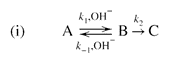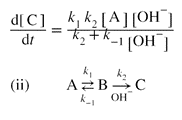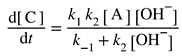ქიმიის ტერმინთა განმარტებითი ლექსიკონი
- ინგლისურ-ქართული
- ქართულ-ინგლისური
- ლექსიკონის შესახებ
- გამოხმაურება

| Kinetic equivalence | კინეტიკური ეკვივალნტობა |
| Two reaction schemes are kinetically equivalent if they imply the same rate law. For example, consider the two schemes (i) and (ii) for the formation of C from A:
|
რეაქციის ორი სქემა კინეტიკურად ეკვივალენტურია, თუ ისინი იმავე სიჩქარის კანონს ემორჩილებიან. მაგალითად, განიხილეთ A-დან C-ს მიღების ორი სქემა (i) და (ii):
|
| Source | წყარო: PAC, 1994, 66, 1077 (Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)) on page 1133 |
|