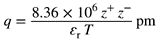ქიმიის ტერმინთა განმარტებითი ლექსიკონი
- ინგლისურ-ქართული
- ქართულ-ინგლისური
- ლექსიკონის შესახებ
- გამოხმაურება

| ion pair | იონური წყვილი |
| A pair of oppositely charged ions held together by Coulomb attraction without formation of a covalent bond. Experimentally, an ion pair behaves as one unit in determining conductivity, kinetic behaviour, osmotic properties, etc. Following Bjerrum, oppositely charged ions with their centres closer together than a distance:
|
საპირისპიროდ დამუხტული იონების წყვილი, რომლებიც ერთმანეთთან დაკავშირებულია კულონური მიზიდულობით კოვალენტური ბმის წარმოქმნის გარეშე. ექსპერიმენტულად, იონური წყვილი იქცევა როგორც ერთი მთლიანი ერთეული გამტარობის, კინეტიკური ქცევის, ოსმოსური თვისებების და ა.შ მიხედვით. ბიერუმის მიხედვით, საპირისპიროდ დამუხტული იონები, რომელთა ცენტრები ერთმანეთთან უფრო ახლოსაა, ვიდრე მანძილი, რომელიც მოცემულია ფორმულით
განიხილება როგორც იონური წყვილი (“ბიერუმის იონური წყვილი“). [z+ და z- არის იონების მუხტის რიცხვითი მნიშვნელობები, εr - გარემოს ფარდობითი შეღწევადობა (ან დიელექტრიკული მუდმივა)]. იონური წყვილი, რომლის შემადგენელი იონები პირდაპირ კონტაქტშია (და არ არის გამოყოფილი შუამავალი გამხსნელით ან სხვა ნეიტრალური მოლეკულით) ეწოდება „მჭიდრო იონური წყვილი“ (ან „კონტაქტური იონური წყვილი“). X+ და Y−-ის მჭიდრო იონური წყვილი სიმბოლურად გამოსახულია როგორც X+Y−. ამის საპირისპიროდ, იონური წყვილი, რომლის შემადგენელი იონები გამოყოფილია ერთი ან რამდენიმე გამხსნელით ან სხვა ნეიტრალური მოლეკულით, აღწერილია როგორც „ფაშარი იონური წყვილი“, სიმბოლურად წარმოდგენილია როგორც X+ || Y−. ფაშარი იონური წყვილის წევრებს შეუძლიათ ადვილად მიმოცვლა სხვა თავისუფალ ან ფაშარად დაწყვილებულ იონებთან ხსნარში. ეს ურთიერთმიმოცვლა შეიძლება აღმოჩენილი იყოს (მაგ. იზოტოპური მარკირებით) და, შესაბამისად, იძლევა ექსპერიმენტულ განსხვავებას მჭიდრო და ფაშარ იონურ წყვილებს შორის. „გამხსნელით გაზიარებულ იონურ წყვილებში“ წყვილის იონური კომპონენტები გამოყოფილია მხოლოდ ერთი გამხსნელის მოლეკულით, ხოლო „გამხსნელით განცალკევებულ იონურ წყვილებში“ ერთზე მეტი გამხსნელის მოლეკულა მონაწილეობს. თუმცა, ტერმინი „გამხსნელით გამოყოფილი იონური წყვილი“ ფრთხილად გამოსაყენებელი და ინტერპრეტირებადია, რადგან ის ასევე ფართოდ გამოიყენება, როგორც ნაკლებად სპეციფიკური ტერმინი „ფაშარი“ იონური წყვილისთვის. |
| See also: common-ion effect | dissociation | ion-pair return | special salt effect | | ასევე იხილეთ: თანამოსახელე იონის გავლენა | დისოციაცია | იონური წყვილის შებრუნება | სპეციალური მარილოვანი ეფექტი | |
Source | წყარო:
|
|