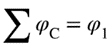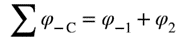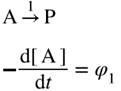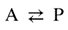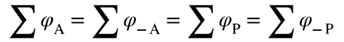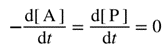ქიმიის ტერმინთა განმარტებითი ლექსიკონი
- ინგლისურ-ქართული
- ქართულ-ინგლისური
- ლექსიკონის შესახებ
- გამოხმაურება

| chemical flux, ϕ | ქიმიური ნაკადი, ϕ |
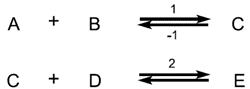
| A concept related to rate of reaction, particularly applicable to the progress in one direction only of component reaction steps in a complex system or to the progress in one direction of reactions in a system at dynamic equilibrium (in which there are no observable concentration changes with time). Chemical flux is a derivative with respect to time, and has the dimensions of amount of substance per unit volume transformed per unit time. The sum of all the chemical fluxes leading to destruction of B is designated the ‘total chemical flux out of B’ (symbol Óϕ-B); the corresponding formation of B by concurrent elementary reactions is the ‘total chemical flux into B or A’ (symbol ÓϕB). For the mechanism:
|
რეაქციის სიჩქარესთან დაკავშირებული კონცეფცია, რომელიც განსაკუთრებით კომპლექსურ სისტემაში კომპონენტის რეაქციის ეტაპების მხოლოდ ერთი მიმართულებით მიმდინარეობის ან დინამიკური წონასწორობის სისტემაში რეაქციების ერთი მიმართულებით მიმდინარეობის (რომელშიც არ არის დაკვირვებადი კონცენტრაციის ცვლილება დროში) აღსაწერად გამოიყენება. ქიმიური ნაკადი არის წარმოებული დროის მიმართ და განზომილებად აქვს დროის ერთეულში გარდაქმნილი ნივთიერების რაოდენობის ფარდობა მოცულობის ერთეულთან. ყველა ქიმიური ნაკადის ჯამი, რომელიც იწვევს B-ს ხარჯვას, მიჩნეულია ″ B-დან ჯამურ ქიმიური ნაკადად″ (სიმბოლო Óϕ-B); B-ს შესაბამისი წარმოქმნა ერთდროული ელემენტარული რეაქციებით არის „B ან A-ში ჯამური ქიმიური ნაკადი″ (სიმბოლო ÓϕB). ქვემოთ მოცემული მექანიზმისათვის:
|
| See also: rate-determining step (rate-limiting step) | | ასევე იხილეთ: სიჩქარის განმსაზღვრელი საფეხური (სიჩქარის მალიმიტირებელი საფეხური) | |
| Source | წყარო: PAC, 1994, 66, 1077 (Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)) on page 1095 |
|