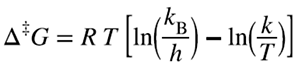ქიმიის ტერმინთა განმარტებითი ლექსიკონი
- ინგლისურ-ქართული
- ქართულ-ინგლისური
- ლექსიკონის შესახებ
- გამოხმაურება

| Gibbs energy of activation (standard free energy of activation), Δ‡Go | გიბსის აქტივაციის ენერგია (სტანდარტული აქტივაციის თავისუფალი ენერგია), Δ‡Go |
| The standard Gibbs energy difference between the transition state of a reaction (either an elementary reaction or a stepwise reaction) and the ground state of the reactants. It is calculated from the experimental rate constant via the conventional form of the absolute rate equation:
where kB is the Boltzmann constant and h the Planck constant (k/h = 2.08358 × 1010 K-1 s-1). The values of the rate constants, and hence Gibbs energies of activation, depend upon the choice of concentration units (or of the thermodynamic standard state). |
გიბსის სტანდარტული ენერგიის სხვაობა რეაქციის გარდამავალ მდგომარეობასა (ელემენტარული რეაქცია ან საფეხურებრივი რეაქცია) და რეაგენტების ძირითადი მდგომარეობებს შორის. იგი გამოითვლება ექსპერიმენტული სიჩქარის მუდმივადან აბსოლუტური სიჩქარის განტოლების ჩვეულებრივი ფორმის მეშვეობით:
სადაც kB არის ბოლცმანის მუდმივა და h პლანკის მუდმივა (k/h = 2.08358 × 1010 K-1 წმ-1). სიჩქარის მუდმივების მნიშვნელობები და, შესაბამისად, გიბსის აქტივაციის ენერგიები, დამოკიდებულია კონცენტრაციის ერთეულების არჩევანზე (ან თერმოდინამიკური სტანდარტულ მდგომარეობაზე). |
| See also: enthalpy of activation, Δ‡H° | entropy of activation, Δ‡S° | | ასევე იხილეთ: აქტივაციის ენთალპია, Δ‡H° | აქტივაციის ენტროპია, Δ‡S° | |
| Source | წყარო: 1.PAC, 1994, 66, 1077 (Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)) on page 1118 2.PAC, 1996, 68, 149 (A glossary of terms used in chemical kinetics, including reaction dynamics (IUPAC Recommendations 1996)) on page 166 |
|