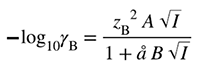ქიმიის ტერმინთა განმარტებითი ლექსიკონი
- ინგლისურ-ქართული
- ქართულ-ინგლისური
- ლექსიკონის შესახებ
- გამოხმაურება

| Debye–Hückel equation | დებაი-ჰიუკელის განტოლება |
| The chemical potential or activity of ions cannot be determined on a purely thermodynamic basis. This is due to the fact that the effects of an ion cannot be separated from the effects of the accompanying counter-ion, or in other terms, the electrochemical potential of the ion cannot be separated into the chemical and the electrical component. Such a separation must necessarily be based on a non- thermodynamic convention. The present convention is based on the assumption that the molal activity coefficient of the chloride ion in dilute aqueous solutions (I < 0.10 mol kg-1) can be estimated by means of the Debye–Hückel equation:
where I is ionic strength, ȥ is the charge number of the ion, å is ion size parameter and A and B are temperature-dependent constants. According to the Bates–Guggenheim convention å B is taken to be at all temperatures and for all compositions of the solutions. |
იონების ქიმიური პოტენციალი ან აქტივობა არ შეიძლება განისაზღვროს წმინდა თერმოდინამიკურ საფუძველზე. ეს გამოწვეულია იმით, რომ იონთა ეფექტები არ შეიძლება განცალკევდეს თანმხლები საწინააღმდეგო იონის ეფექტებისგან. სხვა სიტყვებით რომ ვთქვათ, იონის ელექტროქიმიური პოტენციალი არ შეიძლება დაიყოს ქიმიურ და ელექტრულ მდგენელებად. ასეთი დაყოფა აუცილებლად უნდა ეფუძნებოდეს არათერმოდინამიკურ პირობას. წინამდებარე პირობა ეფუძნება ვარაუდს, რომ ქლორიდის იონის მოლური აქტიურობის კოეფიციენტი განზავებულ წყალხსნარებში (I < 0.10 მოლ კგ-1) შეიძლება შეფასდეს დებაი-ჰიუკელის განტოლებით:
სადაც I არის იონური ძალა, ȥ არის იონის მუხტის რიცხვი, å არის იონის ზომის პარამეტრი, ხოლო A და B - ტემპერატურაზე დამოკიდებული მუდმივები. ბეიტს-გუგენჰაიმის პირობის მიხედვით å B ნამრავლი ითვლება -ის ტოლად ყველა ტემპერატურაზე, ნებისმიერი შემადგენლობის ხსნარისათვის. |
| See also: pH | ასევე იხილეთ: pH |
| Source | წყარო: PAC, 1984, 56, 567 (Physicochemical quantities and units in clinical chemistry with special emphasis on activities and activity coefficients (Recommendations 1983)) on page 569 |
|