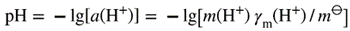| The quantity pH is defined in terms of the activity of hydrogen(1+) ions (hydrogen ions) in solution:
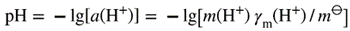
Where a(H+) is the activity of hydrogen ion (hydrogen 1+) in aqueous solution, H+(aq), γm(H+) is the activity coefficient of H+(aq), (molality basis) at molality m(H+), and mɵ = 1 mol kg-1 is the standard molality. |
pH სიდიდე განისაზღვრება წყალბადის (1+) იონების (წყალბადის იონების) აქტიურობის მიხედვით ხსნარში:
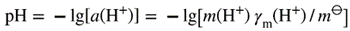
სადაც a(H+) არის წყალბად იონი (წყალბადი 1+) აქტიურობა წყალხსნარში, γm(H+) - H+(წყ)-ის აქტიურობის კოეფიციენტი (მოლალობის საფუძველზე, m(H+) მოლალობაზე და mɵ = 1 მოლი კგ-1 არის სტანდარტული მოლალობა. |
Source | წყარო:
- Green Book, 3rd ed., p. 75
- PAC, 1997, 69, 1007 (Reference value standards and primary standards for pH measurements in D2O and aqueousorganic solvent mixtures: New accessions and assessments (Technical Report)) on page 1007
- PAC, 1996, 68, 957 (Glossary of terms in quantities and units in Clinical Chemistry (IUPAC-IFCC Recommendations 1996)) on page 986
- PAC, 2002, 74, 2169 (Measurement of pH. Definition, standards, and procedures (IUPAC Recommendations 2002)) on page 2169
- PAC, 1990, 62, 2167 (Glossary of atmospheric chemistry terms (Recommendations 1990)) on page 2205
- PAC, 1984, 56, 567 (Physicochemical quantities and units in clinical chemistry with special emphasis on activities and activity coefficients (Recommendations 1983)) on page 569
|