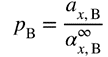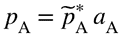| The partial pressure (fugacity) of a solute (B) in a solution is directly proportional to the rational chemical activity (ax) of the solute; this relationship is called Henry”s law:
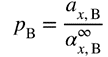
where a∞x,B is the rational solubility coefficient for infinite dilution, i.e. for pure solvent. For the solvent (A) the relationship is called Raoult”s law, and the proportionality factor is the fugacity of the pure solvent, p*A:
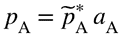
|
გახსნილი ნივთიერების (B) პარციალური წნევა (ფუგაციურობა) ხსნარში პირდაპირპორპორციულია გახსნილი ნივთიერების რაციონალური ქიმიური აქტიურობის (ax); ამ დამოკიდებულებას ჰენრის კანონი ეწოდება.
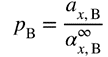
სადაც a∞x,B რაციონალური ხსნადობის კოეფიციენტია უსასრული განზავებისთვის, ანუ სუფთა გამხსნელისთვის. გამხსნელისთვის ამ დამოკიდებულებას ეწოდება რაულის კანონი და პროპორციულობის ფაქტორი არის სუფთა გამხსნელის ფუგატიურობა p*A.
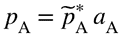
|
Source | წყარო:
- PAC, 1984, 56, 567 (Physicochemical quantities and units in clinical chemistry with special emphasis on activities and activity coefficients (Recommendations 1983)) on page 571
- PAC, 1990, 62, 2167 (Glossary of atmospheric chemistry terms (Recommendations 1990)) on page 2193
- PAC, 1994, 66, 533 (Standard quantities in chemical thermodynamics. Fugacities, activities and equilibrium constants for pure and mixed phases (IUPAC Recommendations 1994)) on page 544
|