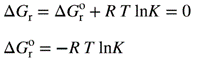ქიმიის ტერმინთა განმარტებითი ლექსიკონი
- ინგლისურ-ქართული
- ქართულ-ინგლისური
- ლექსიკონის შესახებ
- გამოხმაურება

| chemical equilibrium | ქიმიური წონასწორობა |
| Reversible processes [processes which may be made to proceed in the forward or reverse direction by the (infinitesimal) change of one variable], ultimately reach a point where the rates in both directions are identical, so that the system gives the appearance of having a static composition at which the Gibbs energy, G, is a minimum. At equilibrium the sum of the chemical potentials of the reactants equals that of the products, so that:
|
შექცევადი პროცესები [პროცესები, რომლებიც შეიძლება წარიმართოს პირდაპირი ან საპირისპირო მიმართულებით ერთი ცვლადის (უსასრულოდ მცირე) ცვლილებით] საბოლოოდ აღწევს წერტილს, სადაც რეაქციის სიჩქარე ორივე მიმართულებით იდენტურია, ამიტომ სისტემა გამოიყურება, როგორც სტატიკური შედგენილობის მქონე, რომელშიც გიბსის ენერგია G მინიმალურია. წონასწორობისას რეაგენტების ქიმიურ პოტენციალთა ჯამი უდრის პროდუქტებისას, ასე რომ:
|
| Source | წყარო: PAC, 1994, 66, 1077 (Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)) on page 1114 |
|