ქიმიის ტერმინთა განმარტებითი ლექსიკონი
- ინგლისურ-ქართული
- ქართულ-ინგლისური
- ლექსიკონის შესახებ
- გამოხმაურება

| Gibbs energy diagram | გიბსის ენერგიის დიაგრამა |
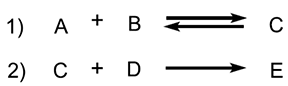
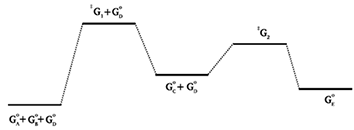
| A diagram showing the relative standard Gibbs energies of reactants, transition states, reaction intermediates and products, in the same sequence as they occur in a chemical reaction. These points are often connected by a smooth curve (a "Gibbs energy profile", commonly still referred to as a "free energy profile") but experimental observation can provide information on relative standard Gibbs energies only at the maxima and minima and not at the configurations between them. The abscissa expresses the sequence of reactants, products, reaction intermediates and transition states and is usually undefined or only vaguely defined by the reaction coordinate (extent of bond breaking or bond making). In some adaptations the abscissas are however explicitly defined as bond orders, Brønsted exponents, etc. Contrary to statements in many text books, the highest point on a Gibbs energy diagram does not necessarily correspond to the transition state of the rate-limiting step. For example, in a stepwise reaction consisting of two reaction steps:
|
დიაგრამა, რომელიც გვიჩვენებს რეაგენტების ფარდობით სტანდარტულ გიბსის ენერგიას, გარდამავალ მდგომარეობებს, რეაქციის შუალედურ და საბოლოო პროდუქტებს, იმავე თანმიმდევრობით, როგორც ეს ხდება ქიმიურ რეაქციაში. ეს წერტილები ხშირად შეერთებულია გლუვი მრუდით (“გიბსის ენერგეტიკული პროფილი“, რომელსაც ჯერ კიდევ უწოდებენ „თავისუფალი ენერგიის პროფილს“), მაგრამ ექსპერიმენტულ დაკვირვებას შეუძლია მოგვცეს ინფორმაცია ფარდობითი სტანდარტული გიბსის ენერგიების შესახებ მხოლოდ მაქსიმუმზე და მინიმუმზე და არა მათ შორის არსებულ კონფიგურაციებში. აბსცისაზე მოცემულია რეაგენტების, შუალედური და საბოლოო პროდუქტების და გარდამავალ მდგომარეობათა თანმიმდევრობა, და, როგორც წესი, განუსაზღვრელია ან მხოლოდ ნაწილობრივ არის განსაზღვრული რეაქციის კოორდინატით (ბმების გაწყვეტის ან წარმოქმნის ხარისხი). თუმცა ზოგიერთ მიახლოებაში აბსცისები ნათლად არის განსაზღვრული, როგორც ბმის რიგები, ბრონსტედის ექსპონენტები და ა. შ. მრავალი სახელმძღვანელოში მოცემულ მტკიცებულებათა მიუხედავად, გიბსის ენერგეტიკული დიაგრამის უმაღლესი წერტილი ყოველთვის არ შეესაბამება სიჩქარის მალიმიტირებელი საფეხურის გარდამავალ მდგომარეობას. მაგალითად, საფეხურებრივ რეაქციაში, რომელიც ორი ეტაპისაგან შედგება:
|
| Source | წყარო: 1.PAC, 1994, 66, 1077 (Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)) on page 1117 2.PAC, 1996, 68, 149 (A glossary of terms used in chemical kinetics, including reaction dynamics (IUPAC Recommendations 1996)) on page 167 |
|