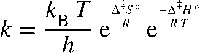ქიმიის ტერმინთა განმარტებითი ლექსიკონი
- ინგლისურ-ქართული
- ქართულ-ინგლისური
- ლექსიკონის შესახებ
- გამოხმაურება

| enthalpy of activation, Δ‡H° | აქტივაციის ენთალპია, Δ‡H° |
The standard enthalpy of activation Δ‡H° is the enthalpy change that appears in the thermodynamic form of the rate equation obtained from conventional transition state theory. This equation is only correct for a first order reaction, for which the rate constant has the dimension reciprocal time. For a second order reaction, for which the rate constant has the dimension (reciprocal time) × (reciprocal concentration), the left hand side should be read as kc° , where c° denotes the standard concentration (usually 1 mol dm-3). The quantity Δ‡S° is the standard entropy of activation, and care must be taken with standard states. In this equation kB is the Boltzmann constant, T the absolute temperature, the h Planck constant, and R the gas constant. The enthalpy of activation is approximately equal to the activation energy; the conversion of one into the other depends on the molecularity. The enthalpy of activation is always the standard quantity, although the word standard and the superscript on the symbol are often omitted. The symbol is frequently (but incorrectly) written ΔH‡, where the standard symbol is omitted and the ‡ is placed after the H. |
აქტივაციის სტანდარტული ენთალპია Δ‡H° არის ენთალპიის ცვლილება, რომელიც თავს იჩენს გარდამავალი მდგომარეობის თეორიიდან გამომდინარე სიჩქარის განტოლებაში (თერმოდინამიკური ფორმა). ეს განტოლება მართებულია მხოლოდ პირველი რიგის რეაქციისთვის, რომლის სიჩქარის მუდმივას აქვს დროის შებრუნებული განზომილება, წმ-1. მეორე რიგის რეაქციისთვის, რომლის სიჩქარის მუდმივას აქვს განზომილება (დროის შებრუნებული განზომილება) × (კონცენტრაციის შებრუნებული განზომილება), მარცხენა მხარე უნდა წავიკითხოთ როგორც kc°, სადაც c° აღნიშნავს სტანდარტულ კონცენტრაციას (ჩვეულებრივ 1 მოლი დმ-3). Δ‡S° სიდიდე არის აქტივაციის სტანდარტული ენტროპია, რის გამოც მხედველობაში მიიღება სტანდარტული მდგომარეობები. ამ განტოლებაში kB არის ბოლცმანის მუდმივა, T - აბსოლუტური ტემპერატურა, h - პლანკის მუდმივა და R - გაზის მუდმივა. აქტივაციის ენთალპია დაახლოებით უდრის აქტივაციის ენერგიას; ერთის მეორედ გარდაქმნა დამოკიდებულია მოლეკულურობაზე. აქტივაციის ენთალპია ყოველთვის არის სტანდარტული სიდიდე, თუმცა სიტყვა სტანდარტი და სიმბოლოზე სტრიქონზედა ნიშანი ხშირად გამოტოვებულია. სიმბოლო ხშირად არასწორად იწერება ΔH‡ ფორმით, სადაც სტანდარტული სიმბოლო გამოტოვებულია და ‡ მოთავსებულია H-ის შემდეგ. |
Source | წყარო:
|
|