STEM ასისტენსი
სათაური:
სითხეების შერევა და ჭარბი მოცულობის შესწავლა
რეზიუმე:
საჭმლის მომზადება, რეცხვა თუ სხვა მრავალი სამრეწველო პროცესი მოითხოვს სითხეების ურთიერთ შერევას. სითხეების შერევის პროცესი დამოკიდებულია სხვადასხვა ფაქტორზე და ზოგჯერ უცნაური შედეგი მოყვება. მაგალითად, თუ რომელიმე ერთი თხევადი ნივთიერების 50 მლ შევურევთ იმავე მოცულობის მეორე თხევად ნივთიერებას, ნარევი ყოველთვის არ იქნება 100 მლ. ეს მოვლენა ცნობილია ნარევების „ჭარბი მოცულობის“ სახელწოდებით. შევისწავლოთ, შეიცვლება თუ არ ჯამური მოცულობა წყლისა და იზოპროპილის სპირტის სხვადასხვა თანაფარდობით შერევის დროს?პროექტის სირთულე:
საგანთა კავშირი:
პროექტის განხორციელებისთვის საჭირო დრო:
1-2 დღესაკითხის მიმოხილვა:
საკვლევი კითხვა:
როგორც იცვლება მოცულობა სხვადასხვა თვისების სითხეების შერევის შედეგად?
შესავალი:
სხვადასხვა სითხის შერევა შეიძლება ყოველდღიურად დაგვჭირდეს. მაგალითად, როცა ვამზადებთ რძიან ყავას, ან სოუსებს სალათებისთვის, ვრეცხავთ სარეცხს, ვიბანთ თავს შამპუნით და სხვა მრავალი. როგორც წესი, ყველაზე ხშირად სითხეების შერევა გვიწევს წყალთან. ამ პროცესების დროს ჩვეულებრივ არ ვფიქრობთ იმაზე, თუ რატომ ერევა კარგად ან ცუდად ესა თუ ის სითხე მეორეს. სამრეწველო პროცესებში კი, როგორიცაა მაგალითად ნავთობის გამოხდა, პოლიმერების დამზადება, თხევადი სარეცხი საშუალებების წარმოება და სხვა, ნივთიერებათა შერევის პარამეტრების კონტროლი აუცილებელია სასურველი პროდუქტის მივიღებისათვის. გასუფთავების სტრატეგიების სწორად შემუშავებისას გარემოს შემსწავლელი მეცნიერებებისთვის მნიშვნელოვანია იმის ცოდნა, თუ როგორ ერევა წყალს თხევადი დამაბინძურებელი სითხეები. ამგვარად, სითხეების შერევის პროცესის ქცევის შესწავლა მნიშვნელოვანია მრეწველობაში და გარემოში მიმდინარე მრავალი პროცესის შესწავლისა და ოპტიმიზაციისთვის.
რა მოხდება თუ სხვადასხვა სითხეს ერთმანეთს შევურევთ? როგორც უკვე აღვნიშნეთ , იგი სხვადასხვა ფაქტორზეა დამოკიდებული. ნივთიერებების ერთმანეთთან შერევა განისაზღვრება მათი შერევადობის უნარით. ზოგიერთი სითხე კარგად ერევა ერთმანეთს და წარმოქმნის ჰომოგენურ ნარევს, რომელსაც ჩვეულებრივ ხსნარებს უწოდებენ. მაგრამ ზოგჯერ სითხეები ერთმანეთს არ ერევა და განშრევება ფენებად. ამ დროს მიიღება ჰეტეროგენული ნარევი.


ცნობილია რომ „მსგავსი იხსნება მსგავსში“. ეს განმარტება გულისხმობს, რომ პოლარული ბუნების გამხსნელებში (მაგალითად წყალში) კარგად იხსნება პოლარული და იონური ნივთიერებები ჰომოგენური ნარევის წარმოქმნით. არაპოლარული გამხსნელები კი კარგად ხსნის არაპოლარული ბუნების ნივთიერებებს. ნივთიერებებს შორის ასეთი სახის ურთიერთქმედებას განსაზღვრავს მოლეკულათშორისი ძალები. ამ ურთიერთქმედების ერთ-ერთი მაგალითია წყალბადური ბმა, რომელიც განაპირობებს წყლის თვისებებს, გვხვდება ცილის სტრუქტურაში და განსაზღვრავს ასევე ბევრი სხვა ნივთიერების წყალში ხსნადობის უნარს. მოლეკულათშორისი ურთიერთქმედება იწვევს ხსნარების უჩვეულო თვისებებს.
საინტერესოა ფაქტი, რომ თუ 50 მლ მოცულობის რომელიმე თხევადი ნივთიერებას შევურევთ იმავე მოცულობის მეორე თხევად ნივთიერებას, მიღებული ნარევი ყოველთვის არ იქნება 100 მლ. როცა ნარევის რეალური მოცულობა ნაკლებია აღებული სითხეების მოცულობების ჯამზე, უწოდებენ „მოცულობის შეკუმშვას“. ამის მიზეზი კი შეიძლება იყოს მოლეკულათაშორისი ურთიერთქმედება. ხშირ შემთხვევაში ეს წყალბადური ბმების წარმოქმნაა კომპონენტებს შორის, რაც იძლევა ნარევის უფრო კომპაქტურ სტრუქტურას. იგი ასევე დამოკიდებულია მოლეკულების ზომებზე და მოლეკულების ფორმებზე. თუ ერთი სითხის მოლეკულები ფარდობითად დიდია მეორე სითხის მოლეკულებზე, პატარა ნაწილაკების იკავებს სივრცეს დიდი ზომის ნაწილაკებს შორის და ნარევი უფრო კომპაქტური ხდება, რაც იწვევს მოცულობის შემცირებას.
მოცემულ სამეცნიერო პროექტში გამოვიკვლევთ თუ რა გავლენას ახდენს ნარევის კომპონენტების თანაფარდობა მიღებული ნარევის მოცულობის ცვლილებაზე. ამისთვის გამოვიყენებთ მოლური წილის განმარტებას, რომელიც განისაზღვრება როგორც მოცემული ნივთიერების (კომპონენტის) მოლების შეფარდება ნარევში შემავალი ყველა ნივთიერების მოლების ჯამთან.
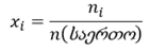
xi – i ნივთიერების მოლური წილი
ni – i ნივთიერების მოლების რიცხვი
n(საერთო) – ყველა კომპონენტის მოლების ჯამი
ამ პროექტში ნარევის მოსამზადებლად გამოვიყენებთ წყალს და იზოპროპილის სპირტს.
აუცილებელია რომ მოცულობები გაიზომოს ძალიან ზუსტად, თითოეული მილილიტრი ძალიან მნიშვნელოვანია!
პროექტში გამოყენებული რესურსები:
 მენზურა 100 მლ-იანი, (2 ცალი) |
 პლასტმასის კონტეინერი ან ქილა დაახლოებით 1 ლ-იანი |
 პასტერის პიპეტები (2 ცალი) |
 სასწორი 0.1 გ სიზუსტით |
 შპატელი ან ხის ჩხირი (დაახლოებით 20 სმ-ის სიგრძის) |
 ქაღალდის ხელსახოცი |
 2 ლ-იანი პლასტმასის ბოთლი ნარჩენებისთვის |
 მარკერი |
 დამცავი სათვალე |
 ხელთათმანი |
 წყალი |
 იზოპროპილის სპირტი, 99%-იანი (900 მლ) |
უსაფრთხოება:
99% იზოპროპილის სპირტი არის ძალიან აალებადი სითხე. შეუძლია გამოიწვიოს თვალის სერიოზული გაღიზიანება. შეინახეთ გრილ ადგილას. მოარიდეთ ნაპერწკლებს, ღია ცეცხლსა და ცხელ ზედაპირის. იმუშავეთ კარგად განიავებად ოთახში და მოერიდეთ ორთქლის შესუნთქვას. დამცავი სათვალისა და ხელთათმანის გარდა, ასევე სასურველი პირბადის გამოყენება.
ექსპერიმენტის პროცედურა:
- პლასტმასის ქილებს, საზომ ცილინდრებს და პასტერის პიპეტებს დააწერეთ „იზოპროპილის სპირტი“ და „წყალი“.
- ჩაასხით სითხეები შესაბამის კონტეინერში და დააყოვნეთ, რომ მიიღოს ოთახის ტემპერატურა.
- სურვილის შემთხვევაში ორივე სითხეში ჩააწვეთეთ სხვადასხვა ფერის საკვები საღებრის ერთი წვეთი. ღია შეფერილი ხსნარების მოცულობის განსაზღვრა უფრო მარტივია. ეს ეტაპი არაა სავალდებულო.
- გაივარჯიშეთ მენზურაში სითხის მოცულობის ათვლაში. მოცულობა უნდა აითვალოთ სითხის ქვედა მენისკის მიხედვით და მენზურა უნდა იყოს მოთავსებული თვალის გასწვრივ.
- ცხრილი 1-ში წარმოდგენილი მონაცემების მიხედვით მოამზადეთ ნარევები იზოპროპილისა და წყლის განსხვავებული თანაფარდობით.
- სასწორზე მეათედების სიზუსტით აწონეთ წყლის და იზოპროპილის სპირტის ცარიელი მენზურები. ჩაიწერეთ მასები რვეულში.
- ქვემოთ ჩამოთვლილი ყველა ეტაპი უნდა გაიმეოროთ თითოეული ნარევისთვის.
- მოამზადეთ #1 ნარევი.
- მოათავსეთ წყლის მენზურა სასწორზე და გაანულეთ.
- ფრთხილად ჩაასხით მენზურაში 5 მლ წყალი და პასტერის პიპეტით მიიყვანეთ ნიშნულამდე.
- ჩაწერეთ წყლის მასა მეათედების სიზუსტით მონაცემთა ცხრილში.
- მოათავსეთ იზოპროპილის სპირტის მენზურა სასწორზე და გაანულეთ.
- ფრთხილად ჩაასხით მენზურაში 50 მლ წყალი და პასტერის პიპეტით მიიყვანეთ ნიშნულამდე.
- ჩაწერეთ იზოპროპილის სპირტის მასა მეათედების სიზუსტით მონაცემთა ცხრილში.
- ფრთხილად გადაიტანეთ წყალი მენზურიდან იზოპროპილის მენზურაში, რომელიც მოთავსებულია სასწორზე. ეცადეთ, რომ არ დაკარგოთ სითხის ერთი წვეთიც კი.
- ჩაიწერეთ ნარევის მასა მეათედების სიზუსტით მონაცემთა ცხრილში.
- ხის ჩხირით მოურიეთ მენზურის შიგთავსს.
- დააყოვნეთ ნარევი, სანამ გაქრება ბუშტუკები. ჩაწერეთ მოცულობა მეათედების სიზუსტით მონაცემთა ცხრილში.
- იგივე ნარევისთვის გაიმეორეთ ზემოთ აღწერილი ეტაპები კიდევ ორჯერ. თითოეული ცდისთვის მოამზადეთ ახალი ცხრილი და შედეგები შეიტანეთ დამატებით ცხრილში.
- ანალოგიურად განსაზღვრეთ #2-6 ნარევების მოცულობა და შეიტანეთ ცხრილში.
- #7-8 არის თანაბარი მოცულობის წყლის ნარევი წყალთან და იზოპროპილის სპირტის ნარევი იზოპროპილის სპირტთან. ამ შემთხვევაში სპირტის მოლური წილი არის 0 და 1.
ცხრილი 1.
| ნარევი # | წყალი (მლ) | იზოპროპილის სპირტი (მლ) | იზოპროპილის სპირტის მოლური წილი (xi) | წყალი (გ) | იზოპროპილის სპირტი (გ) | ნარევის მასა (წყალი + იზოპროპილის სპირტი) (გ) | ნარევის მოცულობა (წყალი + იზოპროპილის სპირტი) (მლ) |
|---|---|---|---|---|---|---|---|
| 1 | 5 | 50 | 0.70 | ||||
| 2 | 10 | 50 | 0.54 | ||||
| 3 | 30 | 50 | 0.28 | ||||
| 4 | 50 | 50 | 0.19 | ||||
| 5 | 50 | 30 | 0.12 | ||||
| 6 | 50 | 10 | 0.045 | ||||
| 7 | 25 + 25 | 0 | 0 | ||||
| 8 | 0 | 25 + 25 | 1 |
მონაცემების ანალიზი:
ცდის დასრულების შემდეგ თქვენ გაანალიზეთ მიღებული შედეგები და შეადარეთ თეორიული მასა და მოცულობა პრაქტიკულად მიღებულ გაზომვის შედეგებს.
- 1-ლი ცხრილის მონაცემების მიხედვით გამოთვალეთ სამი ცდის შედეგად მიღებული ნარევის საშუალო მასა. მიღებულ რიცხვს გამოაკელით მენზურის მასა და შედეგი ჩაწერეთ მე-2 ცხრილში.
- 1-ლი ცხრილის მონაცემების მიხედვით გამოთვალეთ სამი ცდის შედეგად მიღებული ნარევის საშუალო მოცულობა. მიღებული შედეგი ჩაწერეთ მე-2 ცხრილში.
- გამოთვალეთ ნარევის თეორიული მოცულობა. ამისთვის შეკრიბეთ აღებული მოცულობები. მიღებული შედეგი ჩაწერეთ მე-2 ცხრილში.
- გამოთვალეთ ნარევის თეორიული მასა. ამისთვის ჩათვალეთ რომ წყლის სიმკვრივე არის 0.9982 გ/მლ და იზოპროპილის სპირტის 0.7850 გ/მლ (20 °C). მიღებული შედეგი ჩაწერეთ მე-2 ცხრილში.
ცხრილი 2.
| ნარევი # | წყალი (მლ) | იზოპროპილის სპირტი (მლ) | იზოპროპილის სპირტის მოლური წილი (xi) | ნარევის თეორიული მასა (გ) |
ნარევის საშუალო მასა (ცხრილი 1-დან) (გ) |
ნარევის თეორიული მოცულობა (მლ) |
ნარევის საშუალო მოცულობა (ცხრილი 1-დან) (მლ) |
|---|---|---|---|---|---|---|---|
| 1 | 5 | 50 | 0.70 | ||||
| 2 | 10 | 50 | 0.54 | ||||
| 3 | 30 | 50 | 0.28 | ||||
| 4 | 50 | 50 | 0.19 | ||||
| 5 | 50 | 30 | 0.12 | ||||
| 6 | 50 | 10 | 0.045 | ||||
| 7 | 25 + 25 | 0 | 0 | ||||
| 8 | 0 | 25 + 25 | 1 |
- თითოეული ნარევისთვის გამოთვალეთ სხვაობა თეორიულ და პრაქტიკულად მიღებულ საშუალო მასებს შორის. მიღებული შედეგი ჩაწერეთ მე-3 ცხრილში.
- თითოეული ნარევისთვის გამოთვალეთ სხვაობა თეორიულ და პრაქტიკულად მიღებულ საშუალო მოცულობებს შორის. ეს რიცხვი არის ე.წ. „ჭარბი მოცულობა“. მიღებული შედეგი ჩაწერეთ მე-3 ცხრილში.
- „ჭარბი მოცულობას“ ჩვეულებრივ გამოსახავენ როგორც მლ 1 მოლზე (მლ/მოლი). ამისთვის დაგჭირდებათ ნარევში შემავალი კომპონენტების მოლების გამოთვლა. წყლის მოლური მასა არის 18 გ/მოლი, იზოპროპილის სპირტის 60 გ/მოლი. გამოთვლილი მოლები გამოსახეთ მეასედების სიზუსტით.
| ნარევი # | იზოპროპილის სპირტის მოლური წილი (xi) | ნარევის მთლიანი მოლი | მასის სხვაობა (გ) | მოცულობის სხვაობა (მლ) | ჭარბი მოცულობა (მლ/მოლი) |
|---|---|---|---|---|---|
| 1 | 0.70 | ||||
| 2 | 0.54 | ||||
| 3 | 0.28 | ||||
| 4 | 0.19 | ||||
| 5 | 0.12 | ||||
| 6 | 0.045 | ||||
| 7 | 0 | ||||
| 8 | 1 |
- მონაცემთა ვიზუალურად წარმოდგენისთვის შეგიძლიათ გამოიყენოთ გრაფიკები და/ან დიაგრამები.
- გაანალიზეთ მიღებული შედეგები და გამოიტანეთ დასკვნები.
პროექტის ვარიაციები
- დამატებით შეიძლება შეისწავლოთ ცვლილებები წყლისა და იზოპროპილის სპირტის სხვა თანაფარდობებზე.
- შეარჩიეთ რომელიმე ერთი თანაფარდობა და შეისწავლეთ ცვლილებები სხვადასხვა ტემპერატურაზე.
- კიდევ ერთი პარამეტრი, რომელიც შეიძლება გაიზომოს არის ტემპერატურა სითხეების შერევამდე და შერევის შემდეგ. დაგეგმეთ და ჩაატარეთ ექსპერიმენტი ამის შესასწავლად.
- დაგეგმეთ და ჩაატარეთ ექსპერიმენტი სხვა შერევადი თხევადი ნივთიერებების გამოყენებით.
გამოყენებული ლიტერატურა:
Lohner, S. (2023, July 29). Excess Volume: Investigate the "Shrinking Liquids" Effect. Retrieved from https://www.sciencebuddies.org/science-fair-projects/project-ideas/Chem_p036/chemistry/excess-volume-shrinking-liquids
მომზადებულია:
თინათინ ბუთხუზისა და სოფიკო ფაცაციას მიერ







