16.მე-16 ჯგუფის ელემენტები
16.1.ჟანგბადი
კითხვა:
რით აიხსნება ოზონის მოლეკულის პოლარობა და ჟანგბადთან შედარებით მისი მაღალი მჟანგავი უნარი?
პასუხი:
O3-ის მოლეკულის ცენტრალური ატომი იმყოფება sp2-ჰიბრიდულ მდგომარეობაში (2s, 2px-, 2py-ორბიტალები). ცენტრალური ატომის ჰიბრიდული ორბიტალებიდან ორი მონაწილეობს ორი s-ბმის წარმოქმნაში. 2pz-ორბიტალი განლაგებულია სიბრტყის პერპენდიკულარულად და კიდურა ატომის 2pz-ორბიტალთან წარმოქმნის არაპოლარიზებულ p-ბმას. O3-ის მოლეკულას აქვს კუთხური აგებულება (<116.8°). ხასიათდება მცირე პოლარობით. O3-ის მოლეკულა შეიძლება გამოისახოს შემდეგი სტრუქტურული ფორმულით:
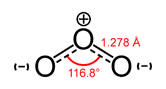
p-ბმის ელექტრონული სიმკვრივე დელოკალიზებულია ატომებზე. ოზონი ხასიათდება პოლარობით და ჟანგბადთან შედარებით უფრო მეტი პოლარიზებადობით. ამით აიხსნება ოზონის უკეთესი ხსნადობა წყალში და ინტენსიური შეფერილობა. ჟანგბადისაგან განსხვავებით, მას ახასიათებს უფრო მაღალი დუღილის ტემპერატურა (-119.9 °C). ოზონი ენდოთერმული, არამდგრადი ნაერთია. ადვილად იშლება ატომური ჟანგბადის წარმოქმნით:
O3 → O2 + O
ამიტომ ოზონი უფრო ძლიერი მჟანგავია, ვიდრე ჟანგბადი. ჩვეულებრივ პირობებში მას შეუძლია დაჟანგოს მრავალი ნაკლებად აქტიური მეტალი (Ag, Hg და სხვა):
8 Ag + 2O3 → 4 Ag2O + O2
ჟანგბადთან შედარებით, ოზონის მაღალ რეაქციისუნარიანობას ადასტურებს მათი ჟანგვა-აღდგენითი პოტენციალის მნიშვნელობების შედარება წყალხსნარებში:
|
O3(აირ.) + H2O(თხ.) + e- → O2(აირ.) + 2OHˉ (ხსნ.) |
E°298= 1.24 ვ |
|
O2(აირ.) + 2H2O(თხ.) + 4 e- → 4 OHˉ(ხსნ.) |
E°298= 0.401 ვ |





