15.მე-15 ჯგუფის ელემენტები
15.1.აზოტი. ფოსფორი
კითხვა:
როგორ ახსნით სხვადასხვა მეტალის ნიტრატის განსხვავებულ ქიმიურ ქცევას გაცხელებისას (დაშლის რეაქციის განსხვავებული მიმართულება)?
პასუხი:
ნიტრატები გახურებით იშლებიან. მიღებული პროდუქტებიდან ერთ-ერთი აუცილებლად ჟანგბადია. ნიტრატების დაშლის სამი განსხვავებული შემთხვევა არსებობს:
- მეტალთა აქტივობის მწკრივში მაგნიუმის ჩათვლით მეტალების ნიტრატები იშლება ნიტრიტის წარმოქმნით და ჟანგბადის გამოყოფით:
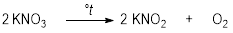
- მაგნიუმიდან დაწყებული Cu-ის ჩათვლით, შესაბამისი ნიტრატების დაშლა მიმდინარეობს მეტალის ოქსიდის წარმოქმნით, NO2-ის და ჟანგბადის გამოყოფით:
2 Cu(NO3)2 → 2CuO + 4 NO2 + O2
- Cu-ის მომდევნო მეტალების ნიტრატები იშლება მეტალების წარმოქმნით, NO2-ის და ჟანგბადის გამოყოფით:
2 AgNO3 → 2 Ag+ 2 NO2 + O2
ნიტრატ-იონი NO3- სქემატურად შეიძლება ასე გამოისახოს:
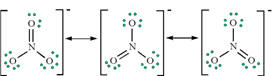
ამ ძალიან გამარტივებულ სქემაში ჟანგბადის ატომები წარმოდგენილია დიპოლების სახით, რომელთა უარყოფითი პოლუსები აზოტის ატომისკენ არის მიმართული. ასეთი სურათი სამართლიანია, რადგან ნიტრატ-იონი კოვალენტური ნაერთია, რომელშიც ელექტრონული სიმკვრივის მაქსიმუმი თავმოყრილია აზოტისა და ჟანგბადის ატომებს შორის სივრცეში. ნიტრატ-იონში ჟანგბადის ატომზე ელექტრონული სიმკვრივე უფრო მეტადაა წანაცვლებული აზოტის ატომისაკენ, ვიდრე ჟანგბადის ნეიტრალური ატომების ან O2--იზოლირებული იონებისა.
Cu(NO3)2-ში Cu2+-ს მცირე რადიუსი და 18-ელექტრონიანი შრე აქვს. ამიტომ ის ხასიათდება მაღალი მაპოლარიზებელი უნარით. გაცხელებისას NO3--ში ადგილი აქვს კონტრპოლარიზაციის ეფექტს.
წარმოვიდგინოთ, რომ ნიტრატ-იონს უახლოვდება საკმაოდ დიდი სიმკვრივის მუხტი, მაგალითად, Cu2+ კატიონი. ჟანგბადის ის ატომი, რომელიც დადებითი მუხტის გავლენის ქვეშ მოექცა, განიცდის პოლარიზაციულ ცვლილებებს და ელექტრონული სიმკვრივე გადაინაცვლებს დადებითი მუხტის წყაროსკენ. შედეგად, ჟანგბადის ამ ატომის პოლარიზაცია ჟანგბადის იმ ატომების პოლარიზაციისგან იქნება განსხვავებული, რომლებიც არ განიცდიან დადებითი მუხტის გავლენას. ჟანგბადის ამ ატომის უარყოფითი პოლუსი ახლა მიმართული იქნება გარე კატიონის მხარეს, ხოლო აზოტის ატომისკენ მიმართული იქნება მისი დადებითი პოლუსი მინიმალური სიმკვრივით:
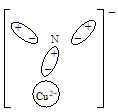
ამგვარად, ხდება პოლუსების გაცვლა, ანუ ჟანგბადის ატომის კონტრპოლარიზაცია. აზოტისა და კონტრპოლარიზებული ჟანგბადის ატომებს შორის ელექტრონული სიმკვრივე მცირდება და კოვალენტური ბმა სუსტდება. ამიტომ ტემპერატურის უმნიშვნელო გაზრდა ბმის გაწყვეტას იწვევს.
KNO3-ში მეტალის კატიონის პოლარიზაციული გავლენა ნიტრატ-იონზე საერთოდ არ ხდება. სამივე ბმა ტოლფასია, იმისდა მიუხედავად, NO3- ანიონში ჟანგბადის მოცემული ატომი ეხება თუ არა K+ კატიონს. გახურება იწვევს N-O ბმების გაწყვეტას ოქსო-ანიონში.
ყველაზე უფრო ღრმა დაშლას გახურებისას განიცდის ვერცხლის ნიტრატი, რადგან მასში, სპილენძ(II)-ის ნიტრატთან შედარებით, უფრო ძლიერად ვლინდება პოლარიზაციის დამატებითი ეფექტი Ag+-ის ელექტრონული გარსის მაღალი ძვრადობის გამო (Ag+ იონის რადიუსი მეტია, ვიდრე Cu2+ იონისა):
2 AgNO3 → 2Ag + 2 NO2 +O2





