1.პირველი (IA) ჯგუფის ელემენტები
1.1.წყალბადი
კითხვა:
რა პროცესებს ეფუძნება მოლეკულური წყალბადის მიღების მეთოდები?
პასუხი:
წყალბადის მიღების ლაბორატორიული ხერხები:
- ზოგიერთ მეტალზე მჟავას მოქმედება: ამ მიზნით, ძირითადად, იყენებენ თუთიას, ხოლო მჟავებიდან - განზავებულ გოგირდმჟავას ან მარილმჟავას (კიპის აპარატში):
Zn + 2HCl → ZnCl2 + H2↑
Zn + 2H+ → Zn2+ + H2 (იონურად)
- კალციუმის მოქმედებით წყალთან:
Ca + 2H2O → Ca(OH)2 + H2↑
- წყლის ელექტროლიზით (ქიმიურად სუფთა წყალბადის მიღება):
![]()
- ელექტროამტარობის გასაზრდელად წყალს გარკვეული რაოდენობით ისეთ ელექტროლიტს უმატებენ, რომელიც არ მონაწილეობს ელექტროლიზის პროცესში, მაგალითად, Na2SO4-ს.
- ტუტის ხსნარის ალუმინთან ან თუთიასთან ურთიერთქმედებით:
2 Al + 2 NaOH + 10 H2O → 2 Na[Al(OH)4(H2O)2] + 3 H2↑
Zn + 2 KOH + 2 H2O → K2[Zn(OH)4] + H2↑
წყალბადის მიღების სამრეწველო ხერხები:
- მეთანის ურთიერთქმედება წყლის ორთქლთან:
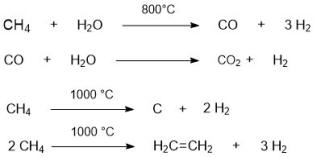
- გავარვარებულ ნახშირზე წყლის ორთქლის გატარება ((ნარევის ე.წ. “წრთობით” –სწრაფი გაცივებით)
![]()
მიღებულ აირთა ნარევს “წყალაირი” ეწოდება, რომლის გახურებულ Fe2O3-ზე გატარებით მიიღება წყალბადის და CO2-ის ნარევი:
![]()
ნარევს ატარებენ წყალში მაღალი წნევის ქვეშ; CO2 მასში იხსნება და მიიღება სუფთა წყალბადი.
- წყლის ორთქლის დაშლა გავარვარებული რკინის ზედაპირზე:
Fe + H2O → FeO + H2↑ (<570 °C)
3 Fe + 4 H2O → Fe3O4 + 4 H2 (>570 °C)
- იონური ჰიდრიდების ურთიერთქმედება წყალთან:
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
- NaCl ან KCl გარკვეული კონცენტრაციის (25-26 %-იანი) წყალხსნარის ელექტროლიზი
(იხ. ქლორი):
2 NaCl + 2 H2O → 2 NaOH + H2↑ + Cl2↑





