ფოიერვერკების ფერთა ქიმია
ახალი წლის ღამეს ფოიერვერკების კაშკაშა და ლამაზი ფერებით იფერება ხოლმე ცა. ფოიერვერკების ფერებს საფუძვლად სხვადასხვა მეტალთა (და მათი იონების) ალის ფერები უდევს საფუძვლად - ძირითადად მეტალთა მარილები გამოიყენება ხოლმე. ალბათ, როდესაც სიტყვა „მარილი“ გესმით, თვალწინ სუფრის მარილი წარმოგიდგებათ ხოლმე, რომელსაც ყოველდღე იყენებთ. რამდენადაც ეს ნივთიერება ერთ-ერთი ტიპის მარილია (ნატრიუმის ქლორიდი), ქიმიაში „მარილს“ გაცილებით ფართო მნიშვნელობით ვიყენებთ. მარილის კლასიკური განსაზღვრება: ნაერთი, რომელიც შედგება მეტალის ატომისა და მჟავას ნაშთისაგან. სხვანაირად, რომ ვთქვათ, მეტალისა და არამეტალის ატომებს შორის იონური ბმის შემცველი ნაერთები. მაშ, როგორ გვაძლევენ ეს ნაერთები ფერთა უზარმაზარ სპექტრს? კიდევ რა არის საჭირო იმისათვის, რომ ფოიერვერკები წარმოიქმნას?
ფოიერვერკის ყველაზე მთავარი კომპონენტი, რა თქმა უნდა, დენთია, რომელიც, აგრეთვე, ცნობილია, როგორც „შავი ფხვნილი“. იგი ჩინელმა ალქიმიკოსებმა აღმოაჩინეს, რომლებიც სინამდვილეში სიცოცხლის ელექსირს ეძებდნენ და აფეთქებებზე არც იყვნენ ორიენტირებულნი. მათ აღმოაჩინეს, რომ თაფლის, გოგირდისა და კალიუმის გვარჯილას (იგივე ნიტრატის) ნარევი მარტივად ალდებოდა.
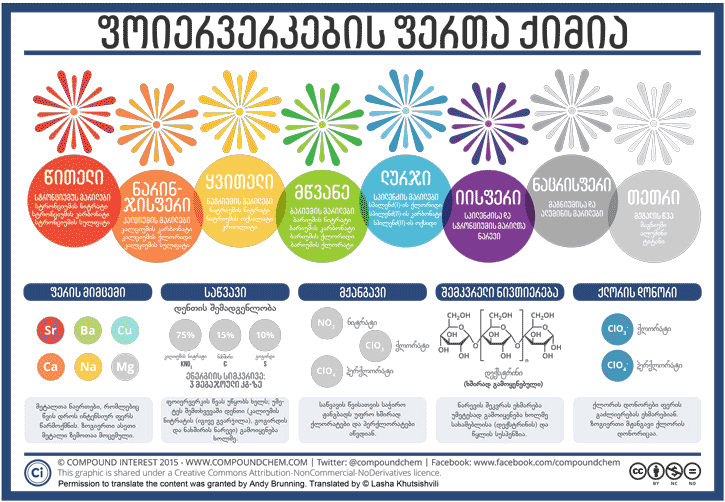
გოგირდისა და კალიუმის ნიტრატის ნარევს მოგვიანებით ნახშირს უმატებდნენ, ნაცვლად თაფლისა - გოგირდსა და ნახშირს რეაქციაში საწვავის როლი აქვთ, ხოლო კალიუმის ნიტრატი მოქმედებს, როგორც მჟანგავი. თანამედროვე „შავ ფხვნილში“ (1781 წლიდან მოყოლებული) კალიუმის ნიტრატის, ნახშირისა და გოგირდის მასური თანაფარდობაა შესაბამისად: 75:15:10.
დენთის წვა ერთი ქიმიური რეაქციით ვერ აღიწერება, რადგან არაერთი პროცესი მიდის ამ დროს. ყველაზე მიახლოებული ქიმიური რეაქციის ტოლობა, რომლის მიხედვითაც დენთი იწვის, ქვემოთაა მოცემული. ნახშირი უმარტივესი (ემპირიული) ფორმულითაა წარმოდგენილი:
6 KNO3 + C7H4O + 2 S → K2CO3 + K2SO4 + K2S + 4 CO2 + 2 CO + 2 H2O + 3 N2
დენთის გრანულების ზომისა და ტენის რაოდენობის ცვლილებით შესაძლებელია საგრძნობლად გაიზარდოს „შავი ფხვნილი“ წვის დრო. ეს ფაქტი პიროტექნიკაში მნიშვნელოვანია.
ისევე როგორც დენთის, ფოიერვერკების შემადგენლობაშიც ე.წ. მაკავშირებელი ნივთიერებაა შერეული. იგი გამოიყენება კომპონენტების ერთ ადგილზე შესაკვრელად. გარდა ამისა, ეს ნივთიერება ხახუნისგან აალების რისკს ამცირებს. ძირითადად ამ როლში ორგანული ნაერთის ერთ-ერთი ფორმა, დექსტრინი, გამოიყენება ხოლმე. დენთის ანთებისთანავე დექსტრინიც იწვის. ამ ორი კომპონენტის გარდა, ფოიერვერკის დასამზადებლად მჟანგავი ნივთიერებაცაა საჭირო იმისათვის, რომ საწვავს ჟანგბადი მიეწოდოს. ამ როლს, როგორც წესი, ნიტრატები, ქლორატები ან პერქლორატები ასრულებენ.
ფოიერვერკის ძირითადი კომპონენტია, აგრეთვე, მეტალის ან მათი მარილების ფხვნილი, რომელთა საშუალებითაც წარმოიქმნება სხვადასხვა ფერის ალი. ეს კომპონენტი ხშირად დაფარული იქნება დენთით იმისათვის, რომ ანთებას შეუწყოს ხელი. წვის რეაქციის შედეგად გამოყოფილი სითბოს საშუალებით მეტალის ატომებში/იონებში არსებული ელექტრონები გადადიან დაბალი ენერგეტიკული შრიდან მაღალ ენერგეტიკულ შრეზე. ეს ე.წ. „აღგზნებული“ მდგომარეობა არაა სტაბილური, ამიტომ ელექტრონები სწრაფად უბრუნდებიან საწყის მდგომარეობას, ანუ ჩადიან დაბალ შრეზე. ამ გადასვლის შედეგად ისინი გამოყოფენ „ჭარბ“ ენერგიას სინათლის სახით. სხვადასხვა მეტალს სხვადასხვა ენერგეტიკული „ნაპრალი“ აქვს, რის გამოც ისინი სხვადასხვა ენერგიის (ანუ ფერის) სინათლეს გამოასხივებენ. ზუსტად იგივე მიზეზით იძლევიან მეტალთა ალის ტესტებზე სხვადასხვა მეტალები სხვადასხვა ფერს, რაც საშუალებას გვაძლევს მათ განსხვავებას. მეტალთა მიერ გამოსხივებული ფერები წარმოდგენილია მოცემულ ინფოგრაფიკაზე.
მაშასადამე, მეტალის ატომია მნიშვნელოვანი, თუმცა ზოგიერთი ნაერთი სხვებზე უპირატესია, მაგ., ჰიგროსკოპულ ნაერთებს (ნივთიერებები, რომლებიც წყალს შთანთქამენ ტენიდანაც კი) ფოიერვერკებში ვერ გამოიყენებ, რადგანაც ისინი ნარევს ტენიანს გახდიან, ხოლო ტენიანი ნივთიერების დაწვა რთულია. ზოგიერთი ნაერთის მიღება სირთულეებთანაა დაკავშირებული, რის გამოც ძვირია. სპილენძის შემცველი ნაერთები მაღალ ტემპერატურაზე არასტაბილურია და ზღვრულ ტემპერატურის მიღწევის შემთხვევაში, ის იშლება, რაც ლურჯ ფერს ვერ წარმოქმნის. ამის გამო ამბობენ, რომ ფოიერვერკის ხარისხი მის მიერ წარმოქმნილი ლურჯი ფერით უნდა განსაზღვრო. იისფერის წარმოქმნაც რთულია, რამდენადაც მისი მიიღება ლურჯწარმომქნელი და წითელწარმომქმნელი ნაერთების საშუალებით ხდება.
იმ შემთხვევაში, თუ უფრო ღრმად გაინტერესებთ ფოიერვერკებთან დაკავშირებული ინფორმაცია, შეგიძლიათ მაიკლ რასელის „ფოიერვერკების ქიმია“ წაიკითხოთ.
ბიბლიოგრაფია და დამატებითი საკითხავი:
- The Chemistry of Fireworks– The Naked Scientists;
- The Chemistry of Pyrotechnics– John A Conkling.
თარგმანი: ლაშა ხუციშვილი





