მჟავები, ტუტეები და pH სკალა
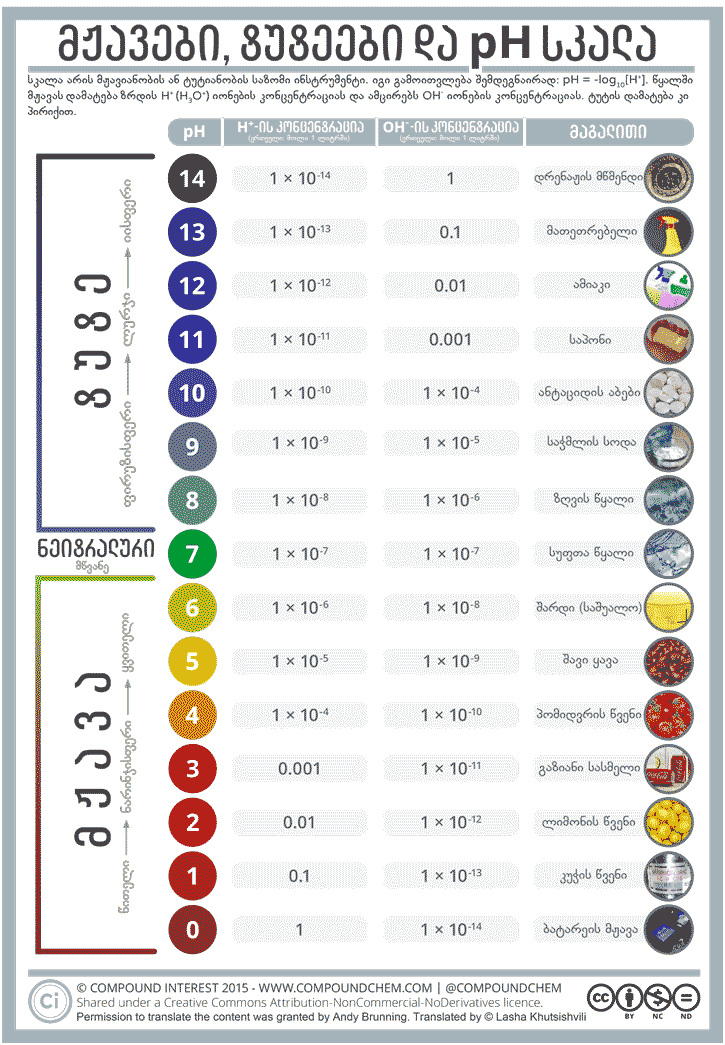
pH სკალა ჩვენთვის ცნობილი სკალაა. უმეტეს ადამიანს, ალბათ, ის ქიმიის გაკვეთილებიდან ახსოვს, ესაა სკალა, რომელიც გამოიყენება, რათა შეფასდეს რამდენად ძლიერი მჟავა/ტუტე არე აქვს ხსნარს. რიცხვები, რომლებიც ფერებს შეესაბამება, pH-ის მნიშვნელობებია, რომლებზეც უნივერსალური ინდიკატორი შესაბამის ფერს იღებს. ბევრ ადამიანს არ ეცოდინება pH-ის უკან მდგომი ქიმია, მაინც საიდან მოვიდა ეს რიცხვები?
სინამდვილეში აღნიშვნაში pH ნაწილობრივ გადმოცემულია მისი შინაარსი. „H“ pH-ში აღნიშნავს ელემენტ წყალბადს. მარტივად რომ ვთქვათ, pH სკალა გვიჩვენებს, თუ რა რაოდენობის წყალბადიონებია ხსნარში: რაც უფრო მეტია წყალბადის კატიონი ხსნარში, მით მცირეა pH. რაც შეეხება „p“-ს pH-ში, იგი ქიმიკოსებისთვის მათემატიკური ოპერაცია ‘-log10’-ს. აღნიშნავს. მაშასადამე, pH უბრალოდ -log10[H+]-ს უდრის (ან -lg[H+]), სადაც [H+] წყალბადის იონის კონცენტრაციაა ხსნარში (შენიშვნა: წყალბადის იონები წყალხსნარში H3O+-ს სახითაა ხოლმე, თუმცა სიმარტივისთვის H+-ს ვწერთ ხოლმე).
თუ ინფოგრაფიკას დააკვირდებით, მიხვდებით, რომ pH-ის ერთი ერთეულით გაზრდა, წყალბადის იონების კონცენტრაციის ათჯერ შემცირებას იწვევს ხსნარში. ეს სკალა ცნობილია, როგორც ლოგარითმული სკალა. რატომ ვიყენებთ საერთოდ ამ მათემატიკურ ოპერაციას მჟავიანობის/ტუტიანობის გამოსასახად? ნათელია, რომ ამ პარამეტრის ერთი რიცხვით დახასიათება გაცილებით მარტივია, ვიდრე რამდენიმეციფრიანი წყალბადის იონის კონცენტრაციების წერა. pH როცა 7-ია, ნიშნავს იმას, რომ ხსნარი ნეიტრალურია (არც მჟავაა და არც ფუძე). თუ pH 7-ის ქვემოთაა, მაშინ ხსნარს მჟავა რეაქცია აქვს, ხოლო თუ pH 7-ზე მეტია, მაშინ - ტუტე რეაქცია.
წყლის ქიმიური ფორმულაა H2O. წყლის მოლეკულას აქვს უნარი დისოცირდეს (გაიხლიჩოს) H+ და OH- (ჰიდროქსიდი) იონებად. ნეიტრალურ ხსნარში მათი კონცენტრაციები ტოლია, მაგრამ საკმარისია, ამ ხსნარს დაამატოთ მჟავა ან ტუტე, მაშინათვე დაირღვევა ეს ბალანსი. მჟავები წყალბად-იონების წყაროა, მათი ხსნარში დამატება იწვევს წყალბადის იონების კონცენტრაციის გაზრდას და ჰიდროქსიდ-იონების კონცენტრაციის შემცირებას. ფუძეებისთვის საპირისპიროა ჭეშმარიტი: ისინი წყალბად-იონების კონცენტრაციას ამცირებენ და ზრდიან ჰიდროქსიდ-იონების კონცენტრაციას.
ბევრმა არ იცის, რომ pH ტემპერატურაზეა დამოკიდებული. მკაცრად: სუფთა წყლის pH 7-ის ტოლია მხოლოდ ‘ოთახის ტემპერატურაზე’ (25˚C). მის ზემოთ და ქვემოთ მჟავიანობა იცვლება, მაგალითად: 100˚C-ზე სუფთა წყლის pH 6.14-ია, ხოლო 0˚C-ზე 7.47. ეს იმას არ ნიშნავს, რომ სუფთა წყალს მჟავა ან ტუტე რეაქცია აქვს ამ ტემპერატურებზე, ეს მხოლოდ იმაზე მიუთითებს, რომ ამ კონკრეტულ ტემპერატურაზე pH სკალის ნეიტრალურობის წერტილი ესაა. აქვე აღსანიშნავია, რომ pH სკალა მხოლოდ 0-14 ინტერვალით არაა შემოსაზღვრული - ზოგიერთი ძლიერი მჟავები ან ტუტეები ამ ზღვრებს სცდება: pH უარყოფითია ან 14-ზე მეტი.
არსებობს კიდევ ერთი მცდარი წარმოდგენა pH-თან და ადამიანის ორგანიზმთან დაკავშირებით. ამ წარმოდგენის მიხედვით, ე.წ. „ტუტოვანი დიეტის“ (შეიძლება შეგხვდეთ „ალკალინური დიეტა“, რაც არასწორი თარგმანია) დროს, თუ თქვენი კვების რაციონში „ტუტე საკვების“ წილს გაზრდით, ორგანიზმში pH-ის მნიშვნელობა მოიმატებს. სინამდვილეში ეს დიეტა გულისხმობს რას, რომ თუ თქვენ ძალიან ბევრ ხილს და ბოსტნეულს მიირთმევთ, არავითარ შემთხვევაში, ეს საზიანო არაა. შეუძლებელია თქვენი ორგანიზმის pH შეცვალოს იმან, რასაც ჭამთ. ამას თავისი მიზეზი აქვს, რომელიც სიტყვა „ჰომეოსტაზში“ ერთიანდება. დეტალებში არ შევალ ამასთან დაკავშირებით, მაგრამ, თუ გაინტერესებთ, მოცემულ ბმულზე შეგიძლია იხილოთ ტუტე დიეტის გაშიფვრა.
კუჭის წვენის pH 1.5-სა და 3.5-ს შორის შეიძლება იყოს, მაგრამ ამას არავითარი გავლენა არ აქვს თქვენი ორგანიზმის pH-ზე, ან უფრო ზუსტად რომ ვთქვათ, სისხლის pH-ზე. ადამიანის სისხლს აქვს სუსტი ტუტე რეაქცია, 7.35-7.45 ინტერვალშია. რომ შეგვეძლოს ჩვენი ორგანიზმის pH-ის შეცვლა ისე, რომ ამ საზღვრებს გასცდეს, საკმაოდ დიდ ზიანს მივაყენებთ ორგანიზმს. pH-ის თუნდაც 0.5-ით შეცვლამ უჯრედის დაზიანება შეიძლება გამოიწვიოს, რომლის აღდგენა შეუძლებელი გახდეს. საბედნიეროდ, საჭმელს, რომლითაც ჩვენ ვიკვებებით, სისხლის pH-ზე გავლენა პრაქტიკულად არ აქვს.
თუმცაღა რასაც მივირთმევთ, შარდის pH-ზე შეიძლება იქონიოს გავლენა. შარდის pH საშუალოდ დაახლოებით 6-ია, მაგრამ ნებისმიერი რიცხვი შეიძლება იყოს 4.5-8.0 ინტერვალიდან. ე.ი., მიუხედავად იმისა, რომ საჭმელს მცირედი გავლენა აქვს შარდის pH-ზე, ეს არ ნიშნავს იმას, რომ სისხლის pH-საც შეცვლის თქვენი კვება.
მაშ, განვაგრძოთ მჟავების სიძლიერეზე საუბრით. მკაცრად: რთულია ესა თუ ის ქიმიური ნაერთი სპეციფიურ წერტილზე დავსვათ pH-ის სკალაზე, რადგანაც მათი ეს წერტილი ცვალებადია იმისდა მიხედვით, თუ რა კონცენტრაციით გვაქვს ხსნარში ეს ნივთიერება. კონცენტრაცია აჩვენებს, თუ რა რაოდენობის ნივთიერებაა გახსნილი მოცემული მოცულობის ხსნარში. თუ მჟავას დიდ რაოდენობას გახსნით შედარებით მცირე რაოდენობის წყალში, მაშინ ვამბობთ, რომ მიღებულ ხსნარს მაღალი კონცენტრაცია აქვს. იგივენაირად, თუ მცირე რაოდენობის მჟავას გავხსნით ბევრ წყალში, მაშინ მიღებულ ხსნარს მცირე კონცენტრაცია ექნება.
ვინაიდან ხსნარის კონცენტრაციის შეცვლა ადვილადაა შესაძლებელი, ერთი და იმავე მჟავის სხვადასხვა ხსნარს სხვადასხვა pH-ის მნიშვნელობა შეიძლება ჰქონდეს, თუმცა, რა თქმა უნდა, ზოგიერთი მჟავა უფრო ძლიერია, ზოგი კი - სუსტი. ქლორწყალბადმჟავა, რომელსაც კუჭის წვენი შეიცავს, მაგალითად, ძლიერი მჟავაა, ადვილად დისოცირდება (იხლიჩება) იონებად. მეორე მხრივ, ძმარმჟავა, რომელსაც ძმარში ვხვდებით, შედარებით სუსტი მჟავაა - ის ადვილად ვერ იხლიჩება იონებად. კიდევ ერთი მაგალითი სუსტი მჟავისა ფთორწყალბადმჟავაა. იმის საწინააღმდეგოდ, რაც არის ნაჩვენები პოპულარულ სერიალში სახელად მძიმე დანაშაული (Breaking bad), ფთორწყალბადმჟავა საკმაოდ სუსტი მჟავაა და, რასაკვირველია, რომ ადამიანის სხეულის გახსნა არ შეუძლია. თუმცა უნდა ითქვას, რომ „არასასიამოვნო“ ნაერთია სხვა მიზეზების გამო (იხ. აქ).
ბიბლიოგრაფია და დამატებითი საკითხავი:
- Amazing alkaline lemons – K Day, The Chronicle Flask;
- A few points on pH – M Leger, Atoms & Numbers;
- This post is pH-balanced for all – M Leger, Atoms & Numbers;
- pH, pOH, and Ka – Bodner Research Web.
თარგმანი: ლაშა ხუციშვილი





