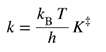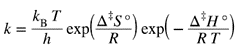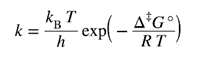| A theory of the rates of elementary reactions which assumes a special type of equilibrium, having an equilibrium constant K‡, to exist between reactants and activated complexes. According to this theory the rate constant is given by:
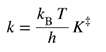
where kB is the Boltzmann constant and h is the Planck constant. The rate constant can also be expressed as:
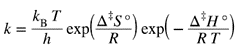
where Δ‡S°, the entropy of activation, is the standard molar change of entropy when the activated complex is formed from reactants and Δ‡H°, the enthalpy of activation, is the corresponding standard molar change of enthalpy. The quantities Ea (the energy of activation) and Δ‡H° are not quite the same, the relationship between them depending on the type of reaction. Also:
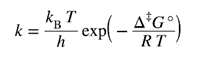
where Δ‡G°, known as the Gibbs energy of activation, is the standard molar Gibbs energy change for the conversion of reactants into activated complex. |
ელემენტარული რეაქციების სიჩქარის თეორია წონასწორობის სპეციალური ტიპის გათვალისწინებით, რომელსაც აქვს წონასწორობის მუდმივა K‡ და არსებობს რეაგენტებსა და გააქტიურებულ კომპლექსებს შორის. ამ თეორიის მიხედვით, სიჩქარის მუდმივა მოცემულია შემდეგი გამოსახულებით:
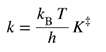
სადაც kB არის ბოლცმანის მუდმივა და h არის პლანკის მუდმივა. სიჩქარის მუდმივა შეიძლება გამოისახოს როგორც:
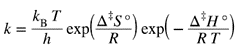
სადაც Δ‡S°, აქტივაციის ენტროპია, არის ენტროპიის სტანდარტული მოლური ცვლილება, როდესაც გააქტიურებული კომპლექსი წარმოიქმნება რეაგენტებისაგან და Δ‡H°, აქტივაციის ენთალპია, არის ენთალპიის შესაბამისი სტანდარტული მოლური ცვლილება. რაოდენობები Ea (აქტივაციის ენერგია) და Δ+H° არ არის მთლად ერთნაირი, მათ შორის დამოკიდებულება განისაზღვრება რეაქციის ტიპით. ასევე:
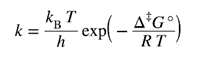
სადაც Δ‡G°, რომელიც ცნობილია როგორც გიბსის აქტივაციის ენერგია, არის სტანდარტული მოლარული გიბსის ენერგიის ცვლილება რეაგენტების გააქტიურებულ კომპლექსად გარდაქმნისათვის. |