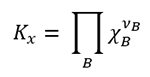ქიმიის ტერმინთა განმარტებითი ლექსიკონი
- ინგლისურ-ქართული
- ქართულ-ინგლისური
- ლექსიკონის შესახებ
- გამოხმაურება

| equilibrium constant | წონასწორობის მუდმივა |
Quantity characterizing the equilibrium of a chemical reaction and defined by an expression of the type where νB is the stoichiometric number of a reactant (negative) or product (positive) for the reaction and χ stands for a quantity which can be the equilibrium value either of pressure, fugacity, amount concentration, amount fraction, molality, relative activity or reciprocal absolute activity defining the pressure based, fugacity based, concentration based, amount fraction based, molality based, relative activity based or standard equilibrium constant (then denoted K°), respectively. |
სიდიდე, რომელიც ახასიათებს ქიმიური რეაქციის წონასწორობას და განისაზღვრება შემდეგი გამოსახულებით: სადაც νB არის რეაგენტების (უარყოფითი) და პროდუქტების (დადებითი) სტექიომეტრული რიცხვი და χ წარმოადგენს რაოდენობას, რომელიც შეიძლება იყოს წნევის, ფუგატიურობის, კონცენტრაციის, ფრაქციის რაოდენობის, მოლალობის, ფარდობითი აქტიურობის ან შებრუნებული აბსოლუტური აქტიურობის წონასწორობის მნიშვნელობა და შესაბამისად, განსაზღვრავს წნევაზე დაფუძნებულ, ფუგატიურობაზე დაფუძნებულ, კონცენტრაციაზე დაფუძნებულ, ფრაქციის რაოდენობაზე დაფუძნებულ, მოლალობაზე დაფუძნებულ, ფარდობით აქტიურობაზე დაფუძნებულ ან სტანდარტულ წონასწორობის მუდმივას (ასეთ შემთხვევაში, გამოიყენება K° აღნიშვნა) |
Source | წყარო:
|
|