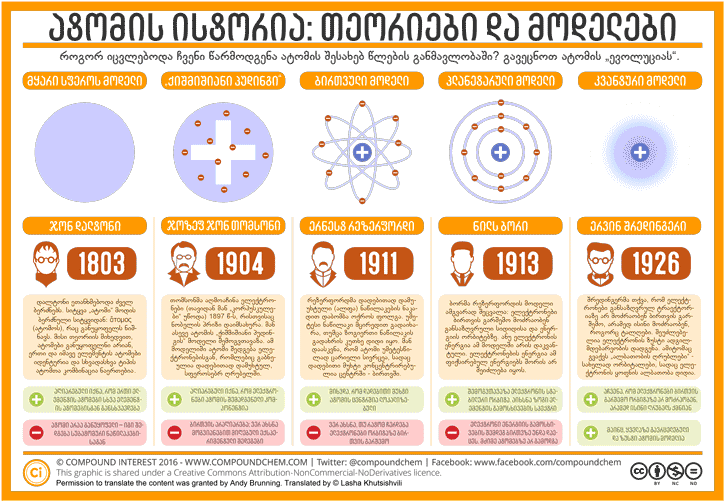
ატომის ისტორია: თეორიები და მოდელები
ნებისმიერი სხეული მატერიას წარმოადგენს. მატერია კი ატომებისაგან შედგება. ესაა ჩვენი მოცემულობა, პირველადი ცნება და ესაა ის, რასაც სკოლაში ვსწავლობთ. მიუხედავად ამისა, ჩვენი იდეები, თუ რა არის, რას წარმოადგენს ატომი, რაოდენ გასაკვირიც არ უნდა იყოს, ახალია: 100 წლის წინაც კი მეცნიერები ჯერ კიდევ კამათობდნენ, თუ როგორ გამოიყურება ატომი. ეს ინფოგრაფიკა მიმოიხილავს ატომთა მოდელების ევოლუციას.
მიუხედავად იმისა, რომ გრაფიკა იწყებს 1800-იანი წლებიდან, ატომის იდეა გაცილებით ადრე გაჩნდა... სიტყვა „ატომი“ მოდის ძველი ბერძნული სიტყვიდან და მისი უხეში თარგმანი არის „განუყოფელი“. ატომის შესახებ იდეას რამდენიმე სხვადასხვა მოაზროვნეს მიაკუთვნებენ ხოლმე, მაგრამ ყველაზე ხშირად დემოკრიტეს (ძვ. წ. 460-370) და მისი მენტორის, ლევკიპუსის, სახელი ჩანს ხოლმე. თუმცაღა მათი იდეა დღევანდელობასთან შედარებით ელემენტარული ცნებით იწყებოდა. მათ აღნიშნეს, რომ ყველაფერი შედგება უმცირესი ნაწილაკებისგან, ატომებისგან, თვალით უხილავი, განუყოფელი (გაყოფა არ შეიძლება) სფეროებისგან, რომლებიც უამრავი ტიპის არსებობს.
მოაზროვნეებს ეგონათ, რომ სხვადასხვა ტიპის ატომი სხვადასხვა ფორმის იქნებოდა. მაგალითად, ისინი ფიქრობდნენ, რომ რკინის ატომებს ჰქონდა კაუჭისებრი ფორმა და ეს კაუჭები ერთმანეთზე იყო გადაბმული, რითაც ხსნიდნენ რკინის სიმყარეს ოთახის ტემპერატურაზე. აგრეთვე წარმოედგინათ, რომ წყლის ატომები გლუვი და სრიალა იყო, რაც ხსნიდა იმას, რომ წყალი ოთახის ტემპერატურაზე სითხეა. დღესდღეობით, რასაკვირველია, ვიცით, რომ ეს ასე არაა, თუმცა მათმა იდეებმა ჩაუყარა საფუძველი მომავალ ატომის მოდელებს.
უნდა ითქვას, რომ დიდი ხანი დასჭირდა ამ პროცესს. 1803 წლამდე ინგლისელი ქიმიკოსის, ჯონ დალტონის, მეტს არავის მოუფიქრებია, რომ ჩამოეყალიბებინა ატომის უფრო მეცნიერული განსაზღვრება. მან თავისი იდეა დააფუძნა ძველი ბერძნების იდეაზე, რომ ატომები არის უმცირესი, განუყოფელი ნაწილაკები, რომლებიც მყარ სფეროს წარმოადგენენ და რომ ერთი და იმავე ელემენტის ატომები იდენტურია. ეს ბოლო წინადადება მეტნაკლებადაა მართალი, რადგან აღნიშნული წესი სხვადასხვა ელემენტის იზოტოპებზე არ ვრცელდება, რამდენადაც ერთი და იმავე ელემენტის იზოტოპებს განსხვავებული ნეიტრონების რაოდენობა აქვთ. თუმცღა, რადგანაც ნეიტრონების არსებობა 1932 წლამდე არ დადასტურდა, ალბათ დალტონს ეს შეცდომა შეგვიძლია ვაპატიოთ. მან, აგრეთვე, შემოგვთავაზა თეორიები, თუ როგორ ერთდებიან ატომები ერთმანეთთან და ახალ ნაერთებს წარმოქმნიან. მან აგრეთვე ქიმიური ელემენტთა სიმბოლოების პირველი თაობა შემოგვთავაზა:

დალტონის ატომური თეორია მხოლოდ დასაწყისი იყო. იგი თვით ატომის ბუნებაზე არაფერს ამბობდა. დალტონის შემდეგ ატომის თემასთან დაკავშირებით დიდი ხანი არავის უმუშავია. იყო რაღაც მცდელობები, რომ აღეწერათ, თუ როგორ გამოიყურება ატომი (მაგალითად, ლორდ კელვინის იდეა, რომ ატომებს ტორნადოსნაირი სტრუქტურა აქვთ), მაგრამ მე-20 საუკუნის დასაწყისამდე პროგრესი ამ მიმართულებით არ ყოფილა.
პირველი მზის შუქი 1800-იანი წლების ბოლოსკენ გამოჩნდა, როდესაც ინგლისელმა ფიზიკოსმა, ჯოზეფ ჯონ თომსონმა ექსპერიმენტულად დაადასტურა, რომ ატომი განუყოფელი არაა, როგორც ადრე იყო მიღებული. მან გამოიყენა კათოდური მილაკი, რომელშიც უარყოფითად დამუხტული ნაწილაკების ნაკადი/სხივი გადიოდა. აღმოჩნდა, რომ ეს სხივი მიიზიდებოდა დადებითად დამუხტული მეტალის მიერ, ხოლო უარყოფითად დამუხტული მეტალისგან განიზიდებოდა. აქედან დაასკვნა, რომ სხივი უარყოფითად უნდა ყოფილიყო დამუხტული.
სხივში შემავალი ნაწილაკების მასა რომ გაზომა, აღმოჩნდა, რომ ეს ნაწილაკები 2000-ჯერ უფრო მსუბუქი იყო, ვიდრე წყალბადის ატომი. კათოდური მილაკის მეტალურ კორპუსს ცვლიდა სხვა მეტალებით. აქედან დაასკვნა, რომ სხვა ელემენტებიც შედგებიან უარყოფითად დამუხტული ნაწილაკებისგან. მან აღმოაჩინა ელექტრონი (თუმცა თომსონმა თავიდან მას „კორპუსკულები“ უწოდა) და დაამტკიცა, რომ ატომები განუყოფელნი არ არიან, რომ ისინი შედგებიან კიდევ უფრო მცირე შემადგენელი ნაწილ(აკ)ებისაგან. თომსონმა ნობელის პრემია მიიღო 1906 წელს ამ აღმოჩენისთვის.
1904 წელს მან თავისი ატომის მოდელი დახვეწა თავისი კვლევების საფუძველზე. ახალ მოდელს დაერქვა (თომსონს არ დაურქმევია ეს სახელი): „ქიშმიშიანი პუდინგის მოდელი“. ამ მოდელის მიხედვით, ატომი არის დადებითად დამუხტული სფერო, რომელშიც ელექტრონები განაწილებულია ისე, როგორც ქიშმიში პუდინგში. მეცნიერებმა დაიწყეს ატომის შიგნეულობის გარკვევა, თუმცა თომსონის მოდელმა არც ისე დიდხანს გასტანა. სწორედ თომსონის ერთ-ერთი სტუდენტის ექსპერიმენტებმა მიაბარა ისტორიას აღნიშნული მოდელი.
ერნესტ რეზერფორდი იყო ახალ ზელანდიელი სტუდენტი, რომელიც კემბრიჯის უნივერსიტეტში სწავლობდა თომსონის ხელმძღვანელობით. რეზერფორდის მოგვიანებით გამოქვეყნებულმა კვლევებმა (მანჩესტერის უნივერსიტეტი) ატომის ახალი მოდელის შექმნას ჩაუყარა საფუძველი. ეს კვლევები გამოაქვეყნა მას შემდეგ, რაც 1908 წელის ნობელის პრემია დაიმსახურა ქიმიაში რადიოაქტიურ ნივთიერებებზე კვლევისთვის.
რეზერფორდმა ჩაატარა ექსპერიმენტი, რომელიც მოიცავდა ოქროს თხელი ფოლგის დაბომბვას დადებითად დამუხტულ ალფა ნაწილაკებით. ალფა ნაწილაკებს იმდენად მცირე ზომა აქვთ, რომ ოქროს ფოლგაში გაძვრნენ. თომსონის მოდელის მიხედვით, წესით, დადებითი მუხტი მთელ ატომში უნდა ყოფილიყო გადანაწილებული, ამიტომაც ალფა ნაწილაკები საერთოდ არ უნდა (ან მცირედ) გადახრილიყვნენ. ამ ექსპერიმენტის საშუალებით რეზერფორდი ფიქრობდა, რომ თომსონის მოდელს დაადასტურებდა, მაგრამ მოხდა საპირისპირო.
ექსპერიმენტის დროს ალფა ნაწილაკების რაღაც ნაწილი გადიოდა ფოლგაში გადაუხრელად ან მცირე გადახრით, მაგრამ ალფა ნაწილაკების ნაწილი დიდი კუთხით გადაიხარა საწყისი პოზიციიდან. ეს მოულოდნელი იყო; როგორც რეზერფორდი აღწერს: „გასაოცარი შედეგი იყო. წარმოიდგინე, რომ 15-ინჩიანი ტყვია ესროლო თხელ ქსოვილს, ქსოვილმა აისხლიტოს და შენ, დამკვირებელს, მოგხვდეს“. ერთადერთი შესაძლო ახსნა ამ ექსპერიმენტის იყო ის, რომ დადებითი მუხტი, ნაცვლად იმისა, რომ განაწილებული იყოს ატომის მთელ სივრცეში, კონცენტრირებულია ცენტრში - ბირთვში. ატომის დარჩენილი ნაწილი უმეტესად უბრალო ცარიელი სივრცეა.
რეზერფორდის მიერ ბირთვის აღმოჩენა ნიშნავდა, რომ ატომის მოდელს სჭირდებოდა გადაკეთება. მან შემოგვთავაზა მოდელი, რომელშიც ელექტრონები დადებითად დამუხტული ბირთვის გარშემო ორბიტაზე მოძრაობენ. რა თქმა უნდა, ეს თომსონის მოდელის განვითარება იყო, მაგრამ ამან ვერ ახსნა, თუ როგორ ახერხებდნენ ელექტრონები ორბიტაზე დარჩენას, ნაცვლად იმისა, რომ ბირთვზე დაცემულიყვნენ.
ნილს ბორი იყო დანიელი ფიზიკოსი, რომელმაც რეზერფორდის მოდელის პრობლემების აღმოფხვრა სცადა. მან შეამჩნია, რომ კლასიკური ფიზიკის კანონები ვერ ხსნიდა, თუ რა ხდებოდა ატომურ დონეზე. ამიტომაც კვანტური თეორია შემოიღო ელექტრონების განაწილების ასახსნელად. მან ივარაუდა, რომ ატომში თითოეულ ელექტრონს განსაზღვრული ენერგია აქვს და ეს ელექტრონები ენერგეტიკულ დონეებზე მოძრაობენ. სხვანაირად რომ ვთქვათ, ელექტრონების ენერგია დაკვანტულია/დისკრეტულია და ყველა მნიშვნელობას ვერ მიიღებს. ელექტრონებს შეუძლიათ ერთი ენერგეტიკული დონიდან გადავიდნენ მეორე ენერგეტიკულ დონეზე (ამ დონეებს ბორი „სტაციონალურ მდგომარეობას“ ეძახდა), მაგრამ ამ პროცესში აუცილებლად უნდა გამოასხივონ ან შთანთქონ ენერგია.
ბორის სტაბილური ენერგეტიკული დონეების იდეა ელექტრონების ბირთვის გარშემო მოძრაობის პრობლემასთან რაღაც დოზით დაკავშირდა. ზუსტი მიზეზები რთულად ასახსნელია, რადგანაც კვანტური მექანიკის კომპლექსურ სამყაროს უკავშირდება. როგორც ბორმა თქვა: „კვანტურმა მექანიკამ შენი შოკირება თუ არ მოახდინა, ჯერ ბოლომდე არ გაგიგია“. სხვა სიტყვებით რომ ვთქვათ, მიკროსკოპულ ზომებზე ყველაფერი უცნაურია.
ბორის მოდელმა ატომური მოდელის ყველა პრობლემა ვერ გადაჭრა. ის წყალბადის ატომისთვის მშვენივრად მუშაობდა, მაგრამ წყალბადზე მძიმე ელემენტებისთვის ეს მოდელი არ მუშაობს. ბორის მოდელი, აგრეთვე, არ ემორჩილება ჰაიზენბერგის განუსაზღვრელობის პრინციპს, კვანტური მექანიკის უმნიშვნელოვანეს ქვაკუთხედს, რომლის მიხედვითაც შეუძლებელია დადგინდეს ელექტრონის ზუსტი ადგილმდებარეობა და იმპულსი. მაინც, აღნიშნული პრინციპის პოსტულატი ჩამოყალიბდა ბორის ატომური მოდელის გამოქვეყნებიდან რამდენიმე წლის შემდეგ. მიუხედავად ამ ყველაფრისა, ბორის ატომური მოდელს, ალბათ, ყველაზე მეტად იცნობთ, რადგან იგი სკოლის ქიმიის კურსში პროგრამულად გათვალისწინებულია. ამ მოდელს თავისი გამოყენებაც აქვს; ბორის მოდელის მიხედვით ადვილია ქიმიური ბმებისა და ზოგიერთი ჯგუფის ელემენტების რეაქციისუნარიანობის ახსნა მარტივ დონეზე.
ყოველ შემთხვევაში მოდელს მაინც სჭირდებოდა დახვეწა. ამ დროს უკვე ბევრი მეცნიერი მუშაობდა და იკვლევდა ატომის კვანტურ მოდელს. მეცნიერებს შორის თავი გამოიჩინა ერვინ შრედინგერმა, რომლის სახელიც ალბათ მანამდე გაგონილი გაქვთ (ეს ის კაცია, კატას რომ სვამს ყუთში). 1926 წელს შრედინგერმა შემოგვთავაზა: ნაცვლად იმისა, რომ ელექტრონები მოძრაობენ განსაზღვრულ ორბიტებზე და განსაზღვრულ შრეებზე, ელექტრონებს ტალღისთვის დამახასიათებელი თვისება აქვთ. რა თქმა უნდა, ეს ცოტა უცნაურად ჟღერს, მაგრამ ალბათ ის გაგიგიათ, რომ სინათლეს აქვს ნაწილაკის და ტალღის თვისებაც (ეს ცნობილია, როგორც „ტალღურ-ნაწილაკური დუალიზმი“) აღმოჩნდა, რომ ელექტრონებსაც აქვთ ეს ორმაგი ბუნება.
შრედინგერმა გამოიყვანა მათემატიკური განტოლებები, რათა ატომში ელექტრონების განაწილება აღეწერა. მისი მოდელის მიხედვით, ბირთვის გარშემო არის გარვეული ელექტრონული სიმკვრივის მქონე ღრუბელი. ამ ღრუბლებს ეწოდებათ „ალბათობის ღრუბლრბი“. მიუხედავად იმისა, რომ ზუსტად არ ვიცით სად არის ელექტრონი, ჩვენ შეგვიძლია შევაფასოთ ელექტრონის ყოფნის ალბათობა გარკვეულ წერტილში. სივრცის იმ ნაწილს, სადაც ელექტრონის ყოფნის ალბათობა მაღალია, ორბიტალი ეწოდება.
ალბათ გასაგებია, თუ რატომ არ იწყება ატომის აგებულება პირდაპირ ამ მოდელით... ამ მოდელის გაგებას ცოტა მეტი დრო სჭირდება!
შრედინგერის მოდელი ატომის ევოლუციური ხაზის ბოლო წერტილი არ იყო. 1932 წელს ინგლისელმა ფიზიკოსმა, ჯეიმს ჩედვიკმა (ერნესტ რეზერფორდის სტუდენტმა), დაადასტურა ნეიტრონის არსებობა, რამაც შეავსო სურათი სუბატორმური ნაწილაკებისა, რომლისგანაც ატომი შედგება. ამბავი აქაც არ მთავრდება; მას შემდეგ ფიზიკოსებმა აღმოაჩინეს, რომ პროტონები და ნეიტრონები შედგებიან კიდევ უფრო მცირე ნაწილაკებისგან - კვარკებისგან, მაგრამ ეს ამ პოსტის თემას ცდება! სამართლიანი იქნება, თუ ვიტყვი, რომ ატომის მოდელი ერთ-ერთი საუკეთესო მაგალითია იმსა, თუ როგორ შეიძლება შეიცვალოს მეცნიერული მოდელები ისტორიის განმავლობაში და როგორ შეიძლება ახალმა კვლევებმა/შედეგებმა/ექსპერიმენტებმა/„სამხილებმა“ საფუძველი ჩაუყაროს ახალ მოდელებს.
ბიბლიოგრაფია და დამატებითი საკითხავი:
- The development of the atomic model – R Allain, Wired;
- Models of the atom – M Fowler;
- History and philosophy of science through models: some challenges in the case of the atom (£) – R Justi and J Gilbert.
თარგმანი: ლაშა ხუციშვილი