ჟანგბადი
ჟანგბადი არის ელემენტთა პერიოდულობის ცხრილში ჰალკოგენიდების ჯგუფის წევრი ელემენტი. ჟანგბადთან ერთად ამ ჯგუფის წევრები არიან: გოგირდი , სელენი, ტელური და პოლონიუმი. მისი რიგითი ნომერია 8 და გამოისახება სიმბოლოთი O (ლათ. Oxygenium) . ჟანგბადი ქიმიურად აქტიური არამეტალია და წარმოადგენს ყველაზე მსუბუქ ელემენტს ჰალკოგენიდების ჯგუფში.
მარტივი ნივთიერება ჟანგბადი, ნორმალურ პირობებში უფერო, უგემო და უსუნო გაზია, რომლის მოლეკულაც შედგება ჟანგბადის ორი ატომისაგან (ფორმულა O2). თხევადი ჟანგბადი არის ღია ცისფერი შეფერილობის, ხოლო გამყარებული ჟანგბადი წარმოადგენს ღია ლურჯი ფერის კრისტალებს. სამყაროში მასის მიხედვით ყველაზე გავრცელებული ელემენტია წყალბადისა და ჰელიუმის შემდეგ, ხოლო დედამიწის ქერქში ყველაზე გავრცელებულია მასის მიხედვით. იგი ჰაერის მოცულობის 20.9% შეადგენს.
ცოცხალი ორგანიზმები, რომლებიც ძირითადად შედგებიან პროტეინების, ნახშირწყლების და ცხიმებისაგან, შეიცავენ ჟანგბადს. ჟანგბადი შედის ცხოველების ქსოვილების, კბილების, ძვლების შემადგენლობაში. ჟანგბადი ადამიანის ორგანიზმში ~ 65%-ია.
ჟანგბადი O2-ის ფორმით გამოიყოფა წყლისაგან ციანობაქტერიების საშუალებით, ზღვის წყლისა და მცენარეებისაგან ფოტოსინთეზის დროს. ყოველი ცოცხალი ორგანიზმი ჟანგბადს იყენებს სუნთქვისათვის. ჟანგბადი ტოქსიკურია ანაერობული ორგანიზმებისათვის (ორგანიზმებისათვის, რომლებიც ცხოვრობენ თავისუფალი ჟანგბადის გარეშე), რომლებიც დომინირებდნენ დედამიწაზე ადრეულ ცხოვრებაში, სანამ O2 დაიწყებდა დაგროვებას.
ჟანგბადის ალოტროპი - ოზონი, ნორმალურ პირობებში ცისფერი ფერის გაზია სპეციფიკური სუნით, რომლის მოლეკულაც შედგება ჟანგბადის სამი ატომისაგან (ფორმულა O3). ოზონის ფენა იცავს ბიოსფეროს ულტრაიისფერი რადიაციისაგან . ძალიან მაღალ სიმაღლეზე ჟანგბადი მნიშვნელოვანი რაოდენობითაა ატომური სახით და იგი იწვევს საფრენი საშუალებების ეროზიას.
ჟანგბადი პირველად სუფთა სახით მიიღო კარლ ვილჰელმ შეელემ (1773 წ) და მისგან დამოუკიდებლად ინგლისელმა ქიმიკოსმა ჯოზეფ პრისტლიმ (1774 წ).
ჟანგბადის თვისებებს სწავლობდა ა. ლავუაზიე, რომელმაც დაადგინა, რომ იგი ჰაერის შემადგენელი ნაწილია, შედის მჟავებისა და სხვა მრავალი ნივთიერების შემადგენლობაში. მან ჟანგბადს ”მჟავას წარმომქმნელი” უწოდა. ჟანგბადი მიიღება თხევადი ჰაერის ფრაქციული გამოხდით, ასევე ღებულობენ წყლის ელექტროლიზით და სხვა. ჟანგბადს იყენებენ ფოლადის, პლასტმასების, ქსოვილების წარმოებაში, ასევე ჟანგბადო-თერაპიაში.
დახასიათება

ჟანგბადის განმუხტვის მილაკი (სპექტრი)
სტანდარტულ წნევასა და ტემპერატურაზე ჟანგბადი უსუნო, უფერო გაზია, მოლეკულური ფორმულით O2, რომელშიც ჟანგბადის ორი ატომი ქიმიურად უკავშირდება ერთმანეთს სპინ-ტრიპლეტური კონფიგურაციით. ატომებს შორის ბმის რიგი არის ორის ტოლი. ტრიპლეტური ჟანგბადი (არ უნდა გავაიგივოთ ოზონთან O3) არის O2-ის მოლეკულის მდგომარეობა დედამიწაზე. მოლეკულის ელექტრონულ კონფიგურაციას აქვს ორი გაუწყვილებელი ელექტრონი, რომელიც გვხვდება ორ რეგენირებულ ორბიტალზე, ეს ორბიტალები კლასიფიცირდება როგორც ანტიკავშირი (ანტიბმა) და ამდენად ორატომიანი ჟანგბადი უფრო სუსტად უკავშირდება ერთმანეთს, ვიდრე ორატომიანი აზოტი სამმაგი ბმით.
ნორმალურ ტრიპლეტურ ფორმაში O2-ის მოლეკულები პარამაგნიტურია - ისინი იძენენ მაგნიტურობას მაგნიტურ ველში. ეს განპირობებულია ჟანგბადის მოლეკულაში გაუწყვილებელი ელექტრონების არსებობით - ორი სავალენტო ელექტრონი არ არის გაწყვილებული. იგი ბირადიკალია ე.ი. მოლეკულაში მეზობლად არსებობს ორმაგი ბმა და ორი გაუწყვილებელი ელექტრონი.
ბუნებაში სინგლეტური ჟანგბადი ჩვეულებრივ წარმოიქმნება ფოტოსინთეზის დროს მზის ენერგიის ხარჯზე. იგი აგრეთვე წარმოიქმნება ტროპოსფეროში ოზონზე სინათლის მოკლე ტალღების მოქმედებით მიმდინარე ფოტოლიზის შედეგად და იმ იმუნოსისტემების მიერ, რომელიც წარმოადგენს აქტიური ჟანგბადის წყაროს.
გავრცელება
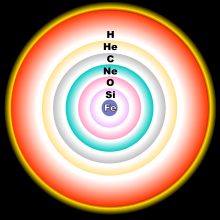
16O კონცენტრაცია O-სფეროში,
17O - H-სფეროში, 18O He-სფეროში.
ჟანგბადი ყველაზე გავრცელებული ელემენტია მასის მიხედვით ჩვენს ბიოსფეროში (ჰაერი, ზღვა და ხმელეთი). ჟანგბადი მესამე ქიმიური ელემენტია გავრცელების მიხედვით მთელ სამყაროში წყალბადის და ჰელიუმის შემდეგ. მზის მასის 0.9%-მდე არის ჟანგბადი. ჟანგბადი 49.2% არის დედამიწის ქერქში მასის მიხედვით და მსოფლიო ოკეანეების ძირითადი (88.8% მასის მიხედვით). ჟანგბადი არის მეორე ადგილზე დედამიწის ატმოსფეროში, იკავებს 21%-ზე მეტს მოცულობით და 23.1% მასის მიხედვით (~ 1015 ტონა). მზის სისტემაში დედამიწაზე არის ჟანგბადის ყველაზე მაღალი კონცენტრაცია ატმოსფეროში. აგრეთვე არის მარსზე (0.1% O2 მოცულობით) და ვენერაზე უფრო დაბალი კონცენტრაციით. ამდენად, ჟანგბადი, რომელიც არის სხვა პლანეტებზე ულტრაიისფერი რადიაციის მოქმედებით ნახშირბადის ოქსიდის გახლეჩის შედეგად მიიღება.
დედამიწაზე ჟანგბადის მაღალი კონცენტრაცია ჟანგბადის ციკლის შედეგია. ეს ბიოქიმიური ციკლი აღწერს ჟანგბადის მოძრაობას დედამიწის სამ ძირითად რეზერვუარს შორის და მათ შიგნით. ესენია: ატმოსფერო, ბიოსფერო და ლითოსფერო. ჟანგბადის ციკლის ძირითადი ფაქტორია ფოტოსინთეზი, რომელიც ათავისუფლებს ჟანგბადს ატმოსფეროში.
იზოტოპები და ვარსკვლავთა წარმოშობა
ჟანგბადი, რომელიც ბუნებაში გვხვდება შედგება სამი სტაბილური იზოტოპისაგან: 16O, 17O და 18O, რომელთაგან 16O არის ყველაზე მეტად გავრცელებული (99.762%). 16O უმეტესი ნაწილი ვარსკვლავებზე სინთეზდება ჰელიუმის შელღობის პროცესის ბოლოს. მაგრამ ზოგიერთი მიიღება ნეონის წვის პროცესში. 17O უპირატესად მიიღება წყალბადის წვით ჰელიუმში CNO ციკლის განმავლობაში. უმეტესი ნაწილი 18O-ისა წარმოიქმნება მაშინ, როცა 14N (მიღებული CNO ციკლის წვისას) შებოჭავს 4He მოლეკულას და 18O წარმოიქმნება ვარსკვლავთა ჰელიუმით მდიდარ ზონებში.
ჟანგბადის თოთხმეტი რადიოიზოტოპია დახასიათებული, რომელთაგან ყველაზე მდგრადი 15O-ის ნახევარდაშლის პერიოდია 122.24 წმ და 14O - ნახევარდაშლის პერიოდია 70.606 წმ. დანარჩენი რადიოაქტიური იზოტოპის ნახევარდაშლის პერიოდი 27წმ-ზე ნაკლებია. 16O-ზე მსუბუქი იზოტოპები იშლებიან β+-ით და იძლევიან აზოტს, ხოლო 18O-ზე მძიმე იზოტოპები ბეტა დაშლით იძლევიან ფთორს.
ალოტროპიები
ჟანგბადი წარმოქმნის ორ ალოტროპიულ მოდიფიკაციას: ნივთიერება ჟანგბადი - 02 და ოზონი - 03.
ელემენტ ჟანგბადის დედამიწაზე გავრცელებულ ალოტრიპიას უწოდებენ ორატომიან ჟანგბადის მოლეკულას O2. მისი ბმის სიგრძეა 121 ნმ, ხოლო ბმის ენერგია კი - 498კჯ მოლი-1. აღნიშნული ფორმა გამოიყენება სიცოცხლისათვის, სუნთქვისათვის და წარმოადგენს დედამიწის ატმოსფეროს მთავარ ნაწილს.
ოზონი
ოზონი ჟანგბადის ალოტრიპიული სახესხვაობაა. მისი მოლეკულა შედგება ჟანგბადის სამი ატომისაგან (O3). მოლეკულას კუთხური აღნაგობა აქვს, ბმებს შორის კუთხე 117°-ია. p ბმის ელექტრონული სიმკვრივე დელოკალიზებულია ჟანგბადის სამივე ატომზე.
ოზონი (ბერძნ. Ozon - სუნის მქონე) ჟანგბადისაგან თვისებებით ძლიერ განსხვავდება. იგი მოცისფრო, დამახასიათებელი სუნის მქონე, ჟანგბადზე 1.5-ჯერ მძიმე აირია. წყალში მცირედ იხსნება, მაგრამ უკეთ ვიდრე ჟანგბადი. ტოქსიკურია. ოზონი უმეტესად არის სტრატოსფეროში. იგი წარმოიქმნება ჭექა-ქუხილის დროს ელექტრული განმუხტვით ან ულტრაიისფერი სხივების მოქმედებით ჰაერის ჟანგბადზე, ამიტომ ვერცხლისწყალ-კვარცის ნათურის მახლობლად იგრძნობა ოზონის სუნი. ჟანგბადის ოზონად გარდაქმნის რეაქცია გამოისახება შემდეგნაირად:
3O2 + 68 კკალ (285კჯ) → 2O3
ოზონი ყოველთვის წარმოიქმნება ჟანგბადის ბირადიკალის მიღების დროს. იგი არამდგრადი, ენდოთერმული ნაერთია და ადვილად იშლება. ოზონის მოლეკულისგან ჩამოცილებული ჟანგბადის ატომი განაპირობებს ჟანგბადთან შედარებით მის უფრო ძლიერ ჟანგვით უნარს - იგი ძლიერი დამჟანგველია, ჟანგავს ისეთ ნივთიერებებს, რომლებთანაც ჩვეულებრივ პირობებში ჟანგბადი არ ურთიერთქმედებს, მაგალითად ვერცხლი:
2 Ag + O3 → Ag2O + O2
ოზონი გამოიყენება წყლის და ჰაერის გასასუფთავებლად, ასევე კვების მრეწველობაში, როგორც ბაქტერიოციდური საშუალება და სხვა.
მართალია ოზონი ატმოსფეროში მცირე რაოდენობითაა (10% მოცულობით), მაგრამ ძალზედ დიდია მისი როლი - იგი უზრუნველყოფს სიცოცხლის პირობებს დედამიწაზე, შთანთქავს ულტრაიისფერ გამოსხივებას, რომელიც დიდი რაოდენობით საზიანოა ცოცხალი ორგანიზმისათვის. გარდა ამისა ოზონის დაშლის დროს გამოყოფილი ენერგია ხელს უწყობს ატმოსფეროს ზედა ფენებში შედარებით მაღალი ტემპერატურის შენარჩუნებას. თუმცა დედამიწის ზედაპირთან ახლოს იგი გაჭუჭყიანებულია ავტომობილების გამონაბოლქვის გამო. ჟანგბადის ოთხი ატომის შემცველი მეტასტაბილური იზოტოპი (O4) აღმოჩენილ იქნა 2001 წელს და იგი ჩათვალეს მყარი ჟანგბადის ექვსიდან ერთ-ერთ ფაზად. ეს დადასტურებულ იქნა 2006 წელს, როდესაც აღნიშნული ფაზა მიიღეს O2-ის შეკუმშვით 20 გპა-ზე. იგი იყო O8 დაჯგუფების რომბოედრი, რომელიც უფრო ძლიერი დამჟანგველია, ვიდრე O2 ან O3 და ამიტომაც მას იყენებენ საწვავად რაკეტებში. მეტალური ფაზა აღმოჩენილ იქნა 1990 წელს, როდესაც მყარ ჟანგბადზე იმოქმედეს 96გპა-ზე მეტი წნევით და როგორც 1998 წელს იქნა ნაჩვენები - ძალიან დაბალ ტემპერატურაზე, ეს ფაზა გახდა სუპერგამტარი.
ფიზიკური თვისებები
ჟანგბადი უფერო, უსუნო აირია. წყალში უმნიშვნელოთ იხსნება. თუმცა უფრო მეტად ვიდრე აზოტი. წყალში ჟანგბადის ხსნადობა დამოკიდებულია ტემპერატურაზე. ჰაერზე ოდნავ მძიმეა (ρ= 1.43გ/სმ3). დუღილის ტემპერატურაა - 183°C. თხევადი და მყარი ჟანგბადი ცისფერია. მყარი ჟანგბადი მაგნიტურ თვისებებს ამჟღავნებს.
ჟანგბადი კონდენსირდება 90.20K (-182.95°C, -277.31F) და იყინება 54.36K (-218.79°C, -361.82F). ორივე თხევადი და მყარი O2 არის გამჭვირვალე, ღია ცისფერი. ძალიან სუფთა თხევადი O2 მიიღება თხევადი ჰაერის ფრაქციული გამოხდით. ჰაერიდან მიღებული ჟანგბადი მინარევების სახით ჩვეულებრივად შეიცავს აზოტსა და ინერტულ აირებს.
ბიოლოგიური როლი

ოქსიდები, მაგალითად რკინის ოქსიდი, წარმოიქმნებიან ჟანგბადის ურთიერთქმედებით მეტალებთან

ჟანგბადის ტოქსიკურობა ვლინდება მაშინ, როცა ფილტვებში ხვდება იგი მაღალ წნევაზე (ნორმალურ პარციალურ წნევასთან შედარებით)
ბუნებაში, თავისუფალი ჟანგბადი წარმოიქმნება მზის სხივების მოქმედებით, ჟანგბადური ფოტოსინთეზის დროს, წყლის გახლეჩით. მწვანე ტალღები და ზღვის ციანობაქტერიები ზღვის არეში აწარმოებენ 70%-მდე თავისუფალ ჟანგბადს, ხოლო დანარჩენი იწარმოება დედამიწის მცენარეული საფარის მიერ.
უმარტივესი ფოტოსინთეზის ფორმულა ასეთია:
6 CO2 + 6 H2O + ფოტონური → C6H12O6 + 6 O2
ჟანგბადი - ადამიანისთვის სასიცოცხლოდ აუცილებელი ელემენტია. მის გარეშე ორგანიზმის უჯრედებში ვერც ერთი ბიოქიმიური რეაქცია და პროცესი ვერ მიმდინარეობს - ჟანგბადი უზრუნველყოფს ორგანიზმს მათი ფუნქციონირებისთვის აუცილებელი ენერგიით.
მოლეკულური O2 აუცილებელია აერობული ორგანიზმების სუნთქვისათვის. იგი გამოიყენება მიტოქონდრიებში ადენოზინტრიფოსფატის (ატფ) აღდგენისას ჟანგვითი ფოსფორილილების დროს. ჟანგბადი შეიწოვება ფილტვებში და სისხლის წითელ უჯრედებში, მას იკავშირებს ჰემოგლობინი, რომლის ფერი მოწითალოდან იცვლება კაშკაშა წითელ ფერამდე. ერთ ლიტრ სისხლს შეუძლია გახსნას 200 სმ3 ჟანგბადი.
ჟანგბადი უდიდესი მნიშვნელობის მარტივი ნივთიერებაა, ურომლისოდაც წარმოუდგენელია სიცოცხლე. ჟანგბადის მონაწილეობით ხორციელდება უმნიშვნელოვანესი სასიცოცხლო პროცესი - სუნთქვა. სუნთქვის დროს ორგანიზმში მიმდინარეობს ნელი ჟანგვა. გამოყოფილი ენერგია ორგანიზმის ცხოველქმედებას ხმარდება. ჟანგბადი ასევე დიდ როლს ასრულებს ბუნებაში მიმდინარე ჟანგვისა და ლპობის პროცესებში. ჟანგბადში წყალბადის, აცეტილენის წვისას ვითარდება ძლიერ მაღალი ტემპერატურა (~ 3000°C ), ამიტომ ეს პროცესი გამოყენებულია მეტალების საჭრელად და შესადუღებლად.
თხევადი ჟანგბადისა და ფოროვანი საწვავი ნივთიერებების (ხის ნახშირი, ხის ფქვილი, ტორფი) ნარევი ე.წ. ოქსილიქვიდები გამოიყენება ასაფეთქებელ საშუალებებად მადნების მოპოვებისას, რკინიგზის ლიანდაგების, ჯებირების, გვირაბების მშენებლობის დროს. იგი აგრეთვე გამოიყენება სარაკეტო საწვავებში.
ჟანგბადი გამოიყენება მედიცინაში - ავადმყოფებისათვის სუნთქვის გაადვილების მიზნით. ჟანგბადი წარმატებით გამოიყენება როგორც ქიმიურ მრეწველობაში (გოგირდმჟავას, აზოტმჟავას წარმოება) ასევე მეტალურგიულ პროცესებში. ფოლადის გამოდნობისას დიდ ეფექტს იძლევა ჰაერის ნაწილობრივი ან მთლიანი შეცვლა ჟანგბადით, რადგან ამ დროს ხდება არა მხოლოდ პროცესის ინტენსიფიკაცია, არამედ მიღებული ფოლადის ხარისხის გაუმჯობესება.
ნაერთები
ჟანგბადის თითქმის ყველა ცნობილ ნაერთში მისი დაჟანგულობის ხარისხი არის -2. დაჟანგულობის ხარისხი -1 გვხვდება მრავალ ისეთ ნაერთში, როგორიცაა პეროქსიდები (H2O2). არის ნაერთები, რომლებშიც ჟანგბადი ავლენს სხვადასხვა დაჟანგულობის ხარისხს: -1/2 (სუპეროქსიდები O-2), -1/3 (ოზონიდები), +1/2 (დიოქსიგენიდები), +1 (დიოქსიგენდიფტორიდები) და +2 (ოქსიგენდიფტორიდები).
ოქსიდები და სხვა არაორგანული ნაერთები
წყალი (H2O) არის წყალბადის ოქსიდი და ჟანგბადნაერთებს შორის ყველაზე ცნობილი ნაერთია. წყლის მოლეკულაში წყალბადის ატომები კოვალენტური ბმით უკავშირდება ჟანგბადს, მაგრამ აგრეთვე მას აქვს უნარი დამატებით მიიზიდოს (23.3კჯ მოლი-1 წყალბად ატომზე) სხვა მოლეკულებისაგან მეზობელი ჟანგბადის ატომი. ეს წყალბადური ბმა წყლის მოლეკულებს ხდის დაახლოებით 15%-ით უფრო მჭიდროდ დაკავშირებულს, ვიდრე ეს მოსალოდნელი იყო მარტივ სითხეში, მხოლოდ ვან-დერ-ვაალსის ძალებით დაკავშირების შემთხვევაში.
მისი ელექტროუარყოფითობიდან გამომდინარე ჟანგბადი წარმოქმნის ბმებს თითქმის ყველა სხვა ელემენტთან მაღალ ტემპერატურაზე და იძლევა შესაბამის ოქსიდებს. თუმცა ზოგიერთი ელემენტი ადვილად წარმოქმნის ოქსიდებს წნევისა და ტემპერატურის სტანდარტულ პირობებში. ამის მაგალითია რკინის დაჟანგვა ჰაერზე. მეტალების ალუმინის და ტიტანის ზედაპირი იჟანგება ჰაერზე და ფარავს მათ ზედაპირს ოქსიდის თხელი ფენით და ამდენად აპასიურებს მეტალებს და ამცირებს მათ შემდგომ კოროზიას. ზოგიერთი გარდამავალი მეტალი ბუნებაში ნაპოვნია როგორც არასტექიომეტრული ნაერთები, სადაც მეტალის რაოდენობა უმნიშვნელოდ ნაკლებია, ვიდრე ამას ქიმიური ფორმულა გვიჩვენებს. მაგალითად ბუნებაში გვხვდება FeO, რომელიც ასე ჩაიწერება Fe1- xO, სადაც x ჩვეულებრივ ≈ 0.05.
ჟანგბადი ნაერთის სახით გვხვდება ატმოსფეროში ნახშირბადის დიოქსიდის (CO2) სახით. დედამიწის ზედაპირის დიდი ნაწილი შედგება დიდი რაოდენობით სილიციუმის ოქსიდისაგან (SiO2, რომელიც გვხვდება გრანიტის და ქვიშის სახით), ალუმინისაგან (ალუმინის ოქსიდი Al2O3 ბოქსიტებსა და კორუნდში), რკინისაგან (რკინის (III)ოქსიდი Fe2O3, ჰემატიტსი და ჟანგში) და სხვა მეტალებისაგან.
დედამიწის ზედაპირის დანარჩენი ნაწილი აგრეთვე წარმოადგენს ჟანგბადის შენაერთებს, ეს არის კალციუმის კარბონატი (კირქვის სახით) და სილიკატები (მინდვრის შპატში). წყალში ხსნადი სილიკატები Na4SiO4, Na2SiO3, და Na2Si2O5-ის სახით. გამოიყენებიან, როგორც დეტერგენტები და ადგეზიდები.
ჟანგბადი აგრეთვე შედის გარდამავალი მეტალების ლიგანდებში და წარმოქმნის მეტალ–O2 ბმას ირიდიუმის ატომთან ვისკას კომპლექსში [IrCl(CO)[P(C6H5)3]2.], პლატინასთან PtF6-ში და რკინასთან, რომელიც მოთავსებულია ჰემოგლობინის ჯგუფის ჰემის ცენტრში.

წყალი არის ერთ–ერთი ყვლაზე გავრცელებული ჟანგბადშემცველი ნივთიერება
ატფ–შიჟანგბადის მასური წილი
40%–ს აღემატება
ორგანული ნაერთები და ბიომოლეკულები
ორგანული ნაერთების მნიშვნელოვან კლასს, რომლებიც შეიცავენ ჟანგბადს არიან: ალკოჰოლები (R-OH); მარტივი ეთერები (R-O-R); კეტონები (R-CO-R); ალდეჰიდები (R-CO-H); კარბოქსი მჟავები (R-COOH); რთული ეთერები (R-COO-R); მჟავათა ანჰიდრიდები (R-CO-O-CO-R); და ამიდები (R-C(O)-NR2) (სადაც R - ორგანული ჯგუფია). ბევრი მნიშვნელოვანი ორგანული გამხსნელია, რომელიც შეიცავს ჟანგბადს, მათ შორის: აცეტონი, მეთანოლი, ეთანოლი, იზოპროპანოლი, ფურანი, ტეტრაჰიდროფურანი (ტჰფ), დიეთილ ეთერი, დიოქსანი, ეთილაცეტატი, დიმეთილფორმამიდი (DMF), დიმეთილსულფოქსიდი(DMSO), ჭიანჭველმჟავა და ძმარმჟავა. აცეტონი ((CH3)2CO) და ფენოლი (C6H5OH) გამოიყენება როგორც საწყისი მასალა ბევრი სხვადასხვა ნივთიერების მისაღებად. სხვა მნიშვნელოვანი ნაერთები, რომლებიც შეცავენ ჟანგბადს არიან: გლიცერინი, ფორმალდეჰიდი, გლუტარალდეჰიდი,ლიმონმჟავა,აცეტანჰიდრიდი და აცეტამიდი. ეპოქსიდები წარმოადგენენ მარტივ ეთერებს, რომლებშიც ჟანგბადი სამატომიანი ბირთვის ნაწილია.
ჟანგბადი სპონტანურად უერთება ბევრ ორგანულ ნივთიერებას ოთახის ტემპერატურაზე, ამ პროცესს ეწოდება ავტოჟანგვა. ჟანგბადის შემცველი ორგანული ნაერთების უმეტესობა არ არის მიღებული უშუალოდ ჟანგბადთან (O2) შეერთებით. ორგანული ნაერთები მნიშვნელოვანია ინდუსტრიაში და კომერციულ საქმიანობაში, ისინი მიიღებიან პრეკურსორების პირდაპირი დაჟანგვით. ასეთებია ეთილენის ოქსიდი და ზეძმარმჟავა.
ბიომოლეკულაში ნაპოვნი ელემენტი არის მნიშვნელოვანი სიცოცხლისათვის. მხოლოდ ძალიან მცირე ნაწილი ბიომოლეკულებისა, როგორიცაა სკვალენი და კაროტინი არ შეიცავს ჟანგბადს. ორგანულ ნაერთებში ნახშირწყლები შეიცავენ ჟანგბადს დიდი რაოდენობით მასის მიხედვით. ყველა ცხიმი, ცხიმოვანი მჟავები, ამინომჟავები და პროტეინები შეიცავენ ჟანგბადს. ჟანგბადი აგრეთვე გვხვდება ფოსფატ (PO3−4) ჯგუფებში ბიოლოგიურად მნიშვნელოვანი ატფ-ის და ადფ-ის მოლეკულაში, ხერხემლის ძვალში, პურინებში (ადენინის გარდა), დნმ-ის და რნმ-ის პურინიმიდებში, აგრეთვე ძვლებში კალციუმის ფოსფატის სახით.
უსაფრთხოება და ტოქსიკურობა
აირადი ჟანგბადი (O2 ) შეიძლება გახდეს ტოქსიკური გაზრდილი პარციალური წნევის დროს, რომელსაც მივყავართ კონვულსიამდე (კრუნჩხვები) და ჯანმრთელობის სხვა პრობლემებამდე. ჟანგბადით მოწამლვა ჩვეულებრივ ხდება მაშინ, როდესაც პარციალური წნევა 50კპა-ზე მეტია. ამიტომ ჟანგბადის მიწოდება სამედიცინო პრაქტიკაში ხდება ჟანგბადის ნიღბებით, რომლის დროსაც O2 მიეწოდება 30% მოცულობით. (≈30 კპა სტანდარტულ პირობებში). იყო შემთხვევები, როცა დღენაკლული ახალშობილების ინკუბატორში, სადაც ჰაერი გამდიდრებული იყო ჟანგბადით, ჩვილების უმეტესობა დაბრმავდა. ამიტომ აღნიშული ეს პრაქტიკა შეწყდა.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით



