აზოტი
აზოტი ქიმიური ელემენტია, რომლის სიმბოლოა N, მისი ატომური ნომერია 7 და ატომური მასა 14. ელემენტური აზოტი უფერო, უსუნო, უგემო ინერტული გაზია. სტანდარტულ პირობებში დედამიწის ატმოსფეროს 78.08% იკავებს.
ელემენტი აზოტი აღმოჩენილ იქნა 1772 წელს შოტლანდიელი ფიზიკოსის დანიელ რეზერფორდის მიერ.
მრავალი ინდუსტრიულად მნიშვნელოვანი პროდუქტი, როგორიცაა აზოტმჟავა, ამიაკი, სასუქები, ორგანული ნიტრატები და ციანიდები შეიცავენ აზოტს. აზოტი გვხვდება ყველა ცოცხალ ორგანიზმში. იგი წარმოადგენს ამინომჟავებში (და შესაბამისად ცილებში) შემავალ ერთ-ერთ სასიცოცხლოდ მნიშვნელოვან ელემენტს. აზოტი ასევე შედის ნუკლეინმჟავებში (დნმ და რნმ). იგი თითქმის ყველა ნეიროტრანსმითერების ქიმიურ სტრუქტურაში არსებობს, გვხვდება ალკალოიდებში, რომელიც ბიოლოგიურად წარმოიქმნება ბევრ ორგანიზმში.
ისტორია
აზოტი (ლათინურად nitrogenium) ცნობილია, რომ 1772 წელს აღმოჩინა დანიელ რეზერფორდმა, რომელსაც მან მავნე ანუ ფიქსირებული აირი უწოდა. შემდგომში დაადგინეს, რომ აზოტი შედიოდა ჰაერის შემადგენლობაშიც, თუმცა კარგად არ იყო შესწავლილი მე-18 საუკუნის ბოლომდე. აზოტი იმავე პერიოდში ასევე შეისწავლა კარლ ვილჰელმ შეელემ, ჰენრი კავენდიშმა და ჯოზეფ პრისტლიმ, რომლებიც აღმოაჩინეს, რომ იგი არ იწვოდა და იყო ფიზიოლოგიური მნიშვნელობის გაზი. ანტონ ლავუაზიე მას უწოდებდა "mephitic air" (ჟანგბადის არ შემცველ აირს ანუ აზოტს, ბერძნულად - უსიცოცხლოს). ექსპერიმენტების დროს აზოტის არეში მოთავსებული ცხოველები კვდებოდნენ.
ალქიმიკოსები აზოტმჟავას იცნობდნენ, როგორც aqua fortis (ძლიერი წყალი). აზოტმჟავასა და ქლორწყალბადმჟავას ნარევი, ცნობილია როგორც aqua regia (სამეფო წყალი), რომელსაც აქვს უნარი გახსნას ოქრო.
აზოტის ნაერთები ადრეული პერიოდიდან გამოიყენება შეიარაღებაში, მრეწველობასა და სოფლის მეურნეობაში (ნატრიუმის და კალიუმის ნიტრატები). 1910 წელს ლორდ რელეიმ (Lord Rayleigh) აღმოაჩინა, რომ აზოტში ელექტრული განმუხტვა წარმოშობს ”აქტიურ აზოტს”. ივარაუდება, რომ მისი ყველა ალოტროპი ერთატომიანია. მუქი ბრილიანტის ყვითელი ნათება მიიღება მისი ურთიერთქმედებით ვერცხლისწყალთან და წარმოიქმნება ფეთქებადი ვერცხლისწყლის ნიტრიდი.
გავრცელება
აზოტი ყველაზე ფართოდ გავრცელებული ელემენტია დედამიწის ატმოსფეროში (78.082% მოცულობით და 75.3% წონითი პროცენტი მშრალ ჰაერში). იგი წარმოიქმნება ვარსკვლავებზე მიმდინარე მასების ლღობის პროცესში. მასის მიხედვით სამყაროში გავრცელებულ ელემენტებს შორის აზოტი მე-7 ადგილზეა.
მოლეკულური აზოტი და აზოტის შენაერთები ასტრონომების მიერ აღმოჩენილია ვარსკვლავშორის სივრცეში შორეული ულტრაიისფერი სპექტროსკოპიული გამოკვლევების საშუალებით. მთვარის ატმოსფერო ძირითადად მოლეკულური აზოტისაგან შედგება. პლანეტების ატმოსფეროში იგი კვალის სახით გვხვდება.
აზოტი არსებობს ყველა ცოცხალ ორგანიზმში, პროტეინებში, ნუკლეინმჯავებსა და სხვა ნაერთების სახით. იგი შეადგენს მცენარეთა საფარის მშრალი წონის ≈ 4%, ხოლო ორგანიზმის ≈ 3%. აზოტი დიდი რაოდენობითაა ცხოველთა გადამუშავებულ პროდუქტებში შარდოვანაში, შარდმჟავაში და ამიაკის ნაწარმებში. აზოტი გვხვდება მრავალ მინერალში, როგორიცაა ნატრიუმის ნიტრატი, კალიუმის ნიტრატი, ამონიუმის ქლორიდი. ბევრი მათგანი არ არის გავრცელებული ბუნებაში მათი წყალში ხსნადობის გამო.
იზოტოპები
არსებობს აზოტის ორი მდგრადი იზოტოპი 14N და 15N, რომელთაგან უფრო გავრცელებულია 14N (99.634%). ეს იზოტოპები წარმოიქმნენ CNO ვარსკვლავების ციკლში. ათი იზოტოპი მიიღება სინთეზურად. 13N-ის ნახევარდაშლის პერიოდია ათი წუთი, ხოლო დანარჩენებისა კი - წამზე ნაკლები.
დედამიწის ატმოსფეროში არსებული მოლეკულური აზოტი ძირითად წარმოადგენს 14N2-ს, ხოლო იზოტოპოლოგიური 14N და 15N-ის რაოდენობა არ აღემატება 0.73%-ს .
რადიოიზოტოპი 16N წარმოიქმნება 16O-დან (წყალში) (n,p) - რეაქციების გავლით. მისი ნახევარდაშლის პერიოდი ძალიან მცირეა ≈7.1წმ და მისი გადასვლა უკან 16O-ში ხდება მაღალ ენერგიული გამა რადიაციით (5-7 მეგა ვოლტი).
თვისებები
აზოტი არამეტალია. მისი ელექტროუარყოფითობა ტოლია 3.04. იგი გარე სავალენტო შრეზე შეიცავს ხუთ ელექტრონს და ამიტომაც უმეტეს ნაერთებში იგი სამვალენტიანია. აზოტის მოლეკულაში აზოტის ატომებს შორის არსებული სამმაგი ბმა მტკიცეა, რაც განაპირობებს აზოტის ინერტულობას. რთულია, N2-ის სხვა ნაერთში გადაყვანა, მაშინ როდესაც აზოტშემცველი ნაერთების ელემენტალურ აზოტში გადაყვანა მარტივია.
ატმოსფერულ წნევაზე აზოტის მოლეკულა კონდენსირდება 77 K-ზე (−195.8 °C). იყინება 63 K (−210.0 °C) და გადადის ბეტა ჰექსაგონალურ კრისტალურ ალოტროპულ ფორმაში. 35.4 K (−237.6 °C) დაბლა იღებს ალფა კუბური კრისტალის ალოტრიპულ ფორმას.
აზოტის არამდგრადი ალოტროპი, რომელიც შეიცავს აზოტის ორ ატომზე მეტს (მაგალითად 3N და 4N), შეიძლება მივიღოთ ლაბორატორიაში ძალიან მაღალ წნევასა (1.1 მილიონი ატმ) და მაღალ ტემპერატურაზე (2000 K). აზოტი განიცდის პოლიმერიზაციას და გადადის ერთმაგბმიან კუბურ სტრუქტურაში. ეს სტრუქტურა მსგავსია ალმასისა და ორივეს აქვს ძალიან მდგრადი კოვალენტური ბმა. N4-ს უწოდებენ ”აზოტის ალმასს”.
რეაქციები
სტანდარტულ წნევასა და ტემპერატურაზე აზოტი ძირითადად რეაქციისუუნაროა.
აზოტი შედის რეაქციაში ლითიუმთან, რომელიც იწვის აზოტის არეში და იძლევა ლითიუმის ნიტრიდს:
6 Li + N2 → 2 Li3N
აზოტის არეში ასევე იწვის მაგნიუმი და წარმოქმნის მაგნიუმის ნიტრიდს:
3 Mg + N2 → Mg3N2
აზოტი იძლევა სხვადასხვა ადუქტებს გარდამავალ მეტალებთან. ერთ-ერთი მაგალითია აზოტის შემცველი კომპლექსი [Ru(NH3)5(N2)]2+. მსგავსი აღნაგობის ნაერთები დღეს მრავლადაა უკვე მიღებული. კიდევ ერთი მაგალითის სახით შეიძლება დასახელდეს IrCl(N2)(PPh3)2, W(N2)2(Ph2CH2CH2PPh2)2, და [(η5-C5Me4H)2Zr]2(μ2, η²,η²-N2). მოცემულ კომპლექსები ჩანს, აზოტს თუ როგორ შეუძლია დაუკავშირდეს მეტალს (ან არამეტალს), რომლებიც მიიღება ჰამბერის პროცესებში ნიტროგენირების და კატალიზის დროს.
აზოტის ნაერთების წარმოების ინდუსტრიაში ფუნდამენტურია ჰამბერის პროცესი, რომლის თანახმადაც აზოტი და წყალბადი ურთიერთქმედებს რკინის (III) ოქსიდის (Fe3O4) თანაობისას ≈ 500 °C და 200 ატმ. წნევაზე.
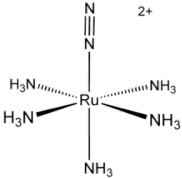
[Ru(NH3)5(N2)]2+ -ის სტრუქტურა
ნაერთები
აზოტის მთავარი ნეიტრალური ჰიდრიდია ამიაკი (NH3), აგრეთვე ჰიდრაზინი (N2H4), რომელიც ფართოდ გამოიყენება როგორც აღმდგენელი. ამიაკი უფრო ფუძე თვისებისაა, ვიდრე წყალი. ამიაკი იძლევა ამონიუმის იონს (NH+4). თხევადი ამიაკი (დუღილის ტემპერატურა 240 K) არის ამფოტერული (ამჟღავნებს როგორც ბრონსტდ-ლოურის მჟავა, ისე ფუძე თვისებას) და წარმოქმნის და (NH2-) იონს. ცნობილია ამიდები და ნიტრიდ მარილები (N3−) , მაგრამ ისინი იშლებიან წყალში.
ამიაკი მიღებულ იქნა 1774 წელს ამონიუმის ქლორიდის (ნიშადურის) გაცხელებით კირთან ერთად. ბუნებაში ამიაკი წარმოიქმნება აზოტის შემცველი ორგანული ნივთიერების ლპობის დროს. წარმოებაში ამიაკს ღებულობენ (რომელიც 2%-მდე აზოტს შეიცავს) მშრალი გამოხდით. ამ დროს მიღებულ აირების ნარევს ატარებენ წყალში, რომელშიც ამიაკის უმეტესი ნაწილი იხსნება. მიღებულ ე.წ. ამიაკიან წყალს ახურებენ ჩამქრალ კირთან ერთად და მიღებულ ამიაკს განზავებული გოგირდმჟავას ან მარილმჟავას მოქმედებით გამოყოფენ ამონიუმის მარილების სახით.
ამიაკი უფერო აირია, მწვანე თავისებული სუნით. იგი თითქმის ორჯერ უფრო მსუბუქია ჰაერზე. ადვილად იხსნება წყალში (20 °C-ზე 710 მოცულობა ერთ მოცულობა წყალში), ამიაკის წყალხსნარი - ამონიუმის ჰიდროქსიდი ფუძე თვისებისაა. ამიაკი ადვილად თხევადდება: 10 °C-ზე და 6.4 ატმ წნევაზე ამიაკი სითხედ იქცევა, -77°C-ზე უფერულ კრისტალებად მყარდება. აირად მდგომარეობაში ამიაკი წყლის მსგავსად მონომოლეკულურია (NH3), ხოლო გათხევადებისას ხდება მისი მოლეკულების ასოცირება (NH3)n. თხევადი ამიაკი მარილების კარგი გამხსნელია. მარილთა ხსნარები ამიაკში ატარებენ ელექტრულ დენს, რომელთა ელექტროგამტარობა ზოგ შემთხვევაში უფრო მაღალია, ვიდრე იმავე მარილების წყალხსნარებისა. თხევად ამიაკში ტუტე და ტუტემიწა ლითონები მნიშვნელოვანი რაოდენობით იხსნება (-33°C 100გ NH3 იხსნება 26.6გ ნატრიუმი და 49გ კალიუმი). მიღებული ხსნარები კონცენტრირებულ მდგომარეობაში მუქი-წითელი ფერისაა, განზავებულში - ლურჯი ფერის. ამიაკის მონო, დი, ტრი და ტეტრაჩანაცვლებულ ნაერთებს უწოდებენ ამინებს (ოთხჩანაცვლებულები წარმოქმნიან მეოთხეული ამონიუმის მარილებს), რომლებსაც აქვთ როგორც კომერციული, ისე ბიოლოგიური მნიშვნელობა. ამ უკანასკნელ ნაერთებში აზოტი დამუხტულია დადებითად და აქვს წყალში გახსნის უნარი. აგრეთვე ცნობილია უფრო დიდი ჯაჭვის, ბირთვის და სტრუქტურის მქონე ჰიდრიდები, მაგრამ ისინი არამდგრადებია.
აზოტის ნაერთებიდან ცნობილია (ნეგატიურად დამუხტული იონები) აზიდები (N3-). მათ აქვთ ხაზოვანი აღნაგობა და არიან მომწამლავები, ვინაიდან უკავშირდებიან რკინის შემცველ ენზიმებს ორგანიზმში ციანიდის მსგავსად. იგივე სტრუქტურის სხვა მოლეკულები უფეროა, მაგალითად ინერტული აზოტის ოქსიდი (დიაზოტმონოქსიდი N2O), მას აქვს ანესთეზიური თვისებები. იგი ცნობილია ”მალხენი გაზის” სახელწოდებით. აზოტი წარმოქმნის ოქსიდებს, რომელთა ზოგადი სახეა NOx..
აზოტის ოქსიდი (NO) არის ბუნებრივი თავისუფალი რადიკალი, რომელიც გადასცემს სიგნალებს როგორც მცენარის ასევე ცოცხალ ორგანიზმში. მურაწითელი ფერის მომწამლავი ნივთიერებაა აზოტის დიოქსიდი NO2. თხევად მდგომარეობაში დუღს 22.4 °C-ზე, ხოლო გაცივების შემდეგ უფერულდება და -10.2 °C-ზე უფერული კრისტალების სახით გამოიყოფა. NO2 არის ნისლის მნიშვნელოვანი შემადგენელი ნაწილი. იგი შეიცავს გაუწყვილებელ ელექტრონს, რის გამოც მას აქვს ტენდენცია წარმოქმნას დიმერი (ელექტრონების გაწყვილებით). იგი საკმაოდ რეაქციისუნარიანია. აზოტის ოქსიდების შესაბამისი მჟავებია: აზოტოვანი მჟავა HNO2 და აზოტმჟავა HNO3. შესაბამისად მარილებს ეწოდებათ ნიტრიტები და ნიტრატები. აზოტის უმაღლესი ოქსიდებია დინიტროტრიოქსიდი - N2O3, დინიტროტეტრაოქსიდი N2O4 და დინიტროპენტაოქსიდი N2O5, რომლებიც არამდგრადი ფეთქებადი ნაერთებია. დაშლის შედეგად გადადიან მდგრად N2-ში. N2O4 -ს იყენებენ როგორც დამჟანგველს. იგი წარმოადგენს აზოტმჟავას წარმოებაში შუალედ პროდუქტს, HNO3 თავის მხრივ ძლიერი დამჟანგველია.
აზოტი ასევე იძლევა არამდგრად, ფეთქებად ნაერთებს. მაგალითად, აზოტის ტრიიოდიდი NI3-ს, ძლიერ ფეთქებად ნიტროცელულოზას, რომელიც მიიღება ცელულოზის ნიტრირებით. ნიტროგლიცერინი ასევე მიიღება გლიცერინის ნიტრირებით. იგი წარმოადგენს დინამიტის შემადგენელ ნაწილს. შედარებით მდგრადი, მაგრამ ძლიერ ფეთქებადი ნივთიერებაა ტრინიტროტოლუოლი (ტნტ), ტროტილი. აზოტი ასვე შედის მრავალ ორგანულ ნაერთში სხვადასხვა ჯგუფების სახით, როგორიცაა ამინები, ამიდები, ნიტროჯგუფი, იმინები და ენამინები.
ქიმიურ ნაერთებში აზოტს საზღვრავენ კელდიშის მეთოდით.
გამოყენება
ინდუსტრიაში აზოტი მიიღება თხევადი აირის ფრაქციული გამოხდით. აირადი აზოტი გამოიყენება აქტიური აირების მოქმედებისაგან ლითონების დასაცავად (ვარვარების ელნათურებში). მნიშვნელოვანი ტექნიკური გამოყენება აზოტს აქვს ამიაკის მიღების პროცესში.
ბუნებაში ხდება აზოტის განუწყვეტელი წრებრუნვა, რის საშუალებითაც მჭიდრო კავშირი მყარდება ერთის მხრივ ცხოველთა და მცენარეთა, მეორე მხრივ აზოტის არაორგანულ ნაერთებს შორის. ჭექა-ქუხილის დროს ჰაერის აზოტი აზოტმჟავად გარდაიქმნება, რომელიც ნიადაგში მოხვედრისას აზოტმჟავას მარილებს წარმოქმნის. ამ უკანასკნელებს ითვისებენ მცენარეები და გადაყავთ ორგანულად ბმულ აზოტად, რომელიც ცხოველთა ორგანიზმში გვხვდება. მცენარეთა და ცხოველთა დაღუპვის შედეგად მათი ნაშთების ლპობის დროს გამოიყოფა ამიაკი, რომელიც განსაკუთრებული ბაქტერიების საშუალებით ნიადაგში აზოტოვანმჟავად იქცევა და ბოლოს, ასევე ბაქტერიების მოქმედებით მიიღება აზოტმჟავა. ნიადაგში მყოფ დენიტრიფიკაციის გამომწვევ ბაქტერიებს აზოტმჟავას მარილები აზოტად გადაჰყავთ.
აირად აზოტს აქვს მრავალმხრივი გამოყენება. მაგალითად ჰაერის შეცვლა ინერტული აირით. მას ძირითადად იყენებენ არასასურველი ჟანგვითი პროცესების თავიდან ასაცილებლად:
- როგორც მოდიფიცირებული ატმოსფერო სუფთა ან ნახშირბადის დიოქსიდთან ნარევის სახით ახალი, შეფუთული საკვების შესანახად (გაფუჭების ან სხვა ფორმის ჟანგვითი პროცესებისგან დასაცავად).
- როგორც არგონის იაფი ალტერნატივა გავარვარებულ ნაერთებში
- ტრანზისტორების, დიოდების და ინტეგრირებული ციკლების ელექტრონული ნაწილების წარმოებაში.
- მაღალვოლტაჟიან ხელსაწყოებში გასაშრობად და შესაკუმშად, როგორც, როგორც დიელექტრული აირი.
- უჟანგავი ფოლადის წარმოებაში.
- გამოიყენება სამხედრო ავიაციის საწვავ სისტემებში ცეცხლის წარმოქმნის რისკის შემცირებისათვის.
ნიტროგენიზებული ლუდი
აზოტი გამოიყენება, როგორც ნახშირბადის დიოქსიდის ალტერნატივა ზოგიერთი ლუდის ქილაში შესაკუმშად, პროდუქტში ჩნდება პატარა ბუშტუკები, რომელიც ლუდს ხდის უფრო შეკრულს და თანაბარს.
თხევადი აზოტი
თხევადი აზოტი კრიოგენული სითხეა. ატმოსფერულ წნევაზე იგი დუღს - 195.8 °C-ზე. თუ მას მოვათავსებთ დიუარის კონტეინერში, შესაძლებელი ხდება მისი ტრანსპორტირება ძალიან მცირე დანაკარგებით.
მშრალი ყინულის მსგავსად, აზოტი გამოიყენება გასაცივებლად. მას ხმარობენ სისხლის, რეპროდუქციული უჯრედების (სპერმა, საკვერცხე) და სხვა ბიოლოგიური მასალების დასაკონსერვებლად. იგი ასევე გამოიყენება კრიოთერაპიაში კანზე კისტების და მეჭეჭების მოსაცილებლად. აზოტი გამოიყენება გამაცივებელ სადრენაჟო მილებში X-სხივების დეტექტორის გასაცივებლად. აგრეთვე შეიძლება გამოვიყენოთ კომპიუტერში ცენტრალური კავშირებისა და აღჭურვილობის გასაცივებლად, რომელშიც ნორმალური ოპერირების დროს სითბოს დიდი რაოდენობა გამოიყოფა.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით



