ნიკელი
ნიკელი ქიმიური ელემენტია, რომელიც აღინიშნება სიმბოლოთი Ni (ლათ. Niccolum - წარმოდგება გერმანული სახელწოდებიდან "რუდი" -კუფვერნიკელი) და მისი ატომური ნომერია 28. მოვერცხლოსფრო-თეთრი მბზინვარე ლითონი მცირე ოქროსფერი შეფერილობით ერთ-ერთია იმ ოთხი ფერომაგნიტურ ელემენტებს შორის, რომლებიც არსებობენ ოთახის ტემპერატურაზე, დანარჩენი სამია რკინა, კობალტი და გადოლინიუმი. იგი იმყოფება ქიმიურ ელემენტთა პერიოდული სისტემის მეათე ჯგუფში. ნიკელის მაგნიტური თვისებები უფრო სუსტია, ვიდრე რკინისა და კობალტისა.
ნიკელის გამოყენების მაგალითები ცნობილია ჯერ კიდევ ქრისტეს შობამდე 3500 წლის წინათ, მაგრამ პირველად გამოყო და მისი ქიმიურ ელემენტად კლასიფიკაცია მოახდინა შვედმა ქიმიკოსმა კროონსტეტმა 1751 წელს, რომელსაც თავდაპირველად მისი შენადნობი აერია სპილენძის მინერალში. უფრო სუფთა სახით იგი მიღებული იყო 1804 წელს გერმანელი ქიმიკოსის ი. რიხტერის მიერ. მისი ყველაზე მნიშვნელოვანი მინერალებია ლატერიტები, მათ შორისაა ლიმონიტი და გარნიერიტი. აგრეთვე პენტლანდიტი. ნიკელის ძირითადი მწარმოებელია კანადა და რუსეთი.
მეტალი კოროზიამედეგია, გამოიყენება შენადნობებში და კატალიზატორად ჰიდრირების რეაქციებში. ენზიმების ცოცხალი ფორმები შეიცავენ ნიკელის აქტიურ ცენტრებს, რომელიც მეტალს ხდის ცოცხალი ფორმების აუცილებელ ელემენტად.
ისტორია
ნიკელის გამოყენება სათავეს იღებს 3500 წლის წინ ჩვენს ერამდე. ბრინჯაო, რომელსაც აწარმოებდნენ სირიაში, შეიცავდა 2%-ზე მეტ ნიკელს. შემდგომ, მისი წარმოება დაიწყეს ჩინეთში. მას ”თეთრ სპილენძს” უწოდებდნენ და იყენებდნენ 1700-1400 წლებში ჩვ. წელთაღრიცხვამდე. თეთრი სპილენძი მე-17 საუკუნეში ექსპორტირებული იქნა ბრიტანეთში, მაგრამ ამ შენადნობში ნიკელის შემცველობა აღმოჩენილ იქნა მხოლოდ 1822 წელს.
შუასაუკუნეებში, გერმანიაში ნაპოვნი იქნა წითელი მინერალი, რომელიც ჰგავდა სპილენძის საბადოს. თუმცა, როდესაც მოახდინეს მისგან სპილენძის ექსტრაქცია, გამოილექა ნიკელი. მათ ამ საბადოს უწოდეს ”Kupfernickel”-ი (გერმანულად Kupfer - სპილენძი). ეს საბადოა ნიკელის არსენიდი - ნიკელის წითელი ალმადანი. 1751 წელს ა.ფ. კრონშტედმა (Axel Fredrik Cronstedt) პირველად მიიღო თეთრი მეტალი - ნიკელი.
აშშ-ში, 1859 წელს გამოუშვეს სპილენძ-ნიკელის ერთცენტიანი მონეტა. მოგვიანებით, 1865 წელს დამზადდა სამცენტიანი, ხოლო შემდეგ წელს კი - ხუთცენტიანი მონეტაც, რომლითაც დღემდე სარგებლობდნენ. სუფთა ნიკელის მონეტები პირველად გამოიყენეს 1881 წელს შვეიცარიაში.
1824 წლიდან ნიკელი თანაური სახით მიღებული იქნა კობალტის ლურჯიდან. 1848 წლიდან ნორვეგია ამუშავებდა ნიკელით მდიდარ საბადოს - პიროტიტს. შემდგომში მისი დიდი დეპოზიტები აღმოჩენილი იქნა კანადაში, რუსეთში, სამხრეთ აფრიკაში, რამაც შესაძლებელი გახადა ნიკელის წარმოების გაზრდა.
გავრცელება
ნიკელი გვხვდება შემდეგი საბადოების სახით: ლატერიტური, რომელთა შორის ძირითადად არის ლიმონიტი: (Fe,Ni)O(OH) და გარნიერიტები (ჰიდროქსილ-ნიკელსილიკატები) (Ni, Mg)3Si2O5(OH)4. ასევე მნიშვნელოვანია მაგნიტური სულფიდების დეპოზიტები, რომელთა შორის მნიშვნელოვანია პენტლანდიტი (Ni, Fe)9S8.
კანადა აწარმოებს ნიკელის მსოფლიო მასის 30%. რუსეთს (ციმბირში) გააჩნია ნიკელის მსოფლიო მარაგის 40%. ნიკელის სხვა მსხვილი დეპოზიტები ნაპოვნია საფრანგეთში, ავსტრალიაში, კუბაში და ინდონეზიაში. ნიკელი კონცენტრირებულია დედამიწის ქერქში (0.01% მასის მიხედვით). კამასიტი და თაენიტი წარმოადგენენ რკინისა და ნიკელის ბუნებრივ შენადნობს. კამასიტში ჩვეულებრივ მინარევები კობალტის ან ნიკელის სახით არის (90 :10)-დან (95 ;5)-მდე თანაფარდობით, ხოლო თაენიტი ნიკელს შეიცავს 20%-დან 65%-მდე. კამასიტი და თაენიტი გვხვდება ნიკელ-რკინის მეტეორიტებში.
იზოტოპები
ნიკელი ბუნებაში გვხვდება ხუთი სტაბილური იზოტოპის სახით: 58Ni, 60Ni, 61Ni, 62Ni და 64Ni , რომელთაგან ყველაზე გავრცელებულია 58Ni (68.077%). 62Ni ელემენტთა შორის ყველაზე სტაბილური ნუკლიდია, სტაბილურობით მეორეა 56Fe შემდეგ. აგრეთვე დახასიათებულია 18 რადიოიზოტოპი, რომელთაგან ყველაზე სტაბილურია 59Ni, ნახევარდაშლის პერიოდი - 76.000 წელი, 63Ni - ნახევარდაშლის პერიოდი - 100.1 წელი და 56Ni - ნახევარდაშლის პერიოდი - 6.077დღე. დანარჩენი იზოტოპების ნახევარდაშლის პერიოდი 60 საათზე ნაკლებია, მათ შორისაა იზოტოპი, ნახევარდაშლის პერიოდით 30 წმ-ზე ნაკლები.
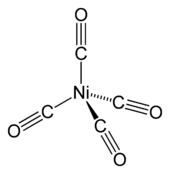
ნიკელის ტეტრაკარბონილი
-sulfate-hexahydrate-sample.jpg)
ნიკელის სულფატის კრისტალები
ფიზიკური თვისებები
ნიკელის ელექტრონული კონფიგურაციაა [Ar] 3d8 4s2. ქიმიური ბმების წარმოქმნაში გარდა გარე ელექტრონებისა, მონაწილეობას ღებულობს გარეს წინა დაუსრულებელი შრის ელექტრონები. მისთვის დამახასიათებელია დაჟანგულობის ხარისხებია: +2, +3 და +4.
ნიკელი წარმოადგენს მოვერცხლისფო თეთრი ფერის მეტალს, რომელსაც გადაჰკრავს მკრთალი ოქროსფერი. ოთახის ტემპერატურასთან მიახლოებულ ტემპერატურაზე იგი მაგნიტურია. მისი კიურის ტემპერატურაა 355°C, მაგრამ ამ ტემპერატურაზე ზემოთ იგი არამაგნიტურია. ნიკელს გააჩნია წახნაგცენტრირებული კუბური კრისტალური მესერი, რომლის პარამეტრებია 0.352 ნმ და ატომური რადიუსია 0.124 ნმ. ნიკელი მიეკუთვნება გარდამავალ მეტალებს, იგი მაგარია და დრეკადი, ადვილად იგლინება.
ქიმიური თვისებები
ნიკელისათვის ძირითადად დამახასიათებელია დაჟანგულობის რიცხვი +2, მაგრამ გვხვდება Ni0, Ni+ და Ni3+ შემცველი ნაერთები. ასევე კარგადაა ცნობილი Ni4+ შემცველი ნაერთები.
ნიკელი (0)
ტეტრაკარბონილნიკელი [Ni(CO4)] - აღმოაჩინა ლუდვიგ მონდმა. იგი აქროლადია ოთახის ტემპერატურაზე. გაცხელებით კომპლექსი იშლება ისევ ნიკელად და ნახშირბადის მონოქსიდად.
Ni(CO)4 → Ni + 4 CO
ნიკელი(0)-ის კომპლექსია აგრეთვე ბის(ციკლოოქტადიენ) ნიკელი(0), რომელიც გამოიყენება ორგანონიკელის ქიმიაში კატალიზატორად.
ნიკელი(II)
შენაერთებში ნიკელი მეტწილად იმყოფება ორვალენტიანი იონის სახით, მაგალითად, სულფიდებში, სულფატებში, კარბონატებში, ჰიდროქსიდებში და ჰალოგენიდებში.
ნიკელი(II) სულფატი დიდი რაოდენობით მიიღება მეტალური ნიკელის ან მისი ოქსიდის გოგირდმჟავაში გახსნით. ნიკელი(II) სულფატის [NiSO4·7H2O] ზურმუხტოვანი მწვანე ფერის კრისტალები ჰაერზე ადვილად იფიტება. იგი ასევე შეიძლება წარმოიქმნას ჰექსაჰიდრატის სახით. ნიკელისა და ამონიუმის ორმაგი მარილი - NiSO4.(NH4)2SO4·6H2O გამოიყენება გალვანური ხერხით მონიკელებისათვის.
ოთხივე ნიკელის ჰალოგენნაერს აქვს ოქტაედრის ფორმა. განსაკუთრებული მნიშვნელობა აქვს ნიკელ(II) ქლორიდს. მისი თვისებები იდენტურია სხვა ქლორიდების თვისებებისა. ნიკელ(II) ქლორიდი მიიღება ნიკელ(II) ოქსიდის, ჰიდროქსიდის ან ნიკელის კარბონატის გახსნით მარილმჟავაში. ხსნარიდან გამოკრისტალდება მწვანე ფერის კრიტალები ჰექსაჰიდრატის სახით - NiCl2·6H2O, მაგრამ დეჰიდრატაციის შედეგად მიიღება უწყლო, ყვითელი ფერის ნიკელის ქლორიდი - NiCl2. ზოგიერთი ტეტრაკოორდინირებული ნიკელ(II)კომპლექს გააჩნია, როგორც ტეტრაედრული ისე ბრტყელი კვადრატის ფორმა. ტეტრაედრული კომპლექსები პარამაგნიტურია, ხოლო ბრტყელი კვადრატის ფორმისა კი - დიამაგნიტური.
ნიკელ(I), (III) და (IV)
ნიკელ(III) ოქსიდი გამოიყენება, როგორც კათოდი არაერთ ბატარეაში, მათ შორისაა ნიკელ-კადმიუმი, ნიკელ-რკინა, ნიკელ-წყალბადი და ნიკელ-მეტალჰიდრიდები. გამოიყენება Li-იონ ბატარეების წარმოებაშიც.
ნუკლეოსინთეზი
ნიკელის სტაბილური ფორმა წარმოიქმნება ახალ ვარსკვლავებზე g-პროცესების შედეგად.
მიღება
ნიკელის ექსტრაგირებას ახდენენ მისი საბადოებიდან. შემდგომი ჟანგვა-აღდგენითი პროცესების საშუალებით შესაძლებელია მეტალის გამოყოფა 75%-ის სისუფთავით. ნიკელის ოქსიდების საბოლოო გასუფთავება ხდება ლ. მონდის პროცესების გამოყენებით, რომელიც ზრდის ნიკელის სისუფთავეს 99.99%-მდე. ეს პროცესი დაპატენტებულ იქნა მე-20 საუკუნეში ლ. მონდის მიერ და იგი გამოიყენეს სამხრეთ უელსში. ნიკელი ურთიერთქმედებს ნახშირბადის მონოქსიდთან დაახლოებით 50 °C ტემპერატურაზე და წარმოქმნის აქროლად ნიკელის კარბონილს, შემდეგ მას ატარებენ კამერაში, 230°C ტემპერატურაზე, სადაც ნიკელის კარბონილი იშლება და მიიღება მეტალური ნიკელი ფხვნილის სახით. გამოთავისუფლებულ ნახშირბადის მონოქსიდს კვლავ პროცესში აბრუნებენ. ამ გზით მიღებული ნიკელი კარბონილური ნიკელის სახელითაა ცნობილი. ნიკელის სულფიდის საბადოდან ნიკელის მისაღებად ახდენენ მის ფლოტაციას და შემდეგ გამოყოფენ. შემდგომი პროცესია შეროთ-გორდონის პროცესი. პირველად გამოიყოფა სპილენძი გოგირდწყალბადის დამატებით, ხოლო დარჩენილ კობალტს და ნიკელს ექსტრაგირებენ და გამოყოფენ მათ სუფთა სახით, რომელშიც ნიკელის კონცენტრაცია 99%-ზე მეტია.
გამოყენება

ნიკელით დაფარული ნეოდინიუმის მაგნიტი გამოიყენება სამუხრუჭე სისტემაში.
ნიკელი გამოიყენება როგორც ინდუსტრიაში, ასევე ყოფა-ცხოვრებაში. იგი, ფართოდ გამოიყენება უჟანგავი ფოლადისა და სპეციალურ შენადნობების წარმოებაში, მაგალითად ბრინჯაოს და ყვითელი სპილენძის (თითბერი) წარმოებაში. ცნობილია შენადნობები სპილენძთან, ქრომთან, ალუმინთან, ტყვიასთან, კობალტთან, ვერცხლთან და ოქროსთან.
ნიკელის 60% გამოიყენება ფოლადის წარმოებაში, 14% ნიკელ-სპილენძის და ნიკელ-ვერცხლის შენადნობებში, 9% გამოიყენება ისეთი ნიკელის მისაღებად, რომელიც დეფორმირდება ცივ მდგომარეობაში.
ნიკელს ხშირად იყენებენ რკინის დასაფარავად, რაც იცავს მას კოროზიისაგან. აწარმოებენ აგრეთვე მეტალ-კერამიკულ ცეცხლმედეგ შენადნობებს, რომლებიც ნიკელს შეიცავენ შემკვრელი მეტალის სახით. ასეთი შენადნობები უძლებენ გაცხელებას 1100°C-მდე.
ნიკელი ასევე ფართოდ გამოიყენება ელექტროგამახურებელი დანადგარების ელემენტების ნიქრონის ტიპის შენადნობების დასამზადებლად, რომლებიც შეიცავენ 80% ნიკელს და 20% ქრომს. ლაბორატორიაში ნიკელი გამოიყენება ჰიდრირების რეაქციებში - კატალიზატორად, ხშირად იგი გამოიყენება რენეის ნიკელის სახით. ნიკელის შენადნობს რკინასთან-პლატინიტს ისეთივე გაფართოების კოეფიციენტი აქვს, როგორც მინას. ამერიკული ”ნიკელის” ხუთცენტიანი მონეტა წარმოადგენს 75% სპილენძს და 25% ნიკელს. სუფთა ნიკელისაგან ამზადებენ ლაბორატორიულ ჭურჭელს.
ნიკელს იყენებენ მინისათვის მწვანე შეფერილობის მისაცემად.
ბიოლოგიური როლი
1970 წლამდე არ იყო ცნობილი ნიკელის მნიშვნელოვანი როლი მიკროორგანიზმების და მცენარეების ბიოლოგიაში. ურეაზა (ენზიმი რომელიც მონაწილეობს შარდოვანას ჰიდროლოზში) შეიცავს ნიკელს.
ტოქსიკურობა
ნიკელის ზოგიერთი ნაერთი, მათ შორის ნიკელის სულფიდი წარმოადგენს კანცეროგენულ ნაერთს. ნიკელის კარბონილი [Ni(CO4)] წარმოადგენს ძლიერ ტოქსიკურ აირს. მისი ტოქსიკურობა გამოწვეულია მასში, როგორც მეტალის არსებობით, ასევე ძლიერ მომწამლავი ნახშირბადის მონოქსიდის შემცველობით. ზოგიერთ ადამიანში ნიკელი იწვევს ალერგიას და დერმატიტს.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით



