გოგირდი
გოგირდი წარმოადგენს ქიმიურ ელემენტს ატომური ნომრით 16. იგი გამოისახება სიმბოლოთი S და წარმოადგენს მულტივალენტურ არამეტალს. გოგირდი ბუნებრივი ფორმით წარმოადგენს ღია ყვითელი ფერის მყარ კრისტალურ ნაერთს. ბუნებაში იგი გვხვდება, როგორც თვითნაბადი, ასევე სულფიდური და სულფატური მინერალების სახით. იგი სიცოცხლისათვის აუცილებელი ელემენტია და გვხვდება ორ ამინომჟავაში: ცისტეინსა და მეთიონინში. გამოიყენება სასუქებში, შავი დენთის, ასანთის, ინსექტიციდების და ფუნგიციდების წარმოებაში.
დახასიათება

გოგირდი წვისას ლღვება სისხლისფერ წითელად და გამოყოფს ლურჯ ალს, რომელიც ღამით უფრო კარგად დაიკვირვება
გოგირდი ყვითელი მყიფე კრისტალური ნივთიერებაა, სითბოსა და ელექტრობის ცუდი გამტარია. წყალში გოგირდი არ იხსნება, კარგად იხსნება გოგირდნახშირბადში CS2 და დიეთილეთერში (C2H2)2O. ელემენტურ გოგირდს აქვს სუსტი, ასანთის მსგავსი სუნი. გოგირდის ”მკვეთრი სუნი” გაიგივებულია გოგირდწყალბადის (H2S) ან ლაყე კვერცხის სუნთან, ან გოგირდის წვის დროს წარმოქმნილი გოგირდის დიოქსიდის სუნთან.
გოგირდი იწვის ლურჯი ალით. ამ დროს გამოიყოფა დამახასიათებელი, მკვეთრი სპეციფიური სუნის მქონე გოგირდის დიოქსიდი, რომელიც ლორწოვან გარსში გახსნისას წარმოქმნის განზავებულ გოგირდოვან მჟავას. გოგირდი თვითონ წყალში არ იხსნება და არც სველდება, იგი წყლის ზედაპირზე ტივტივებს (ფლოტაციის უნარი). გოგირდი იხსნება გოგირდნახშირბადში და მცირე რაოდენობით იხსნება ბენზოლში და ტოლუოლში. გოგირდის ძირითადი დაჟანგულობის ხარისხია: -2; +2; +4; +6. იგი წარმოქმნის სტაბილურ ნაერთებს თითქმის ყველა ელემენტთან კეთილშობილი აირების გარდა. გოგირდის კრისტალოგრაფია კომპლექსურია. დამოკიდებულია სპეციფიკურ პირობებზე. ყველაზე მეტად ცნობილია მისი კრისტალური სტრუქტურის მქონე ალოტროპიები - რომბული და მონოკლინური, რომელთა მესრის კვანძებში განლაგებულია S8 მოლეკულები, მაგრამ ისინი განსხვავდებიან მოლეკულების წყობით კრისტალში ან კრისტალური ფორმით. ალოტროპიის ამ სახეს ეწოდება პოლიმორფიზმი.
ჩვეულებრივ პირობებში მდგრადი მოდიფიკაციაა რომბული გოგირდი. იგი ყვითელი ფერის, მყიფე ნივთიერებაა, ლღობის ტემპერატურით 112.8 °C, სიმკვრივე - 2.07გ/სმ3. ახასიათებს მცირე ელექტრო და თბოგამტარობა.
გამლღვალი გოგირდის ნელი გაცივებისას მიიღება მონოკლინური გოგირდი მუქი-ყვითელი ნემსისებრი კრისტალების სახით. მისი ლღობის ტემპერატურაა 119 °C, სიმკვრივე - 1.96გ/სმ3. იგი მდგრადია მხოლოდ 96 °C-ზე ზემოთ. ჩვეულებრივ პირობებში თანდათან გარდაიქმნება რომბულ გოგირდად.
გამლღვალი გოგირდი მოძრავი, გამჭვირვალე სითხეა. 160 °C-ის ზემოთ გაცხელებისას გარდაიქმნება მუქ ბლანტ სითხედ, ხოლო მისი სწრაფი გაცივებისას (გამლღვალი გოგირდის ნაკადის ცივ წყალში ჩასხმით) მიიღება ამორფული სახესხვაობა - პლასტიკური გოგირდი S, ყავისფერი, რეზინისმაგვარი მასა, რომელიც გაჭიმვისას იწელება, მოშვებისას კი მოკლდება. პლასტიკური გოგირდის მოლეკულები გოგირდის ატომების გრძელი ჯაჭვებია, რომლებიც გაუჭიმავ პლასტიკურ გოგირდში უწესრიგოდაა გადახლართული, გაჭიმვისას კი სწორდება და გამჭიმავი ძალის მიმართულებით ერთმანეთის მიმართ პარალელურად ლაგდება, მოშვებისას კი ისევ ეხვევა.
გოგირდი დუღს 444.6 °C ტემპერატურაზე. ტემპერატურის შემდგომი გაზრდით ორთქლში ატომთა რიცხვი მოლეკულაში თანდათანობით მცირდება.
900 °C ტემპერატურის ზემოთ გოგირდი ორატომიანი მოლეკულებისაგან შედგება. მათ ჟანგბადის მსგავსად პარამაგნიტური თვისებები ახასიათებთ. 1500 °C-ზე მაღალ ტემპერატურაზე მიმდინარეობს S2 მოლეკულების დისოციაცია ცალკეულ ატომებად.
გავრცელება
გოგირდი ბუნებაში ფართოდაა გავრცელებული, ის გვხვდება თავისუფალ მდგომარებაში (თვითნაბადი გოგირდი) და ნაერთების სახით. იგი დედამიწის ქერქში 0.05%-ია, ზღვის წყალში 0.08% (მასით). თვითნაბად გოგირდს ვხვდებით ჩამქრალი ან მოქმედი ვულკანების ახლოს.თვითნაბადი გოგირდით მდიდარი საბადოებია კუნძულ სიცილიაზე, ამერიკაში, იაპონიაში, ყირიმზე,თურქმენეთში, ყარაყუმის უდაბნოში, უზბეკეთში, კავკასიაში და ვოლგისპირეთში. მიწის წიაღი გაცილებით მდიდარია ლითონთა სულფიდებით: ალმადანი ანუ პირიტი - FeS2, თუთიის მატყუარა (თუთიის კრიალა ) - ZnS, ტყვიის კრიალა - PbS, სტიბანიტი (სტიბიუმის სულფიდი), ქალკოზინი - Cu2S, ქალკოპირიტი- CuFeS2, სინგური - HgS. საკმაოდ გავრცელებულია ბუნებაში გოგირდმჟავას მარილები, მაგალითად თაბაშირი CaSO4·2H2O, ბარიტი BaSO4 და სხვა. ყურე ყარა–ბოღაზგოლი ყოველწლიურად იძლევა მილიონობით ტონა მირაბილიტს – ათ მოლეკულა წყალთან დაკრისტალებულ ნატრიუმ–სულფატს Na2SO4·10H2O (იგივე გლაუბერის მარილი) და მწარე მარილს MgSO4·7H2O.
გოგირდი მიეკუთვნება იმ ელემენტთა რიგს ურომლისოდაც სიცოცხლე შეუძლებელია, რადგანაც იგი შედის ცილების შემადგენლობაში. ადამიანის ორგანიზმში გოგირდის შემცველობა 0.16%-ია (მასით). ბიოქიმიური პროცესების შედეგად იგი ორგანიზმში იჟანგება გოგირდმჟავამდე, რომელიც ნაწლავებში წარმოქმნილ ბაქტერიებს აუსნებოვნებს.
სტაბილური გოგირდი წარმოიქმნება ძალიან დიდ, ძალიან ცხელ (2.5 მილიონი კელვინი) ვარსკვლავზე. ამისათვის საჭიროა სილიციუმის ერთი ატომს დაემატოს ჰელიუმის ერთი ატომი.
ალოტროპია
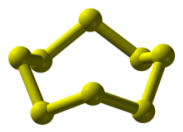
ციკლოოქტაგოგირდის S8 სტრუქტურა
გოგირდი იძლევა 30 მყარ ალოტროპს, რომელთაგან ზოგი რომბულია, ზოგი კი პრიზმული და პლასტიკური. ოთახის ტემპერატურაზე მდგრადია რომბული გოგირდი, 96 °–ზე და უფრო მაღლა მდგრადია პრიზმული გოგირდი. რომბული გოგირდი ლღვება 113°–ზე, ადუღებამდე გაცხელებული გოგირდი რომ ცივ წყალში ჩავასხათ, გაცივებისას მივიღებთ პლასტიკურ გოგირდს, რომელიც რამდენიმე საათში მყიფე ხდება, ყვითლდება და ბოლოს რომბულ გოგირდად იქცევა. რომბული და პლაზმური გოგირდის მოლეკულების შედგენილობა ერთნაირია, თითოეული მოლეკულა 8 ატომისაგან შედგება S8. მაგრამ რომბულ კრისტალებში მოლეკულების წყობა სხვაგვარია ვიდრე პრიზმულში. ეს არის ალოტროპიის ერთ–ერთი სახე, პოლიფორმიზმი ეწოდება. პოლიმორფიზმი არის ზოგიერთი მარტივი და რთული ნივთიერების მიერ სხვადასხვა კრისტალური ფორმის სახესხვაობის წარმოქმნის უნარი.
იზოტოპები
ცნობილია გოგირდის 25 იზოტოპი. ოთხი მათგანი სტაბილურია: 32S (95.02%), 33S (0.75%), 34S (4.21%) და 36S (0.02%). გოგირდის რადიოაქტიური იზოტოპის 35S სიცოცხლის ხანგრძლივობა ძალიან მცირეა. 35S წარმოიქმნება ატმოსფეროში 40Ar-ზე კოსმოსური სხივების მოქმედებით. მისი ნახევარდაშლის პერიოდია 87 დღე.
ქიმიური თვისებები
ოთახის ტემპერატურაზე გოგირდი ურთიერთქმედებს ფთორთან, ქლორთან და ფოსფორთან, რა დროსაც ამჟღავნებს აღმდგენ თვისებებს:
S + 3F2 = SF6
2S + Cl2 = S2Cl2
კონცენტრირებულ მჟავებთან - დამჟანგველებთან (HNO3, H2SO4) გოგირდი ურთიერთქმედებს ხანგრძლივი გაცხელების შემდეგ და იჟანგება:
S + 6HNO3(კონც) = H2SO4 + 6NO2 ↑ + 2H2O
S + 2H2SO4(კონც.) = 3SO2 ↑ + 2H2O
ჰაერზე გოგირდი იწვის ცისფერი ალით და წარმოქმნის გოგირდოვან ანჰიდრიდს - უფერო აირს მკვეთრი სუნით:
S + O2 = SO2
ამ შემთხვევაში გოგირდი აღმდგენ თვისებებს ავლენს, თვითონ კი S+4-მდე იჟანგება.
ჟანგბადის არეში გოგირდის წვა ენერგიულად მიმდინარეობს. გოგირდის ორჟანგის დაჟანგვით მიიღება გოგირდის ანჰიდრიდი SO3.
სპექტრალური ანალიზის საფუძველზე დადგინდა, რომ სინამდვილეში გოგირდის დაჟანგვისას მიმდინარეობს ჯაჭვური რეაქცია და წარმოიქმნება მთელი რიგი შუალედური პროდუქტებისა: გოგირდის მონოოქსიდი S2O2, მოლეკულური გოგირდი S2, თავისუფალი გოგირდის ატომი S და გოგირდის მონოოქსიდის თავისუფალი რადიკალი SO.
მეტალებთან ურთიერთქმედებისას წარმოქმნის სულფიდებს:
2Na + S = Na2S
ამ სულფიდებზე გოგირდის დამატებით წარმოიქმნება პოლისულფიდები:
Na2S + S = Na2S2
გოგირდი გაცხელებით ურთიერთქმედებს ნახშირბადთან, სილიციუმთან, ფოსფორთან და წყალბადთან:
C + 2S = CS2 (გოგირდნახშირბადი)
გოგირდი გაცხელებისას იხსნება ტუტეში, მიმინარეობს დისპროპორციონირების რეაქცია:
3S + 6KOH = K2SO3 + 2K2S + 3H2O
გოგირდწყალბადი წყალში გახსნისას იძლევა შესაბამის მჟავას, რომელიც ურთიერთქმედებს მეტალებთან და წარმოქმნის მეტალსულფიდების მთელ სერიას. ბუნებრივი მეტალსულფიდები ძალიან გავრცელებულია, განსაკუთრებით რკინის სულფიდი ანუ პირიტი, რომელიც ამჟღავნებს ნახევარგამტარ თვისებებს. ასევე გავრცელებულია გალინა - ტყვიის სულფიდი.
პოლიმერული გოგირდის ნიტრიდს აქვს მეტალური თვისებები, მიუხედავად იმისა, რომ იგი არ შეიცავს მეტალის არც ერთ ატომს. ამ ნაერთს აქვს აგრეთვე არაჩვეულებრივი ელექტრული და ოპტიკური თვისებები. ეს პოლიმერი შეიძლება მივიღოთ ტეტრასულფოტეტრანიტრიდიდან - S4N4.
ფოსფორის სულფიდები გამოიყენება სინთეზში. მაგალითად P4S10 და მისი წარმოებულები ნაფთალინ-1.8-დიილ-1.3.2.4-დითიადიფოსფეტენ-2.4-დისულფიდ და სხვა წარმოებულები გამოიყენებიან ორგანულ ნაერთებში ჟანგბადის ატომის გოგირდით შესაცვლელად.
სულფიტები (SO23-) წარმოადგენენ გოგირდოვანი მჟავას მარილებს. გოგირდოვანი მჟავა მიიღება SO2-ის წყალში გახსნით. გოგირდოვანი მჟავა და შესაბამისი სულფიტები ძლიერი აღმდგენი აგენტებია. SO2-დან არის წარმოებული პიროსულფიტი და მეტაბისულფიტ იონი (S2O25-).
სულფატები (SO24-) წარმოადგენენ გოგირდმჟავას მარილებს. გოგირდმჟავა ექვიმოლური რაოდენობით ურთიერთქმედებს SO3-თან გვაძლევს პიროგოგირდმჟავას (H2S2O7).
თიოსულფატები (S2O23-), რომელთაც ზოგჯერ მოიხსენიებენ როგორც თიოსულფიტები ან ”ჰიპოსულფიტები”, გამოიყენებიან ფოტოგრაფიულ ფიქსაციაში, როგორც აღმდგენი აგენტები.
ნატრიუმის დითიონიტი Na2S2O4 ძლიერი აღმდგენია.
პეროქსიდიგოგირდმჟავა (H2S2O8) მიიღება SO3-ის ურთიერთქმედებით კონცენტრირებულ H2O2 და კონცენტრირებულ H2SO4-თან.
გოგირდის ნიტრიდი გვხვდება, როგორც ხაზოვანი, ისე ციკლური ნაერთების სახით, რომლებიც შეიცავენ მხოლოდ N და S. ამის მაგალითია ტეტრაგოგირდტეტრანიტრიდი S4N4.
თიოციანატები შეიცავენ SCN- ჯგუფს. თიოციანატები დაჟანგვით იძლევიან თიოციანოგენს (SCN)2, NCS-SCN-ის სახით.
ორგანული ნაერთები
ბევრი ორგანული ნაერთის არასასიამოვნო სუნი გამოწვეულია მასში გოგირდის არსებობით, ასეთებია მეთილმერკაპტანი და დიეთილსულფიდი. თიოლები და სულფიდები გამოიყენებიან ბუნებრივი აირების სუნის მისაცემად, მათ შორის მნიშვნელოვანია 2-მეთილ-2-პროპანთიოლი (მესამ. ბუტილ მერკაპტანი). ნივრის სუნი და ”მყრალი” სუნი აგრეთვე გამოწვეულია გოგირდშემცველი ორგანული ნაერთებით. მაგრამ ყველა გოგირდშემცველ ნაერთს არა აქვს უსიამოვნო სუნი. მაგალითად, გრეიფრუტმერკაპტანს, რომელიც შეიცავს მონოტერპენოიდს, აქვს გრეიფრუტის დამახასიათებელი სუნი ძალიან მცირე კონცენტრაციით, უფრო დიდი კონცენტრაციის დროს ამ ნაერთს უკვე აქვს თიოლის დამახასიათებელი არასასიამოვნო სუნი.
ქვემოთ მოყვანილი გოგირდშემცველი ორგანული ნაერთებია (სადაც R და R’ არის ორგანული ჯგუფი -CH3) თიოეთერები R-S-R’. ესენი წარმოადგენენ სულფოშემცველი მარტივი ეთერების ექვივალენტს.
თიოლები (მერკაპტანები) აქვთ R-SH ფორმა. ისინი წარმოადგენენ ალკოჰოლების გოგირდშემცველ ექვივალენტს.
თიოლატ იონი არის R-S-. იგი წარმოიქმნება თიოლების ფუძეებთან ურთიერთქმედების დროს.
სულფოქსიდების ფორმულაა R-S(=O)-R’. უმარტივესი სულფოქსიდი DMSO (დიმეთილსულფოქსიდი) კარგი გამხსნელია.
სულფონების ფორმულაა R-S(=O)2R’. გავრცელებული სულფონია C4H8SO2.
მიღება

მოსახლეობა გოგირდს აგროვებს ვულკანის ქავაჰ იჯენის (Kawah Ijen) ნაპირებზე. ინდონეზია. (ფოტო 2009)

გოგირდის ექსტრაგირება ხდება ორი ძირითადი პროცესით: სიცილიური და ფრაშის პროცესით.
ექსტრაქცია ბუნებრივი რესურსებიდან
სიცილიური პროცესი.
სიცილიური პროცესი პირველად გამოყენებულ იქნა სიცილიაში. უძველესი დროიდან ცნობილია ვულკანურ რეგიონებში მადნიდან გოგირდის მიღება. ამ პროცესის დროს გოგირდის საბადოს აქუცმაცებენ, შემდეგ დიდი რაოდენობით ათავსებენ აგურის გამოსაწვავ ღუმელში დახრილად, ისე რომ მათ შორის მოძრაობდეს ჰაერი. შემდეგ მადანს აყრიან ფხვნილისებრ გოგირდს და ცეცხლს უკიდებენ. როგორც კი გოგირდი დაიწვება გამოყოფილი სითბო ალღობს გოგირდის საბადოს. ამის შემდეგ გამლღვალი გოგირდი ჩამოედინება ქვევით დახრილი გვერდიდან. გამლღვალ გოგირდს აგროვებენ ხის კასრებში. სიცილიური პროცესით მიღებული გოგირდი სუფთავდება გამოხდით.
ფრაშის პროცესი
ფრაშის პროცესის დროს გოგირდის საბადოში მილით წნევის ქვეშ შეყავთ გადახურებული წყლის ორთქლი, მეორე მილით ჩატუმბავენ შეკუმშულ ჰაერს, რომლის მოქმედებითაც გამლღვალი გოგირდი მესამე მილით ამოდის საბადოდან. მას ხდიან და ორთქლის კონდენსაციით ღებულობენ გოგირდის ფხვნილს. ამ გზით მიიღება 99.5% სისუფთავის გოგირდი, რომელიც არ საჭიროებს შემდგომ გასუფთავებას.
სინთეზი
ნახშირყლაბადების გასუფთავებისას (გაუგოგირდოება) გამოყოფილი გოგირგის შეგროვება. ალბერტა.
ელემენტური გოგირდის მიღება გოგირდწყალბადიდან (კლაუსის მეთოდი) მდგომარეობს ნავთობის ან ბუნებრივი აირის დეჰიდროსულფირებაში.
გოგირდს ღებულობდნენ გოგირდწყალბადისა და ჰაერის გატარებით გააქტივებულ ნახშირზე, რომელიც კატალიზატორის როლს ასრულებს:
2H2S + O2 → 2H2O + 2S
გოგირდს ღებულობენ ასევე გოგირდოვანი გაზის ნახშირით აღდგენით მაღალ ტემპერატურაზე:
SO2 + C → CO2 + S
გოგირდის სინთეზი შესაძლებელია რკინის ალმადანის (პირიტის) 600°–მდე გახურებით ღუმელში. ამ ტემპერატურაზე ალმადანი იშლება, რის შედეგადაც მიიღება გოგირდოვანი რკინა და გოგირდი.
FeS2 → FeS + S
თვითნაბადი გოგირდის სუბლიმაციით (აქროლებით) მიიღება გოგირდის მტვერი, ხოლო გამოდნობით ღებულობენ კოშტოვან გოგირდს.
გამოყენება
გოგირდი წარმოადგენს მრავალი ნაერთის პრეკურსორს. მისი მსოფლიო წარმოების დაახლოებით 85% (1989 წელი) იხარჯება გოგირდმჟავას მისაღებად. იგი ფართოდ გამოიყენება, როგორც ქიმიურ მრეწველობაში, ისე ლითონთა გადამამუშავებელ, ნავთობგადამამუშავებელ და მრეწველობის სხვა დარგებში. ლითონგადამამუშავებელ მრეწველობაში იგი გამოიყენება ლითონის ზედაპირის ოქსიდებისაგან გასუფთავების - მონიკელების, მოქრომვის და სხვა ოპერაციების წინ. გოგირდმჟავას როლი უმნიშვნელოვანესია მსოფლიო ეკონომიკაში და მისი წარმოება და ხარჯვა არის ნაციონალური ინდუსტრიის განვითარების ინდიკატორი.
გოგირდის ერთ-ერთი პირდაპირი გამოყენებაა კაუჩუკის ვულკანიზაცია. იგი უშუალოდ შედის რეაქციაში ნახშირბადთან და იძლევა გოგირდნახშირბადს (CS2), რომელიც გამოიყენება ცელოფნების და ხელოვნური აბრეშუმის წარმოებაში. გოგირდშემცველი ნაერთები გამოიყენება დეტერგენტებში, ფუნგიციდებში, საღებრებში. ასევე გამოიყენებიან მცენარეთა მავნებლების წინააღმდეგ საბრძოლველად. გოგირდი ასევე გამოიყენება ასანთისა და დენთის წარმოებაში. ანტიმიკრობული და ანტიპარაზიტული მოქმედების გამო. გასუფთავებული გოგირდი გამოიყენება მედიცინაში კანის დაავადების სამკურნალო მალამოების დასამზადებლად. ნატრიუმისა და ამონიუმის თიოსულფატები გამოიყენება ფოტოგრაფიაში ფიქსატორად. მაგნიუმის სულფატი MgSO4 (მწარე მარილი) გამოიყენება როგორც სასაქმებელი, ასევე როგორც გამშრობი საშუალება.
გოგირდმჟავა ჰიგროსკოპულია, წყლისადმი დიდი სწრაფვა განაპირობებს მის გამოყენებას აირების გასაშრობად. იგი რეაგირებს მრავალ ორგანულ ნაერთთან, მისი ეს თვისება გამოიყენება მავნე მინარევებისაგან ბენზინის, ნავთის და სხვა ნავტობპროდუქტების გასაწმენდად. გოგირდმჟავა ფართოდ გამოიყენება ფოსფოროვანი მადნებიდან პროდუქტების ექსტრაქციისათვის, სასუქების მისაღებად.
მნიშვნელოვანია ანტისეპტიკური საშუალების - გოგირდის (IV) ოქსიდის (SO2) გამოყენება ბოსტნეულისა და ხილის შესახრჩოლებლად. მათი ლპობის თავიდან აცილების მიზნით ღვინის კასრებში ობის მოსასპობად. გოგირდის დიოქსიდი მრავალ საღებართან წარმოქმნის უფერო ნაერთებს. მიღებული ნაერთები არამდგრადია და შეიძლება გაცხელებით ან სინათლის მოქმედებით ადვილად დაიშალოს და ქსოვილმა აღიდგინოს პირველადი ფერი.
ალიცინი, ნიორში შემავალი აქტიური აგენტი
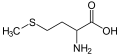
მეთიონინი, თიოეთერის შემცველი ამინომჟავა
პერფთოროქტან სულფომჟავა ზედაპირულად აქტიური ნაერთი
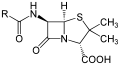
პელიცილინი
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით



