
გაფართოებული ძებნა
"ქიმიის უწყებანი" ტომი:2, ნომერი:1, 21-24 გვ.
სახალისო ექსპერიმენტი - ქიმიის სწავლის მოტივაციის ამაღლების მეთოდი
სსიპ ქალაქ გორის #6 საჯარო სკოლა, ქიმიის სერტიფიცირებული პედაგოგი
რეზიუმე: ნაშრომში გაზიარებულია პედაგოგის პირადი გამოცდილება, თუ როგორ იყენებს სახალისო ექსპერიმენტს ქიმიის სწავლის მოტივაციის ამაღლების საშუალებად. აღწერილა სასწავლო მასალის შესაბამისი მარტივი და უსაფრთხო სახალისო ექსპერიმენტის შერჩევის მეთოდოლოგია, რომელთა დაგეგმვა, ჩატარება, ანალიზი, დასკვნის გამოტანა და შეძენილი ცოდნის ახალ სიტუაციაში გამოყენება შეუძლიათ მოსწავლეებს.
საკვანძო სიტყვები: მოტივაციის ამაღლება, სახალისო ექსპერიმენტი, ქიმიის სწავლება
ქიმიის სწავლის მოტივაციის ამაღლების ერთ-ერთი მნიშვნელოვანი სტრატეგია სახალისო ექსპერიმენტის გამოყენებაა. ამ დროს რამდენიმე წინაპირობის დაცვაა საჭირო: ექსპერიმენტი უნდა იყოს მარტივი, უსაფრთხო, უკავშირდებოდეს სასწავლო მასალას და მოსწავლეს, თავისი საბაზო ცოდნის საფუძველზე, უნდა შეეძლოს მისი ახსნა, სასწავლო მიზანთან დაკავშირება და სხვა სიტუაციაში გამოყენება.
ექსპერიმენტი ზოგადად ქიმიის სწავლის მოტივაციას ზრდის. როდესაც ცდა სახალისოა და თამაშის ელემენტებსაც შეიცავს, მისი სამოტივაციო ეფექტი კიდევ უფრო იზრდება.
განვიხილავ რამდენიმე მაგალითს და ექსპერიმენტის მეთოდიკას:
1. წყლის ,,გარდაქცევა" ღვინოდ და პირიქით
მიზანი: ინდიკატორის მოქმედების მექანიზმის გააზრება.
თემა: ფუძურ-მჟავური რეაქციები, ნეიტრალიზაცია, ქიმიური წონასწორობა.
ექსპერიმენტის აღწერა: სადემონსტრაციო მაგიდაზე ვათავსებ სამ დანომრილ კოლბას, ჭიქას ან დიდი ზომის სინჯარას.
№1 სინჯარაში ვასხამ გამოხდილ წყალს და 1-2 წვეთ ფენოფტალეინის ხსნარს ვამატებ. ფენოფტალეინი სუსტი ორგანული მჟავაა, რომელიც მოლეკულური ფორმით უფეროა, ანიონური ფორმით კი - ჟოლოსფერი:
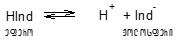
მჟავას (H+ იონების) დამატებისას წონასწორობა გადაიხრება უფერო მოლეკულების წარმოქმნის მხარეს და მჟავა არეში (ისევე როგორც წყალში) ხსნარი უფერულია. ტუტის (OH– იონების) დამატებისას OH– უკავშირდება ხსნარში ისედაც მცირე რაოდენობით არსებულ H+ იონებს. H+ იონების კონცენტრაციის შემცირება წონასწორობას გადახრის ჟოლოსფრად შეფერილი ანიონის მხარეს და ხსნარი ჟოლოსფერს მიიღებს.
№2 სინჯარაში ჩავასხამ ტუტის (მაგ. NaOH-ის) უფერო განზავებულ ხსნარს, №3-ში კი მჟავას (მაგ. HCI-ის) განზავებულ ხსნარს. (ხსნარების დამზადებაში მოსწავლე მონაწილეობას არ იღებს).
ვთხოვ რომელიმე მოსწავლეს მოვიდეს სადემონსტრაციო მაგიდასთან და ჩემი ინსტრუქციის შესაბამისად ჩაატაროს ცდა:
1. №2 სინჯარიდან №1 სინჯარაში გადაასხით მცირე რაოდენობით ტუტის ხსნარი. ხსნარი ჟოლოსფერი გახდება ანუ ,,წყალი ღვინოდ იქცევა".
2. იმავე №1 სინჯარაში მცირე რაოდენობით №3 სინჯარიდან გადაასხით მჟავას ხსნარი, სანამ ხსნარი არ გაუფერულდება ანუ ,,ღვინო ისევ წყლად არ გარდაიქმნება". შემდეგ მაგიდასთან გამოვიძახებ სხვა მოსწავლეს და ვთხოვ იმავე თანმიმდევრობით გაიმეოროს ცდა. შედეგი იგივე მიიღება.
ექსპერიმენტის ეფექტის გასაზრდელად ზოგჯერ №1 სინჯარას ცარიელს ვიღებ, მხოლოდ მასში წინასწარ ფენოლფტალეინის ხსნარი მაქვს გამოვლებული.
შემდეგ მოსწავლეებს ვთხოვ დაგეგმონ კვლევა, როგორ ჩაატარებენ იმავე ტიპის ცდებს ინდიკატორ ლაკმუსის გამოყენებით. თან ვუხსნი მათ, რომ ლაკმუსი ბუნებრივი საღებარი ნივთიერებაა, რომელიც წყალში იისფერია, მჟავაში წითელი, ტუტეში - ლურჯი; ფართოდ გამოიყენება და ყველაზე ცნობილია ფუძურ-მჟავურ ინდიკატორებში. მოსწავლეები მივლენ იმ დასკვნამდე, რომ მსგავსი ეფექტის მისაღებად (წყლის ღვინოდ გადასაქცევად) ლაკმუსი არ გამოდგება, მაგრამ მჟავასა და ტუტის გამოსაცნობად კარგია.
გამოდგება ლაკმუსი ან ფენოფტალეინი ხსნარის pH-ის დასადგენად? არ გამოდგება. მაშინ როგორ დგინდება ხსნარის pH? უნივერსალური ინდიკატორით, რომლის ქაღალდს თან ახლავს
pH-ის შკალა. ასე, თანდათანობით, სახალისო ცდების ჩატარებისას მოსწავლეთა ცოდნა ფართოვდება, მათი ინტერესი და ჩართულობაც იზრდება.
2. თემა: ქიმიურ რეაქციათა ტიპები. რეაქციის სითბური ეფექტი
მიზანი: ქიმიური რეაქციების კლასიფიკაცია. საკითხების განხილვა ეფექტურია სახალისო ცდების ჩატარების ფონზე.
1. შეერთების რეაქცია.
ა) კვერცხის მოხარშვა უცეცხლოდ. ფაიფურის ჯამზე ვათავსებ ჩაუმქრალი კირის ფხვნილს. შიგ ვათავსებ კვერცხს. ვთხოვ მაგიდასთან მყოფ მოსწავლეს ფრთხილად, თანდათან ამატოს ჯამში წყალი. ყველა ხედავს, როგორ ცხელდება და ,,დუღს" წყალი და იმდენი სითბო გამოიყოფა, რომ ცხელ წყალში კვერცხი იხარშება.
კირის ჩაქრობის რეაქცია შეერთების, ეგზოთერმული რეაქციაა:
CaO + H2O → Ca(OH)2 + Q
ბ) წყალი კატალიზატორი. ამწოვ კარადაში ფაიფურის როდინში ვსრესავ ალუმინის ფხვნილისა და იოდის კრისტალების ნარევს. ვთხოვ მოსწავლეს იქვე წვეთობით ამატოს წყალი - წარმოიქმნება ლამაზი, იისფერი ბოლი, რომელიც მალე ქრება და ახალი ნივთიერება - ალუმინის იოდიდი წარმოიქმნება:
2Al + 3I2 → 2AlI3 + Q
წყალი ამ რეაქციაში კატალიზატორის როლშია. სქემატურად ეს პროცესი ასე გამოისახება:
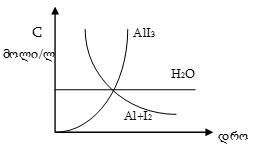
შეერთების რეაქცია აქაც ეგზოთერმულია და კატალიზური.
გ) შაქრის წვა. ფერფლი კატალიზატორი. შაქრის ფხვნილს ვათავსებ ფაიფურის ჯამზე და ვთხოვ მოსწავლეს რამდენჯერმე მიიტანოს შაქართან ახლოს ანთებული ასანთი. ამ პირობებში შაქარი არ იწვის. შემდეგ მოსწავლეთა თვალწინ შაქრის ფხვნილს შევურევ წინასწარმომზადებულ სიგარეტის ფერფლს და ვთხოვ მოსწავლეს ცდა ისევ გაიმეოროს. ასანთის მიტანისას შაქარი აინთება და იწვის. ვთხოვ ახსნან მიზეზი - ფერფლი კატალიზატორია. წვის რეაქციაა:
C12H22O11 + 12O2 → 12CO2 + 11H2O + Q
რეაქცია შეერთების, ეგზოთერმული, კატალიზურია.
დ) ვარდის გაუფერულება. ზარხუფის ქვეშ ვათავსებ წითელი ვარდის ფურცელსა და წინასწარგახურებულ გოგირდის ფხვნილს. ვწვავ გოგირდს. ვარდი უფერულდება. ვთხოვ მოსწავლეებს ახსნან, რომელმა რეაქციამ გამოიწვია ვარდის გაუფერულება?
S + O2 → SO2
SO2 - აუფერულებს. (ქსოვილის შეღებვა - გაუფერულება)
2. დაშლის რეაქცია.
ა) ქსოვილის შეღებვა - გაუფერულება. ნიშადურის სპირტის, იგივე ამონიუმის ჰიდროქსიდის, ხსნარში (იყიდება აფთიაქში და საყოფაცხოვრებო ქიმიის მაღაზიაში) ვამატებ 1-2 წვეთ ფენოფტალეინს. ხსნარი ჟოლოსფერი ხდება. ვათავსებ ჟოლოსფერ ხსნარში თეთრ ქსოვილს . ქსოვილი მაშინვე შეიღებება. დავაყოვნებ ხსნარს და მოსწავლეები ნახავენ, რომ ქსოვილი ისევ გაუფერულდება. ვთხოვ ახსნან მიზეზი. NH4OH-ს ტუტე რეაქცია აქვს. ქსოვილიც ტუტეში ჟოლოსფერს მიიღებს (გაწითლდება). დაყოვნებისას ამიაკი აქროლდება და წყალი დარჩება, წყალში კი ქსოვილი ისევ გაუფერულდება:
NH4OH → NH3 + H2O
რეაქცია არის დაშლის, ენდოთერმული.
ბ) ცეცხლი - მწერალი. ვთხოვ მოსწავლეს KNO3-ის ხსნარით დასველებული წკირით დახატოს თეთრ ფურცელზე რაიმე ფიგურა ან ქიმიური სიმბოლო. ნახატზე აღვნიშნავ საწყის წერტილს და მათ თვალწინ ვახურებ იმ ადგილს სპირტქურის ალზე. ყველა ხედავს როგორ გაყვება ცეცხლი ნაწერს (ნახატს), ამოწვავს ქაღალდს და ფიგურა გამოჩნდება. ვთხოვ ახსნან მიზეზი.
2KNO3 → 2KNO2 + O2
გამოყოფილ ჟანგბადში წვა გაგრძელდება.
გ) წყალი მწერალი. ვთხოვ მოსწავლეს ფენოფტალეინის ხსნარში დასველებული წკირით დახატოს ფიგურა. დააცადეთ ხსნარს გაშრობა. შემდეგ წკირი ტუტის ხსნარში დაასველეთ და ფიგურას ზემოდან გადაუსვით. ფიგურა ჟოლოსფრად გამოჩნდება. ასე შეიძლება საიდუმლო წერილი დაწეროთ და შემდეგ როცა მოისურვებთ, მაშინ წაიკითხოთ - ვუხსნი მოსწავლეებს.
3. ჩანაცვლების რეაქცია. სპილენძის ვერცხლად გადაქცევა.
ვერცხლისწყლის ნიტრატის ხსნარში ვათავსებ სპილენძის ფირფიტას. ვთხოვ მოსწავლეებს დააკვირდნენ სპილენძის ფერის ცვლილებას. მათ თვალწინ სპილენძი ,,ვერცხლად" იქცევა - მისი ზედაპირი ვერცხლისწყლის ფენით დაიფარება:
Hg(NO3)2 + Cu → Cu(NO3)2 + Hg
ჩანს, რომ სპილენძი ვერცხლისწყალზე უფრო აქტიურია.
4. მიმოცვლის რეაქცია.
ა) წყლის რძედ გადაქცევა და პირიქით. ვამზადებ სამ (1-3) ქიმიურ კოლბაში (ჭიქაში) CaCI2-ის, Na2CO3-ის და HCI-ის განზავებულ ხსნარებს. ვუკეთებ წარწერებს. ვთხოვ მოსწავლეს იმოქმედოს ჩემი ინსტრუქციის შესაბამისად:
მე-2 ჭურჭლიდან პირველში გადმოასხას ხსნარი - წყალი რძედ იქცევა:
CaCI2 + Na2CO3 → CaCO3¯ + 2NaCI
რძე - CaCO3-ის სუსპენზიაა.
მიღებულ რძეს მე-3 ჭურჭლიდან დაამატოს ხსნარი. რძე ისევ წყლად იქცევა (CaCO3 მჟავაში გაიხსნება):
CaCO3 + 2HCI → CaCI2 + H2O + CO2
შემდეგ ვთხოვ მოსწავლეებს მოიფიქრონ როგორ შესძლებენ იმავე თანმიმდევრობით სხვა ხსნარების შერევით იგივე შედეგს. განსჯის შემდეგ შეირჩევა BaCI2-ის, Na2SO4-ის და HCI-ის ხსნარები.
ბ) სისხლის წვეთის მიღება. წინასწარ დავამზადებ ამონიუმის როდანიდის და რკინა(III)-ის ქლორიდის უფერო განზავებულ ხსნარებს.
ვთხოვ ორ მოსწავლეს - ერთმა მინის წკირი პირველ ხსნარში დაასველოს, მეორე მოსწავლემ კი - მეორეში და სწრაფად წკირის ბოლოები ერთმანეთთან მიიტანონ. შეხების ადგილზე ყველა დაინახავს სისხლის წვეთებს.
3NH4NCS + FeCI3 → Fe(NCS)3 + 3NH4CI
Fe(NCS)3 არის სისხლისფერი წითელი ხსნარი და სწორედ ამ ხსნარის წვეთი ჩანს წკირების შეხების ადგილზე. ესაა თვისებითი რეაქცია Fe3+ იონზე. რეაქცია არის მიმოცვლის და ის იმიტომ მიმდინარეობს, რომ Fe(NCS)3 კოვალენტური აღნაგობის მარილია და ხსნარში მოლეკულების სახით რჩება (არ დისოცირდება).
3. თემა: ჟანგვა-აღდგენა. ხსნარები, კრისტალები.
ა) შაქრის დანახშირება. შაქრის კონცენტრირებულ ხსნარს ქიმიურ ჭიქაში ფრთხილად ვამატებ გოგირდმჟავას კონცენტრირებულ ხნარს და ვთხოვ მოსწავლეებს დააკვირდნენ, როგორ დანახშირდება და ამოფუვდება შაქარი:
C12H22O11 + კონც. H2SO4 → C . H2O + CO2 + SO2
დანახშირების მიზეზი გამოყოფილი ნახშირია, აფუებისა კი გამოყოფილი CO2 და SO2 აირები. ამ რეაქციაში კონც. H2SO4 მჟანგავია – S+6-დან გადადის S+4-ში, ხოლო შაქარი აღმდგენი (C0-დან გადადის C+4-ში).
ბ) სპირტქურის ანთება უასანთოდ. ფაიფურის ჯამში კონც. H2SO4-ის ხსნარს ფრთხილად შევურევ KMnO4-ის ფხვნილს და მოსწავლეთა თვალწინ ამ ნარევში პიპეტით ჩავაწვეთებ ეთილის სპირტს. სპირტი აალდება და ამ ალით შეიძლება სპირტქურის ანთება, თუმცა ეს პროცესი უსაფრთხო არ არის და შეიძლება სპირტქურის ანთებისას მასში მოთავსებული სპირტი აალდეს. ამიტომ ასეთი ცდა არ უნდა ჩაატარონ. ამ ალთან შეიძლება ქაღალდის ფურცელი მიიტანონ და ანთებული ფურცლით სპირტქურა აანთონ.
მოსწავლეებთან ერთად ვხსნი რომელი ქიმიური რეაქციები განხორციელდა ცდის მსვლელობისას.
2KMnO4 + კონც.H2SO4 → 2HMnO4 + K2SO4 მიმოცვლა
2HMnO4 → Mn2O7 + H2O დაშლა
Mn2O7 → Mn2O3 + 2O2 ჟანგვა-აღდგენა
C2H5OH + 3O2 → 2CO2 + 3H2O + Q ჟანგვა-აღდგენა
ასე, თანდათანობით თითქმის ყველა საკითხის შესწავლას ვახერხებ სახალისო ქიმიური ექსპერიმენტის თანხლებით. სადაც შესაძლებელია (უსაფრთხოა), ექსპერიმენტის ჩატარებაში მონაწილეობენ მოსწავლეები, თუ არა და მე ვატარებ სადემონსტრაციო ცდებს და მოსწავლეები მონაწილეობენ მიმდინარე ქიმიური რეაქციების დახასიათებაში. ვამჩნევ, რომ ასეთი მიდგომით ბევრი მოსწავლის ცნობისმოყვარეობა იზრდება. ისინი გაკვეთილში უფრო ჩართულნი ხდებიან, კმაყოფილებიც არიან, რომ თავიანთი შესაძლებლობები გამოავლინეს და გაკვეთილზე ენერგია სწავლაზე დახარჯეს. ასეთი სახალისო ექსპერიმენტებით ქიმიის სწავლის მოტივაცია შესამჩნევად იზრდება.
გამოყენებული ლიტერატურა:
1. http://mastavlebeli.ge; ქ. კუპატაძე. ქიმიური ექსპერიმენტი - ჯადოსნური სამყაროს კარიბჭე.
2. http://www.sev-chem.narod.ru/opyt.htm; გასართობი გამოცდილება ქიმია.
3. ეფექტური სწავლება. თეორია და პრაქტიკა. გამოცდების ეროვნული ცენტრი, 2010.
გამოქვეყნებულია: 31-08-2015
