ბორი
ბორი- ელემენტების პერიოდულობის სისტემის მეორე პერიოდის, მესამე ჯგუფის A ქვეჯგუფის ელემენტია, ატომური ნომრით 5. აღინიშნება სიმბოლოთიB(ლათ.Borium).
ბორის ატომური მასაა 10.811. ბორი სუფთა სახით უფერო, ნაცრისფერი ან წითელი კრისტალური ან მუქი ამორფული ნივთიერებაა. ცნობილია ბორის 10 ალოტროპიული მოდიფიკაცია. ბორი წარმოადგენს ტრივიალურ მეტალოიდს, რომელიც დიდი რაოდენობით გვხვდება ბორაქსის და ალექსისტის აქროლად საბადოებში.
ამორფული ბორი - მურა ფერის ფხვნილია, კრისტალური ბორი კი შავი ფერისაა, რომელიც საკმაოდ მძიმეა (~ 9.5 მოხის შკალის მიხედვით) და ოთახის ტემპერატურაზე სუსტი გამტარია. ბორი გამოიყენება დანამატების სახით ნახევარგამტარების ინდუსტრიაში, ხოლო მისი ნაერთები უმნიშვნელოვანეს როლს ასრულებენ როგორც მსუბუქი სტრუქტურული მასალები, ინსექტიციდები (მწერების საწინააღმდეგოდ), კონსერვანტები და რეაგენტები ორგანული სინთეზისათვის.
ბორი წარმოადგენს მცენარეებისათვის აუცილებელ საკვებ ელემენტს. მისი ნაკლებობა იწვევს დაავადებას, მაგრამ მაღალი კონცენტრაციის დროსაც ასევე შესაძლებელია ანომალური პროცესების განვითარება.
დადგენილია, რომ იგი მნიშვნელოვანი ელემენტია ვირთხების და სხვა ძუძუმწოვრების ცხოველქმედებისათვის, თუმცა მისი ზუსტი ფიზიოლოგიური როლი ჯერ კიდევ სრულად არ არის შესწავლილი.
ისტორია და ეტიმოლოგია

ბორის ნატეხი
სახელი ბორი წარმოდგა არაბული სიტყვისაგან ”ბურაქ” ან ირანული სიტყვისაგან ”ბურაჰ”, როგორც იწოდება მინერალი ბორატი.
ბორის ნაერთები ცნობილია ათასეული წლების განმავლობაში. ბორაკი ცნობილი იყო აღმოსავლეთ ტიბეტის უდაბნოებიდან, სადაც მან მიიღო სახელი ტინკალი Na2B4O7·10H2O (წარმოქმნილია სანსკრიტიდან).
ბორატით ჭურჭლის მოჭიქურება გამოყენებული იყო ჩინეთში. ტინკალით მდიდარია აღმოსავლეთი. არაბ ალქიმიკოსს ჯაბირ იბნ ჰეიინს შემჩნეული ჰქონდა 700-მდე სახეობის ბორატი. მარკო პოლოს XIII საუკუნეში ზოგიერთი ჭიქური იტალიაში ჩაჰქონდა. აგრიკოლა აღნიშნავდა ფლიუსი (შესალღობად) სახით მათ გამოყენებას მეტალურგიაში.
ბორის მჟავა აღმოჩენილ იქნა ცხელ მინერალურ წყაროებში ფლორენციის ახლოს, იტალიაში. იგი ცნობილი გახდა, როგორც ტკივილგამაყუჩებელი მარილი, რომელიც ძირითადად მედიცინაში გამოიყენება. ბორის შემცველია იშვიათი მინერალი საროლინი. მან დასახელება მიიღო იტალიაში აღმოჩენის გამო. იგი წარმოადგენდა ბორატის ძირითად წყაროს 1842 წლიდან 1872 წლამდე ევროპისათვის, სანამ ამერიკულმა საბადომ არ ჩაანაცვლა იგი.
ბორი პირველად გამოყვეს ჰ. დევიმ, ჯ.ლ. გეი-ლუსაკმა და ლ.ჯ. ტენერმა 1808 წელს ბორის მჟავასა და კალიუმს შორის რეაქციით. დევი ელემენტს უწოდებდა ბორასიუმს. ი. ბერცელიუსმა ბორს, როგორც ელემენტს, იდენტიფიკაცია გაუკეთა 1842 წელს. პირველად სუფთა ბორი მიიღო ამერიკელმა ქიმიკოსმა ვ. ვენთრაუბმა 1909 წელს.
ალოტროპია
ბორს ნახშირბადის მსგავსად უნარი აქვს წარმოქმნას კოვალენტურად დაკავშირებული მოლეკულური მესერი. ნომინალურად მოწესრიგებული (ამორფული) ბორიც კი შეიცავს რეგულარულ იკოსაედრს (ოცწახნაგოვანი), თუმცა ისინი კავშირდებიან შემთხვევით ყოველგვარი რიგის გარეშე.
კრისტალური ბორი საკმაოდ მაგარია. იგი არის შავი ფერის და აქვს მაღალი ლღობის ტემპერატურა (2000°C-ზე მეტი). კრისტალური ბორი გვხვდება ოთხი ძირითადი პოლიმორფული სახით: α, β, γ და τ. α, β და τ ფაზები დაფუძნებულია B12-ის იკოსაედრზე, γ - ფაზა კი შეიძლება აღწერილ იქნას როგორც იკოსაედრისა და B2-ის ატომური წყვილებით წარმოქმნილი ქვამარილის ტიპის წყობით. იგი შეიძლება მიღებულ იქნას ბორის სხვადასხვა ფაზების შეკუმშვით 12-20 გპა და 1500-1800 °C-ზე გაცხელებით. ტემპერატურისა და წნევის მოხსნის შემდეგ იგი ხდება მდგრადი. τ ფაზა წარმოიქმნება იგივე წნევის, მაგრამ უფრო მაღალი ტემპერატურის დროს, დაახლოებით 1800-2200 °C-ზე. იგი მდგრადი რჩება წნევისა და ტემპერატურის მოხსნის შემდეგაც. 160 გპა-ის ზემოთ შეკუმშული ბორი იძლევა ფაზას, რომლის სტრუქტურა ჯერ კიდევ უცნობია და ეს ფაზა წარმოადგენს ზეგამტარს 6-12K ტემპერატურის დროს.
| ბორის ფაზა | α | β | γ | τ |
|---|---|---|---|---|
სიმეტრია | რომბოედრი | რომბოედრი | ორთორომბული | ტეტრაგონური |
ატომების (კავშირების)/ უჯრედი | 12 | ~105 | 28 | |
სიმკვრივე (გ/სმ3) | 2.46 | 2.35 | 2.52 | 2.36 |
სიმაგრე ვიკერსის მიხედვით (გპა) | 42 | 45 | 50-58 | |
მოცულობითი დრეკადობა(გპა) | 2 | 1.6 | 2.1 |
იზოტოპები
ბორს აქვს ორი ბუნებრივი, სტაბილური იზოტოპი11B (80.1%) და10B (19.9%). მასების განსხვავება გამოწვეულია δ11B-ის დიდი რაოდენობით, რომელიც განსაზღვრავს11B და10B-ს შორის ფრაქციულ განსხვავებას და ტრადიციულად გამოისახება პროცენტებში, იგი ბუნებრივ წყლებში მერყეობს 16-დან +59.
ცნობილია ბორის 13 იზოტოპი, რომელთაგან არსებობის ყველაზე ხანმოკლე პერიოდი აქვს7B იზოტოპს. იგი იშლება პროტონის და ალფა ნაწილაკის გამოყოფით. მისი ნახევარდაშლის პერიოდია 3.5×10−22წმ. ბორის იზოტოპური ფრაქციონირება კონტროლდება B(OH)3და [B(OH)4]- შორის მიმოცვლის რეაქციით. ბორის იზოტოპები ფრაქციონირდებიან აგრეთვე მინერალების კრისტალიზაციის დროს, ჰიდროთერმულ სისტემებში წყლის ფაზის ცვლილებისას და ქვის ნატეხების ჰიდროთერმული დამუშავებისას (მაგ. მაგმის საშუალებით). უკანასკნელი პროცესის საშუალებით ადგილი აქვს10B(OH)4იონების მოცილებას და თიხურ მასალად გარდაქმნას.11B(OH)3-ის გამორეცხვა იწვევს ზღვის წყლების გამდიდრებას11B-ით ოკეანისა და კონტიტენტურ წყლებთან შედარებით.
ეგზოტიკური17B წარმოადგენს ბირთვის ჰალოს, ანუ მისი რადიუსი მნიშვნელოვნად უფრო დიდია, ვიდრე მოსალოდნელი თხევადი წვეთის მოდელის მიხედვით.
იზოტოპების გამდიდრება
ნეიტრონების მიმართ მაღალი წინააღმდეგობის გამო10B ხშირად გამოიყენება შელღობის კონტროლისათვის ბირთვულ რეაქტორებში, როგორც ნეიტრონების მშთანთქმელი ნივთიერება. იზოტოპების გამდიდრების რამდენიმე პროცესია ცნობილი.
გამდიდრებული ბორი (ბორი - 10)
ბუნებრივი ბორი წარმოადგენს ~ 20%10B-სა და 80%11B-ის ნარევს. ბირთვული ინდუსტრია ბუნებრივ ბორს ამდიდრებს სუფთა10B-მდე. გაღარიბებული ან გადამუშავებული ბორი თითქმის სუფთა11B-ია.11B რეკომენდირებულია, როგორც ანეიტრონული საწვავი და გამოყენებულია ნახევარგამტარების ინდუსტრიაში.
გამდიდრებული ბორი ანუ10B გამოიყენება რადიაციისაგან დაცვისათვის და ბორით ნეიტრონების შთანთქმის თერაპიაში.10B-ის შემცველი ნაერთები გამოიყენება სიმსივნეების საწინააღმდეგოდ - შედარებით დაბალი დოზების თერმული ნეიტრონებით მკურნალობისას, რომელსაც საფუძვლად უდევს ბორიდან α ნაწილაკების გამოტყორცნა. ეს უკანასკნელი კი მოქმედებს სიმსივნის უჯრედებზე.
ბირთვულ რეაქტორებში და მის მსგავს ჩაკეტილ სისტემებში10B გამოიყენება რეაქციის კონტროლისათვის. ამ მიზნით შესაძლებელია გამოყენებულ იქნას როგორც ბორსილიკატების ძელაკები, ასევე ბორის მჟავა. დაწნეხილი (შეკუმშული) წყლის რეაქტორებში ბორის მჟავა ემატება რეაქტორის გამაცივებელ აგენტს, როცა დანადგარი გამორთულია საწვავით შესავსებად, შემდეგ იგი ნელა იფილტრება მრავალი თვის განმავლობაში და საწვავი ხდება ნაკლებ რეაქტიული.
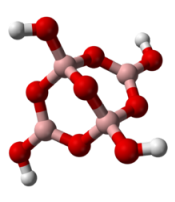
[B4O5(OH)4]2− ტეტრაბორანის ანიონის ბურთულ-ღეროვანი მოდელი. ასეთი სახით არსებობს იგი კრისტალურ ბორაქსში: Na2[B4O5(OH)4]·8H2O. ბორის ატომები გამოსახულია ვარდისფრად, ხიდური ჟანგბადები - წითლად, ჰიდროქსილის წყალბადები - თეთრად. ორი ბორის ატომი არის sp2ჰიბრიდულ მდგომარეობაში, ხოლო ერთი sp3მდგომარეობაში.
გაღარიბებული ბორი (ბორი - 11)
კოსმოსურ რადიაციას შეუძლია წარმოქმნას მეორადი ნეიტრონები თუ ისინი დაეჯახებიან კოსმოსურ აპარატებს. ეს ნეიტრონები შეიძლება შთაინთქას10B-ით, თუ მას მოიცავს კოსმოსური აპარატის ნახევარგამტარები და შესაბამისად წარმოქმნიან γ-სხივებს, α – ნაწილაკებს და ლითიუმის იონს. შელღობის შედეგად მიღებულმა პროდუქტებმა შეიძლება დაასხივონ ირგვლივ მყოფი ნახევარგამტარული მიკროსქემები და გამოიწვიონ მონაცემების დაკარგვა.
რადიაციულად მდგრადი ნახევარგამტარი კონსტრუქციების დამზადების ერთ-ერთი საშუალებაა გაღარიბებული ბორის გამოყენება, რომელიც იმდენად არის გამდიდრებული11B-ით, რომ თითქმის არ შეიცავს10B-ს.11B რადიაციულად უფრო მდგრადია.
გაღარიბებული ბორი არის ბირთვული ინდუსტრიის თანაური პროდუქტი.
11B აგრეთვე რეკომენდირებულია როგორც საწვავი ანეიტრონული შელღობისათვის. როდესაც პროტონი ეცემა ენერგიით 1.602 × 10-19 ჯ (500KeV), იგი წარმოქმნის α-ნაწილაკებს და 8.7 MeV ენერგიას.
ბმრ სპექტროსკოპია
10B და11B ატომებს აქვთ ბირთვული სპინი.10B-ის ბირთვული სპინია 3, ხოლო11B-ის - 3/2. ეს იზოტოპები ამიტომაც გამოიყენებიან ბირთვულ მაგნიტურ რეზონანსულ სპექტროსკოპიაში.10B და11B ბირთვები იწვევენ მათთან დაკავშირებული ბირთვების სპინურ გახლეჩას რეზონანსში.
ქიმიური თვისებები
ბორი ქიმიური თვისებებით უფრო ახლოსაა სილიციუმთან, ვიდრე ალუმინთან. კრისტალური ბორი ქიმიურად ინერტულია და მდგრადია მდუღარე ფთორწყალბად და ქლორწყალბად მჟავების მიმართ. წვრილად დაქუცმაცებული ბორი ნელა ურთიერთქმედებს ცხელ კონცენტრირებულ წყალბადის პეროქსიდთან, ცხელ კონცენტრირებულ აზოტმჟავასთან, ცხელ გოგირდმჟავასთან და გოგირდმჟავისა და ქრომმჟავის ცხელ ნარევთან.
ბორის ჟანგვა დამოკიდებულია მის კრისტალურ სტრუქტურაზე, დაქუცმაცებულობის ხარისხზე, სისუფთავეზე და ტემპერატურაზე. ბორი არ რეაგირებს ჰაერთან ოთახის ტემპერატურაზე, მაგრამ მაღალ ტემპერატურაზე იგი იწვის ბორის ტრიოქსიდის წარმოქმნით:
4B + 3O2→ 2B2O3
ბორი ანალოგიურად მოქმედებს გოგირდთან და იძლევა ბორის სულფიდს B2S3.
ბორი ურთიერთქმედებს ჰალოგენებთან და იძლევა ტრიჰალოგენიდს:
2B + 3Br2→ 2BBr3
ეს ნაერთები ასევე შეიძლება მივიღოთ შესაბამისი ოქსიდებისაგან.
გავრცელება
ბორი იშვიათი ელემენტია და მისი შემცველობა დედამიწის ქერქში შეადგენს მხოლოდ 0.001%. ბორატების საწარმოო მარაგები მსოფლიო მასშტაბით არის 10 მილიონი ტონა. თურქეთი და აშშ ბორის უმსხვილესი მწარმოებლები არიან. თურქეთს გააჩნია დაახლოებით მსოფლიო ბორის მარაგის 72%. ბორი არ გვხვდება დედამიწაზე ელემენტის სახით, მაგრამ იგი მოიპოვება ბორატების, ბორის მჟავას, კოლემანისტის, კერინიტის, ელექსიტის და ბორაკების სახით.
ბორის მჟავა ზოგჯერ წარმოიქმნება გაზაფხულის ვულკანურ წყლებში. ბორი გვხვდება ელექსიტის სახით. იგი ბოჭკოვანი კრისტალია და მისი ინდივიდუალური ბოჭკოები შეიძლება იყოს ოპტიკური ბოჭკოების მსგავსი. ბორის მნიშვნელოვანი წყაროა რაზორიტი (კერინიტი) და ტინკალი (ბორაკის საბადო). ორივე მათგანის მოპოვება წარმოებს კალიფორნიაში, მაგრამ ბორატები უდიდესი რაოდენობით გვხვდება ცენტრალურ და აღმოსავლეთ თურქეთში ესკეშიერის, კიუთახის და ბალიკესირის რაიონებში.
ბორის ნაწარმები
ბორი წარმოქმნის ნაერთების მთელ რიგს, რომელშიც ბორის ფორმალური დაჟანგულობის ხარისხია +3. მათ მიეკუთვნება ოქსიდები, სულფიდები, ნიტრიდები და ჰალოგენიდ ნაერთები.
დიდი რაოდენობითაა აღწერილი ბორორგანული ნაერთები, მაგალითად: ტრიფენილბორი.
ჰალოიდნაერთებში ბორს ასევე შეუძლია წარმოქმნას ნივთიერებები, რომელშიც მისი ფორმალური დაჟანგულობის ხარისხი ნაკლებია სამზე, მაგალითად, როგორიცაა ბორის არამდგრადი ფთორიდები BF და B2F4.
ბორის ნაერთებს შორის შეიძლება გამოვყოთ მისი ჰიდრიდები. მათი სტრუქტურა არა ჰგავს სხვა ელემენტების ამ ტიპის ნაერთებს. ამ სერიას მიეკუთვნება დიბორანი (B6H2), დეკაბორანი (B10H14) და კარბბორანები (მაგ. C2B10H12). მრავალი ელემენტის მსგავსად ისინი წარმოქმნიან ტიპიურ კოვალენტურ ბმას. ბორის ჰიდრიდებში დაჟანგულობის ხარისხი ხშირად დაბალია (მაგ. პოლიედრულ ბორანებში).
სუფთა ელემენტური ბორი ძნელად ექსტრაგირდება. უახლესი მეთოდია ბორის აღდგენა ბორის ოქსიდებიდან მეტალური მაგნიუმითა და ალუმინით, თუმცა პროდუქტი თითქმის ყოველთვის მოიცავს მეტალთა ბორიდების მინარევებს.
სუფთა ბორი შეიძლება მივიღოთ აქროლადი ბორის ჰალოგენიდების წყალბადით აღდგენით მაღალ ტემპერატურაზე. ულტრა სუფთა (ზესუფთა) ბორი, ნახევარგამტარების ინდუსტრიაში გამოსაყენებლად მიიღება დიბორანების დაშლით მაღალ ტემპერატურაზე და შემდგომ მას ასუფთავებენ გალღობით ან ე.წ. ზოხრალსკის პროცესებით.
წითელი ვარვარების ტემპერატურაზე ბორი შლის წყლის ორთქლს და გამოყოფს წყალბადს. ძლიერ მაღალ ტემპერატურაზე ბორი ენერგიული აღმდგენია. აზოტთან ან ამიაკთან ურთიერთქმედებით (700°C-ზე) ბორი წარმოქმნის ნიტრიდს - BN. ელექტროღუმელში ბორი უერთდება ნახშირბადს და წარმოქმნის კარბიდს (B4C), სილიციუმთან ურთიერთქმედებისას კი - სილიციდს (B4Si).
ბორწყალბადები
ბორი უშუალოდ წყალბადს არ უერთდება. ბორწყალბადები ანუ ბორანები მიიღება მაგნიუმბორიდზე მარილმჟავას მოქმედებით. ამ დროს მიიღება ექვსამდე სხვადასხვა ბორანი: B2H6(აირი), B4H10(აირი), B5H9(სითხე), B5H11(სითხე) და B10H14(მყარი). ყველაზე დიდი რაოდენობით წარმოიქმნება ”ბორბუტანი”.
წყლის მოქმედებით ბორანები ადვილად იშლება:
B2H6+ 6 H2O → 2 H3BO3+ 6 H2
ბორანების მოლეკულების სტრუქტურული აღნაგობის საკითხი საბოლოოდ არ არის გადაჭრილი. სავარაუდოდ ადგილი აქვს წყალბადური ბმის წარმოქმნას.
ბორწყალბადისა და ამიაკის ურთიერთქმედებით მიიღება ბორამიდები:
B2H6+ 2 NH3→ 2 H3BNH3(ანუ B2H6× 2 NH3)
ერთ-ერთი ბორამიდი (ბორაზოლი) B3N3H6უფერო სითხეა (Tდუღ 55°C) და თავისი აღნაგობით ჰგავს ბენზოლს (ექვსკუთხედი, რომელშიც B და N ატომები განლაგებულია მორიგეობით) და ამიტომ მას უწოდებენ არაორგანულ ბენზოლს.
ბორატებზე (ორთობორმჟავას მარილი) ტუტის მოქმედებით მიიღება მეტაბორატი:
Na2B4O7+ 2 NaOH → 4 NaBO2+ H2O
ბორატს იყენებენ მინანქრების, ჭიქურების და ოპტიკური მინის დასამზადებლად. როგორც ანტისეპტიკური საშუალება კონსერვების წარმოებაში და სხვა. ბორატი გამოიყენება აგრეთვე ლოთონების რჩილვის დროს - სარჩილავ ადგილზე ოქსიდების ფენის მოსაცილებლად აყრიან ბორატს. ბორატთან ზოგიერთი ლითონთა ოქსიდების შელღობისას უკანასკნელნი იხსნებიან მასში და B2O3-თან შეფერილ მარილებს (”მინებს”) წარმოქმნიან; მაგ. კობალტის ოქსიდთან იგი წარმოქმნის კობალტმეტაბორიტს - Co(BO2)2ლურჯ მინას, ქრომის ოქსიდთან მწვანე მინას - Cr(BO2)3.
ნატრიუმპერბორატი - NaBO3საუკეთესო სადეზინფექციო საშუალებაა. იგი გამოიყენება მატყლის, აბრეშუმის, შალის, სპილოს ძვლისა და ა.შ. გასარეცხად და გასათეთრებლად. იგი მიიღება შემდეგი რეაქციით:
NaBO2+ H2O2→ NaBO3+ H2O
ნატრიუმის ბორჰიდრიდი ცეცხლსაშიშია მისი აღმდგენი ბუნების გამო. ბორის ჰალოიდიდები კოროზიულია.
წარმოება
ბორის გლობალურმა ხარჯმა 2005 წელს რეკორდს მიაღწია - 1.8 მილიონი ტონა B2O3. ივარაუდება, რომ მომდევნო პერიოდში გაიზრდება მოთხოვნა აზიიდან, ევროპიდან და ჩრდილოეთ ამერიკიდან. ფორმა, რომლითაც მოიხმარება ბორი უკანასკნელ ხანებში, შეიცვალა. კოლემანიტის მსგავსი საბადოების გამოყენება შემცირდა შემდგომ დარიშხანის მოხმარებასთან დაკავშირებით. მომხმარებელი ეძებს სუფთა ბორატებს და ბორის მჟავას, რათა დაბინძურება იყოს ნაკლები. 1 გ კრისტალური ბორის საშუალო ფასია 5$ US.
ბორის მჟავაზე მოთხოვნის გაზრდამ გამოიწვია მწარმოებლების ინტერესის გაზრდა. კომპანიამ ”Eti Mine” თურქეთში გახსნა ახალი ბორის მჟავას ქარხანა, რომლის წარმოების მოცულობაა 100,000 ტონა წელიწადში (2003 წელი). Rio Tinto ჯგუფმა თავის ქარხანაში გაზარდა ბორის წარმოების მოცულობა წელიწადში 260,000 ტონიდან (2003) 310,000 ტონამდე (2005 წლის მაისი). ჩინური ბორის მწარმოებლებს უკვე შეუძლიათ დააკმაყოფილონ სწრაფად მზარდი მოთხოვნა უმაღლესი ხარისხის ბორატებზე. მათ 2005-2006 წლებში შეძლეს იმპორტის გაზრდა 100-ჯერ. დინატრიუმტეტრაბორატზე და ბორის მჟავაზე მოთხოვნა იმავე პერიოდში გაიზარდა 28%-ით.
გლობალურმა მოთხოვნამ მიგვიყვანა ბოჭკოვანი მინის და ბორსილიკატების პროდუქტების წარმოების ზრდამდე. მოთხოვნა მანუფაქტურული მდგრადი ბოჭკოვანი მინის წარმოებაზე თანდათან გაიზარდა აზიაში, რამაც დასვა საკითხი განვითარებულიყო ბორისაგან თავისუფალი ბოჭკოვანი მინის მიღების ტექნოლოგიები.
ენერგიის ხარჯების ბოლოდროინდელმა ზრდამ შეიძლება მიგვიყვანოს ბოჭკოვანი მინის გამოყენების იზოლაციასთან , რაც გამოიწვევს ბორის ხარჯების შემცირებას. Roskill Consulting ჯგუფმა გაიანგარიშა ბორის მსოფლიო ხარჯი, რომელიც შეიძლება გაიზარდოს წელიწადში 3.4%-ით და 2010 წლისათვის მიაღწიოს 21 მილიონ ტონას.

მანგანუმის დიბორიდის სუპერგამტარის ბურთულ-ღეროვანი მოდელი. ბორის ატომები განლაგებულია არომატული გრაფიტის მაგვარ შრეებად თითოეულ ბორის ატომზე -1 მუხტით. მანგანუმ (II) იონები განთავსებულია შრეებს შორის
გამოყენება
ბორი წარმოადგენს კოროზია და სითბომედეგი ნალღობების, კომპოზიციური მასალების (ბოროპლასტმასების), ასევე ბირთვული რეაქტორების მარეგულირებელი დანადგარების კომპონენტს. ბორი აგრეთვე გამოიყენება ფოლადის ნაკეთობების ზედაპირის ბორირებაში მისი მექანიკური და კოროზიული თვისებების გასაუმჯობესებლად და ნახევარგამტარების ინდუსტრიაში.
ბორი მცირე რაოდენობით (პროცენტის მეათასედი ან მეათიათასედი ნაწილი) შეჰყავთ ფოლადში და ზოგიერთ ფერად ნალღობებში (მაგ. ბრონზა). ბორი ფოლადში შემავსებლად შეჰყავთ 0.003%, ბორი ფერობორიდის სახით ზრდის წრთობის ადგილის სიღრმეს და ამით ზრდის ნაკეთობის მდგრადობას.
ბორის ნაერთები გამოყენებულია მიკროსასუქებად. დიდი მნიშვნელობა აქვთ ბორმჟავასა და ბორატებს.
საიზოლაციო საშუალებები
ბორის ნაერთებიდან უმთავრესად გამოიყენება ნატრიუმტეტრაბორატჰეპტაჰიდრატი (Na2B4O7), რომელიც გამოიყენება საიზოლაციო ბოჭკოვანი მინებისა და ნატრიუმის პერბორატის დასამზადებლად.
დეტერგენტები და მათეთრებელი აგენტები
ბორატი გამოიყენება სარეცხ საშუალებებში, როგორც მათეთრებელი დანამატი. განსაკუთრებით კი მნიშვნელოვანია ნატრიუმის პერბორატი. იგი წარმოადგენს აქტიური ჟანგბადის წყაროს ბევრ დეტერგენტში, სარეცხ საშუალებებში და მათეთრებლებში. იგი აგრეთვე გვხვდება ზოგიერთი კბილის მათეთრებლის ფორმულაში.
მინა და კერამიკა

ბორაქსის კრისტალი

ბოროსილიკატური მინა
აშშ-ში ბორის 70% გამოიყენება მინისა და კერამიკის წარმოებაში.
ბორსილიკატურ მინას, რომლის ტიპიური შედგენილობაა 12-15% B2O3, 80% SiO2და 2% Al2O3, თერმული გაფართოების დაბალი კოეფიციენტი აქვს, და შესაბამისად თერმული შოკის მიმართ დიდად გამძლეა. დურანი და პირექსი არის ორი მთავარი ბრენდი ამ ტიპის მინებისთვის.
ბორის ბოჭკოები (ძაფები) ძალიან მდგრადი მსუბუქი მასალებია, რომელიც გამოიყენება აეროსივრცეში როგორც კომპოზიციური მასალების კომპონენტი, ასევე სპორტული ინვენტარისათვის, როგორიცაა გოლფის ჯოხი და სათევზაო ანკესი. ბოჭკოები შეიძლება მივიღოთ ბორის ორთქლის მოქმედებით ვოლფრამის ძაფზე.
ბირთვულ რეაქტორებში ბორით დაცვა
ბორით დაცვა გამოიყენება ბირთვულ რეაქტორებში ბირთვულ რეაქციების კონტროლისათვის. იგი ხელს უწყობს ნეიტრონების დაჭერას.
ნახევარგამტარების ინდუსტრია
ბორი უმნიშვნელოვანესი ტექნოლოგიური მასალაა ისეთი ნახევარგამტარებისათვის, როგორიცაა სილიკონი, გერმანიუმი და სილიციუმკარბიდი. ბორის ნახევარგამტარად გადაქცევის ტრადიციულ მეთოდს წარმოადგენს მისი ატომური დიფუზია მაღალ ტემპერატურაზე. ამ პროცესში აგრეთვე გამოიყენება მყარი (B2O3), თხევადი (BBr3) და აირადი (B2H6ან BF3) ბორის წარმოებულები. თუმცა 1970 წლის შემდეგ ბორის მიღების წყაროდ გამოყენებულია BF3. ნახევარგამტარების ინდუსტრიაში ბორტრიქლორის აირი აგრეთვე მნიშვნელოვანი ნაერთია. ბორის წყაროდ რეაქტორებში აგრეთვე გამოიყენება ტრიეთილბორანი. ასევე გამოიყენება ბორის შემცველი მძიმე ნახშირბადის აპკი, სილიციუმის ნიტრიდისა და ბორის ნიტრიდის ნარევის აპკები.
საინჟინრო მასალა
ბორის კარბიდი, რომელიც წარმოადგენს ძირითად კერამიკულ მასალას, მიიღება B2O3-ის შეერთებით ნახშირბადთან ელექტრულ ღუმელში.
2 B2O3+ 7C → B4C + 6 CO
იგი გამოიყენება ტანკების, ტყვიაგაუმტარი ჟილეტების ჯავშნისათვის. მათ ასევე შეუძლიათ ნეიტრონების შთანთქმა და ამ დროს არ წარმოქმნიან სიცოცხლისუნარიან რადიობირთვებს. ამიტომ იგი შეიძლება მძლავრ ქარხნებში გამოყენებულ იქნას წარმოქმნილი რადიაციის შთანთქმისათვის.
BCN და BeB2ნაერთების მექანიკური თვისებები მასალა ალმასი კუბური BC2N კუბური BC5კუბური BN B4C BeB2ვიკერის სიმაგრე (გპა) 115 76 71 62 38 22 მსხვრევისადმი მდგრადობა (მპა მ1/2) 5.3 4.5 9.5 6.8 3.5
ბორის ნაერთები ცნობილია თავიანთი გამორჩეული სიმაგრით და მდგრადობით, ესენია:
ჰეტეროალმასი ( BCN)
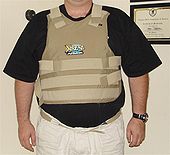
ბორის კარბიდი გამოიყენება ბალისტიკური დამცავი ჟილეტების წარმოებაში
ეს ნაერთი ნახშირბადის მიმართ იზოელექტრულია, მას აქვს როგორც ჰექსაგონალური (რბილი გრაფიტის მსგავსი - h-BN) და კუბური (მაგარი, ალმასის მსგავსი c-BN) ფორმები. h-BN გამოიყენება როგორც მარალტემპერატურული კომპონენტი და საპოხი ნივთიერება. c-BN აგრეთვე ცნობილია კომერციული სახელწოდებით ბორაზონი. ეს არის საუკეთესო გასაპრიალებელი მასალა. მისი სიმაგრე მცირედ ნაკლებია, მაგრამ ქიმიური სტაბილურობით აღემატება ალმასს.
რენიუმ დიქლორიდი შეიძლება მივიღოთ ჩვეულებრივი წნევის დროს, მაგრამ იგი ძალზედ ძვირია რენიუმის გამო. ReB2-ის სიმაგრე ჩანს შედარებით ანიზოტროპული, რადგანაც მას აქვს ჰექსაგონალური ფენოვანი სტრუქტურა. შეიძლება შევადაროთ ვოლფრამის კარბიდს, სილიციუმის კარბიდს, ტიტანიუმის დიბორიდს ან ცირკონიუმის დიბორიდს.
AlMgB14+ TiB2კომპოზიტს აქვს მაღალი სიმაგრე და ცვეთამედეგობა. ამიტომ გამოიყენება როგორც შესაფუთი მასალა მაღალი ტემპერატურისაგან დასაცავად.
ბორის კარბიდი და კუბური ბორის ნიტრიდი ფართოდ გამოიყენება სახეხი მასალების დასამზადებლად. მეტალური ბორიდები გამოიყენებიან საგნების შესაფუთად ქიმიური და ფიზიკური ზემოქმედებისაგან დასაცავად.
გამოყენების სხვა სფეროები
ბორი არის ნეოდინიუმ მაგნიტის (Nd2Fe14B) შემადგენელი კომპონენტი, რომელიც ფართოდ გამოიყენება ელექტროტექნიკაში, ელექტრულ მექანიზმებში, როგორიცაა მაგნიტურ რეზონანსული გამოსხივება (მრგ), სხვადასხვა სახის ძრავები და კომპიუტერები HDDs, CD და DVD ფლეიერები, მობილური ტელეფონები, დროის ჩამრთველები, მოლაპარაკე აპარატები და ა.შ.
სახამებლის და კაზეინის შემცველი ადგეზიურ მასალები დანამატის სახით მოიცავს ნატრიუმის ტეტრაბორატდეკაჰიდრატს (Na2B4O7·10H2O). იგი ასევე შედის ანტიკოროზიულ სისტემებში.
ნატრიუმის ბორატები გამოიყენება როგორც ფლუსი ვერცხლის და ოქროს შესალღობად სხვა მეტალებთან ამონიუმის ქლორიდის თანაობისას. ისინი, როგორც ცეცხლმედეგი ნაერთები ემატებიან პლასტიკატებს და რეზინის ნაწარმებს.
ბორის მჟავა (იგივე ორთობორის მჟავა) H3BO3გამოიყენება ბოჭკოვანი მინის წარმოებაში და მინის პანელების მოსაწყობად.
ბორის მჟავას აგრეთვე აქვს ანტისეპტიკური, ანტისოკოვანი და ანტივირუსული თვისებები და ამიტომ იგი გამოიყენება როგორც წყლის გამწმენდი საშუალება საცურაო აუზებში. ბორის მჟავა ასევე ტრადიციულად გამოიყენება როგორც ცნობილი პრეპარატი ჭიანჭველების, რწყილების და ტარაკნების საწინააღმდეგოდ.
მაგნიუმდიბორატი არის მნიშვნელოვანი სუპერგამტარი მასალა 39K ტემპერატურაზე. MgB2-ის მავთული მიიღება მძლავრი პროცესების დროს ღუმელებში და გამოიყენება სუპერგამტარ მაგნიტში.
იგი ასევე გამოიყენება, როგორც ლღობის ტემპერეტურის დეპრესანტი ნიკელ-ქრომის შენალღობში.
ბიოლოგიური როლი
ბორის შემცველი ბუნებრივი ანტიბიოტიკი ბორომიცინი გამოყოფილია სტრეპტომიცინისაგან. ბორი არის მცენარეებისათვის აუცილებელი საკვები ელემენტი. იგი უპირველესად საჭიროა უჯრედის გარსის ინტეგრირებისათვის. მარილის მაღალ კონცენტრაციას >1.0 მნ შეუძლია გამოიწვიოს ფოთლებში მარგინალური და ნაწილობრივი ნეკროზი, ხოლო დაბალი კონცენტრაციის დროს (<0.8 მნ) შეიძლება ადგილი ჰქონდეს იგივე სიმპტომებს.
ბორი აუცილებელია ვირთხების ჯანმრთელობისათვის, იგი ასევე აუცილებელია სხვა ძუძუმწოვრებისათვის.
ბორის როლი ცოცხალ ორგანიზმში არ არის სრულად დადგენილი. ადამიანის კუნთოვანი ქსოვილი შეიცავს (0.33–1)×10‑4% ბორს, ძვლოვან ქსოვილი (1.1–3.3)×10–4% –ს, ხოლო სისხლი – 0.13მგ/ლ. ყოველდღიურად საკვებიდან ადამიანი ღებულობს 1–3მგ ბორს. ბორის ნაერთები მოსალოდნელია გამოყენებულ იქნას ართრიტების სამკურნალოდ.
ელემენტი ბორი და ბორატები არატოკსიკურია ადამიანისა და ცხოველებისათვის (დაახლოებით მსგავსია სუფრის მარილისა). LD50(დოზა, რომლის დროსაც 50% არის სასიკვდილო) ცხოველებისათვის არის დაახლოებით 6გ/კგ-ზე წონის მიხედვით. ნივთიერებები დოზით LD502გ-ზე ზევით არ არის ტოკსიკური. მინიმალური ლეტალური დოზა ადამიანებისათვის არ არის დადგენილი, მაგრამ აღნიშნული იყო რომ 4 გ დღეში არის ინციდენტების გარეშე და ბორის მჟავას სამკურნალო დოზაა 20 გ. თევზი ძლებს ბორის მჟავას ნაჯერ ხსნარში 30წთ-ის განმავლობაში და უფრო მეტ ხანს ბორაქსების კონცენტრირებულ ხსნარებში. ბორიტები უფრო ტოკსიკურებია მწერებისათვის, ვიდრე ძუძუმწოვრებისათვის. ბორანები და მსგავსი აირადი ნაერთები საკმაოდ მომწამვლელია.
ბორანები (ბორის წყალბად ნაერთები) ტოქსიკურია, ადვილად აალებადია და მოითხოვს სპეციალურ შენახვას.
ანალიზური მეთოდები
საკვებში ან ნივთიერებებში ბორის რაოდენობის განსაზღვრისათვის გამოიყენება კოლორიმეტრული მეთოდი. ბორი გარდაიქმნება ბორის მჟავად ან ბორატებად, რომელიც მჟავა არეში კურკუმინის ქაღალდთან იძლევა წითელ კომპლექსს - როსოციანინს. კურკუმინი ყვითელი სტილბენური საღებარია.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით



