ცირკონიუმი
ცირკონიუმი Zr ქიმიური ელემენტია ატომური ნომრით 40. მისი ატომური მასა 91.224. იგი მბზინავი, რუხი–თეთრი ფერის, გარდამავალი მეტალია და ჰგავს ტიტანს. ცირკონიუმი გამოიყენება როგორც შემლღობი აგენტი მისი კოროზიამედეგობის გამო. ბუნებაში ცირკონიუმი თავისუფალი სახით არ მოიპოვება. იგი ძირითადად მიიღება მინერალ ცირკონისაგან, რომელიც შეიძლება გასუფთავდეს ქლორით. ცირკონიუმი სუფთა სახით პირველად 1824 წელს მიიღო ჯ.ბერცელიუსმა.
იგი შედის როგორც არაორგანულ, ასევე ორგანულ ნაერთებში. არსებობს მისი ხუთი ბუნებრივი იზოტოპი, რომელთაგან სამი სტაბილურია. ცირკონიუმს ბიოლოგიური როლი არ არის ცნობილი. ცირკონიუმის ფხვნილი იწვევს მცირეოდენ გაღიზიანებას, ხოლო მისი ნაერთების შესუნთქვას შეუძლია გამოიწვიოს კანის და ფილტვების დანაწევრება.
ისტორია
ცირკონიუმის შემცველი მინერალი - ცირკონი და აგრეთვე მისი სხვადასხვა ვარიაციები (ჯარგენი, ბიასინთი, ჯისინთი, ლიგარი) მოიხსენიება ჯერ კიდევ ბიბლიურ წერილებში. 1789 წლამდე არ იყო ცნობილი, რომ მინერალი შეიცავდა ახალ ელემენტს. კლაპროტმა ახალ ელემენტს უწოდა ცირკონერდი (ცირკონი). ჰ.დეივი შეეცადა ეს ახალი ელემენტი 1808 წელს გამოეყო ელექტროლიზით, მაგრამ ვერ შეძლო.
ცირკონიუმი (სირიული – zargono, არაბული zurken, სპარსული zungun – ნიშნავს „ოქროს მსგავსს") პირველად 1824 წელს სუფთა სახით გამოყო ჯ. ბერცელიუსმა კალიუმისა და კალიუმ–ცირკონიუმ ფთორიდის ნარევის გაცხელებით. შემდგომ სახელმა განიცადა ადაპტირება და დრეს იგი იწოდება ცირკონიუმად (zirkon და zirconium).
სუფთა მეტალური ცირკონიუმი კომერციული მიზნებისათვის პირველად მიიღო ა. არკელმა და ჯ. ბოიერმა 1925წ. პროცესი მოიცავდა ცირკონიუმტეტრაიოდიდის დაშლას. იგი შემდგომში 1945 წელს ჩაანაცვლა უფრო იაფი კროლის პროცესმა, რომელშიც ცირკონიუმტეტრაქლორიდი იხლიჩებოდა მაგნიუმით.
გავრცელება
ცირკონიუმი ეკუთვნის გაბნეული მეტალების რიცხვს. დედამიწის ქერქში მისი კონცენტრაცია შეადგენს დაახლოებით 130 მგ/კგ და დაახლოებით 0.026 მკგ/ლ – ზღვის წყალში.
იგი არასოდეს გვხვდება ბუნებაში სუფთა მეტალის სახით. ცირკონიუმის ძირითადი სამრეწველო წყაროა ცირკონიუმ–სილიკატ მინერალი – ცირკონი (ZrSiO4), რომელიც გვხვდება ავსტრალიაში, ბრაზილიაში, ინდოეთში, რუსეთში, სამხრეთ აფრიკასა და აშშ–ში, თუმცა მისი დეპოზიტები მთელ მსოფლიოშია მცირე რაოდენობით.
ცირკონის 80% არის ავსტრალიასა და აფრიკაში. მისი რესურსი მსოფლიოში აღწევს 60 მილიონ ტონას, ხოლო ყოველწლიური მსოფლიო წარმოება შეადგენს დაახლოებით 900 000 ტ.
მცირე რაოდენობით ცირკონიუმი აგრეთვე გვხვდება 140–ზე მეტ მინერალში, მათ შორის ბადელიტსა და კოსნარიტში.
იზოტოპები
ბუნებრივი ცირკონიუმი გვხვდება ექვსი იზოტოპის სახით: 90Zr, 91Zr და 92Zr სტაბილურებია.94Zr –ის ნახევარდაშლის პერიოდია 1.10×1017 წელი, 96Zr–ის ნახევარდაშლის პერიოდია 2.4×1019 წელი, რომელიც წარმოადგენს ყველაზე დღეგრძელ რადიოიზოტოპს. ამ ბუნებრივი იზოტოპებიდან 90Zr ყველაზე გავრცელებულია.
სინთეზირებულია 28 ხელოვნური იზოტოპი, რომელთა ატომური მასებია 78–დან 110–მდე. მათ შორის 93Zr ყველაზე დღეგრძელი იზოტოპია (ნახევარდაშლის პერიოდია 1.53×106). 110Zr (ცირკონიუმის ყველაზე მძიმე იზოტოპის) ნახევარდაშლის პერიოდია 30 მილიწამი. ცირკონიუმს აგრეთვე აქვს ექვსი მეტასტაბილური იზოტოპი: 83mZr, 85mZr, 89mZr, 90m1Zr, 90m2Zr და 91mZr. მათგან 90m2Zr–ის ნახევარდაშლის პერიოდია 4.161 წთ.
ფიზიკური თვისებები
ცირკონიუმი მბზინავი, მორუხო–თეთრი ფერის, რბილი, დრეკადი, ადვილად დასამუშავებელი მეტალია, რომელიც ოთახის ტემპერატურაზე მყარია. იგი დაბალი სისუფთავის დროს ხდება მძიმე და მყიფე.
ცირკონიუმის ლღობის ტემპერატურაა 1855 °C, ხოლო დუღილის ტემპერატურა - 4409°C. მისი ელექტროუარყოფითობა 1.33 ტოლია . d – ჯგუფის ელემენტებს შორის, ცირკონიუმს იტრიუმის ლუტეციუმის და ჰაფნიუმის შემდეგ აქვს უდაბლესი ელექტროუარყოფითობა.
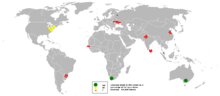
ცირკონიუმის მოპოვება 2005 წელს
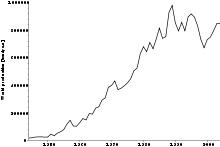
ცირკონიუმის მარილების მსოფლიო წარმოება

ცირკონიუმის ზოდი
ქიმიური თვისებები
ცირკონიუმი ფხვნილის სახით აალებადია, მაგრამ მყარი ფორმით ძნელად იწვის. იგი ძლიერ მდგრადია ტუტეების, მჟავების, მარილთა ხსნარებისა და სხვა აგენტების მოქმედების მიმართ. შესაბამისად, კოროზია მედეგია.
ფთორის თანაობისას იხსნება ქლორწყალბადმჟავასა და გოგირდმჟავაში.
მისი შენადნობი თუთიასთან მაგნიტური ხდება 35k ტემპერატურაზე ქვემოთ.
ცირკონიუმი, როგორც გარდამავალი მეტალი, წარმოქმნის მრავალ არაორგანულ ნაერთს, როგორიცაა ცირკონიუმის დიოქსიდი (ZrO2). ეს ნაერთი, რომელსაც ასევე მოიხსენიებენ, როგორც ცირკონია, წარმოადგენს ქიმიურად მდგრად ნაერთს, განსაკუთრებით კუბურ ფორმაში. ამ თვისებების გამო იგი გამოიყენება თერმულ ბარიერული დანაფარების მისაღებად. იგი აგრეთვე ანაცვლებს ალმასს.
ცირკონიუმის ვოლფრამის მჟავას მარილი, წარმოადგენს არაჩვეულებრივ ნივთიერებას, რომელშიც ის იკუმშება გაცხელებისას, მაშინ როცა უმეტესი ნაერთები გაცხელებისას ფართოვდება.
ZrZn2 ერთ–ერთი ამათგანია, რომელიც ამჟღავნებს ზეგამტარ თვისებებს და ახასიათებს ფერომაგნიტიზმი.
ცირკონიუმის სხვა არაორგანული ნაერთებია ცირკონიუმ (III) ჰიდრიდი, ცირკონიუმ ნიტრიდი და ცირკონიუმ ტეტრაქლორიდი (ZrCl4.). ეს უკანასკნელი გამოიყენება ფრიდელ–კრაფტსის რეაქციებში.
გამოყენება
ცირკონიუმი თავისი მაღალი კოროზომედეგობის გამო ხშირად გამოიყენება შენადნობებში, როგორც კოროზიის საწინააღმდეგო აგენტი.
ცირკონიუმის დიოქსიდი (ZrO2) გამოიყენება ლაბორატორიულ ტიგელებში, მეტალურგიულ ბრძმედებში, როგორც გამძლე მასალა.
ცირკონით (ZrSiO4) მზადდება ნახევრად ძვირფასი ქვები, რომელთაც იყენებენ საიუველირო საქმეში.
ცირკონიუმის კარბონატი (3ZrO2·CO2·H2O) გამოყენებული იყო ლოსიონებში, მაგრამ შემდგომში შეწყვიტეს, რადგანაც კანს აღიზიანებდა.
ცირკონიუმის წარმოების 90% გამოიყენება ბირთვულ რეაქციებში (ცირკონიუმის შენადნობის მისაღებად), რადგანაც იგი ნეიტრონებს ნაკლებად აკავებს და კოროზიულად მდგრადია.
ცირკონიუმი გამოიყენება შეიარაღებაში როგორც BLU-97/B, რომელსაც აქვს ცეცხლაალების ეფექტურობა.
ცირკონიუმის ფხვნილი მაგნიუმთან ერთად (60% Zr და 40% Mg) იხმარება უკვალო აალებისთვის.
ZrO2 გამოიყენება ცეცხლგამძლე ჭურჭლის წარმოებაში. ცირკონიუმის დიოქსიდი და მისი ზოგიერთი სხვა ნაერთი (სილიკატი, კარბონატი, ფოსფატი) იხმარება როგორც თეთრი მინერალური საღებარი და აგრეთვე მინანქრის წარმოებაში.
ცირკონიუმის კარბიდი გამოყენებას პოულობს მინის საჭრელად და როგორც სახეხი მასალა, აგრეთვე გამოიყენება ელ. ნათურების ძაფებად.
წარმოება
ცირკონიუმი წარმოადგენს ტიტანის მინერალის ილუმინიტის და რუტილის საბადოების გადამუშავების თანაურ პროდუქტს.
2003–დან 2007წ–მდე ცირკონიუმის ფასი გაიზარდა $360–დან $840–მდე.მეტალი კომერციულად მიიღება ცირკონიუმ (IV) ქლორიდის აღდგენით მეტალური მაგნიუმის საშუალებით (კროლ–პროცესში).
ბიოლოგიური როლი
ცირკონიუმის ბიოლოგიური როლი არ არის ცნობილი, თუმცა დადგენილია, რომ მის მარილებს აქვთ დაბალი ტოქსიკურობა. ადამიანის ორგანიზმი შეიცავს, საშუალოდ, მხოლოდ 1 მგ ცირკონიუმს და დღიურად იგი ღებულობს დაახლოებით 50 მკგ.
ცირკონიუმის შემცველობა ადამიანის სისხლში 10 მნ-ზე ნაკლებია. წყალმცენარეები იწოვენ ხსნად ცირკონიუმს, რაც იშვიათია ხმელეთის მცენარეებში. მცენარეების 70% არ შეიცავს ცირკონიუმს.
ცირკონიუმის ფხვნილმა შეიძლება გამოიწვიოს თვალის გაღიზიანება, ხოლო ცირკონიუმის ნაერთების ჩასუნთქვამ კი შეიძლება გამოიწვიოს ფილტვების და კანის დასკდომა. ცირკონიუმის ტეტრაქლორიდი ზრდის ვირთხებისა და ზღვის გოჭების სიკვდილიანობას. ასევე ძაღლებში დაბლა წევს ჰემოგლობინს და სისხლის წითელ უჯრედებს.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით



