ნატრიუმი
ნატრიუმი ელემენტთა პერიოდულობის ცხრილში არის მესამე პერიოდის, პირველი ჯგუფის მთავარი ქვეჯგუფის ელემენტი, რიგობრივი ნომრით 11. აღინიშნება სიმბოლოთი Na. სუფთა ფორმით ნატრიუმი რბილი მოვერცხლისფრო თეთრი მეტალია, რომელიც სწრაფად იჟანგება ჰაერზე.
ისტორია
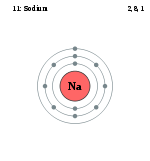
ნატრიუმის ატომის სქემა
ნატრიუმი (ან უფრო სწორად, მისი ნაერთები) გამოიყენება უძველესი დროიდან. მაგალითად, სოდა ბუნებაში გვხვდება ეგვიპტის ტბებში. ბუნებრივ სოდას ძველი ეგვიპტელები ბალზამირებისთვის, ტილოს გამოსახარშად, საკვების ხარშვისას, საღებავებისა და ჭიქურების მოსამზადებლად იყენებდნენ. პლინიუს უფროსი წერდა, რომ ნილოსის დელტაში (მასში იყო საკმარისი რაოდენობის მინარევი) სოდას გამოყოფდნენ მდინარის წყლიდან. ის გაყიდვაში ხვდებოდა დიდი ნაჭრების სახით, რომელიც ნახშირის მინარევის გამო იყო ნაცრისფერი ან ზოგჯერ შავი ფერის.
მეტალური ნატრიუმი პირველად მიიღო ბრიტანელმა ქიმიკოსმა ჰემფრი დევისმა 1807 წელს ნატრიუმის ჰიდროქსიდის გამლღვალი მასის ელექტროლიზით. მისი სახელწოდება წარმოქმნილია არაბული სიტყვის ”ნატრონ”-დან და ბერძნული სიტყვიდან ”ნიტრონ”-ი, რაც სოდას ნიშნავს. თვითონ ელემენტს თავიდან უწოდებდნენ სოდას (ლათ. sodium).
მიღება
ნატრიუმის მიღების უძველესი მეთოდი იყო ნატრიუმის კარბონატის აღდგენა ნახშირით, ნარევის გაცხელებით რკინის ჭურჭელში 1000 °C-მდე.
Na2CO3 + 2C = 2 Na + 3 CO
დღეს ნატრიუმს სამრეწველო მასშტაბით იღებენ ნატრიუმის ჰიდროქსიდის ან ნატრიუმის ქლორიდის ელექტროლიზით.
ფიზიკური თვისებები
ნატრიუმი არის მოვერცხლისფრო თეთრი, პლასტიკური, რბილი (ადვილად იჭრება დანით) მეტალი. თხელ ფენას აქვს იასამნისფერი შეფერილობა. ახლად გაჭრილი ნატრიუმი ბზინავს. ნატრიუმის ელექტროგამტარობისა და თბოგამტარობის სიდიდე საკმაოდ მაღალია, სიმკვრივე - 0.96842 გ/სმ3 (19.7°C დროს), დნობის ტემპერატურა 97.86 ° C, დუღილის ტემპერატურა 883.15 ° C.
წნევის ქვეშ ხდება გამჭვირვალე და წითელი როგორც ლალი.
ქიმიური თვისებები
ნატრიუმი ტუტე მეტალია, რომელიც ჰაერზე ადვილად იჟანგება - შედის ჟანგბადთან რეაქციაში და მისი ზედაპირი იფარება ოქსიდის თხელი ფენით, მასთან ერთად წარმოიქმნება ჰიდროქსიდი და ნატრიუმის კარბონატი ატმოსფეროში არსებულ წყლის ტენსა და ნახშირბადის დიოქსიდთან ურთიერთქმედების გამო:
4Na + O2 → 2Na2O
Na2O+CO2 → Na2CO3
ჰაერის ჟანგბადისაგან დასაცავად მეტალურ ნატრიუმს ინახავენ ნავთში.
ნატრიუმი აზოტთან ურთიერთქმედებს გაცხელებით:
2 Na + 3 N2 = 2 NaN3
ჭარბ ჟანგბადთან ურთიერთქმედებისას წარმოიქმნება ნატრიუმის ზეჟანგი (ნატრიუმის პეროქსიდი):
2Na + O2 = Na2O2
ნატრიუმი, განსხვავებით კალიუმისა და რუბიდიუმისაგან, ჰაერზე გახურებით ისე ლღვება, რომ არ განიცდის აალებას. ჰაერზე გახურებისას დუღილის ტემპერატურამდე (883 °C) ნატრიუმი იწვის ყვითელი ალის წარმოქმნით. მისი ეს თვისება საფუძვლად უდევს ნატრიუმის ემისიურ ანალიზს.
თხევად ამიაკში გახსნისას იძლევა ამიდს: NaNH2
ცნობილია ნატრიუმის შენადნობები ზოგიერთ მეტალთან, როგორიცაა: ვერცხლისწყალი, ტყვია, კალა, ალუმინი და ყველა ტუტე ლითონთან.
ნატრიუმის ინტერმეტალურ ნაერთებს ვერცხლისწყალთან ამალგამა ეწოდება. (NaHg3, NaHg4, NaHg, Na2Hg Na3Hg2 Na5Hg2). ისინი ფართოდ გამოიყენებიან ორგანულ ქიმიაში, როგორც აღმდგენლები. ამალგამაში შემავალი ნატრიუმი ადვილად ჩაენაცვლება წყალბადს წყალში და სპირტებში.
ნატრიუმი რეაქციაში შედის აგრეთვე ეთილის სპირტთან ნატრიუმის ეთილატის წარმოქმნითა და წყალბადის გამოყოფით:
C2H5OH+Na → C2H5ONa+1/2H2
წყალთან ნატრიუმი ურთიერთქმედებს ენერგიულად, რეაქცია მიმდინარეობს წყალბადის გამოყოფით, რომელიც შეიძლება თვითნებურად აალდეს ან აფეთქდეს, მეტალის პატარა ნაჭრები ტივტივებენ წყლის ზედაპირზე.
2Na + 2H2O → 2NaOH + H2
როგორც ყველა ტუტე მეტალი, ნატრიუმიც ძლიერი აღმდგენია და ენერგიულად ურთიერთქმედებს მრავალ არამეტალთან (გამონაკლისია აზოტი, იოდი, ნახშირბადი და კეთილშობილი აირები) და ადვილად შედის რეაქციაში.
2Na + Cl2 → 2NaCl
განზავებულ მჟავებთან ურთიერთქმედებს როგორც ტიპური მეტალი:
2Na + 2HCl → 2NaCl + H2-
კონცენტრირებულ, დამჟანგველ მჟავებთან ურთიერთქმედებისას წარმოიქმნება აღდგენის პროდუქტები:
8Na + 10HNO3 → 8NaNO3 + NH4NO3 + 3H2O
ნატრიუმი იხსნება თხევად ამიაკში და წარმოიქმნება ლურჯი ხსნარი. რეაქცია მიმდინარეობს –40°C-ზე:
Na + 4NH3 → Na[NH3]4

ნატრიუმის თვისებითი განსაზღვრა ალის საშუალებით – კაშკაშა–ყვითელი ფერის ემისიური სპექტრი "ნატრიუმის D-ზოლი", დუბლეტი 588,9950 და 589,5924 ნმ.
ბიოლოგიური როლი
ორგანიზმში ნატრიუმის დიდი ნაწილი იმყოფება უჯრედს გარედან (დაახლოებით 15-ჯერ მეტია ვიდრე ციტოპლაზმაში). ამ განსხვავებას უზრუნველყოფს ნატრიუმ-კალიუმიანი ტუმბო, რომელიც ამოტუმბავს უჯრედის შიგნით მოხვედრილ ნატრიუმს.
კალიუმთან ერთად ნატრიუმი ასრულებს შემდეგ ფუნქციებს:
- მემბრანული პოტენციალისა და კუნთების შეკუმშვის შექმნის პირობები
- სისხლში ოსმოსური კონცენტრაციის შენარჩუნება
- მჟავა-ტუტე ბალანსის შენარჩუნება
- წყლის ბალანსის ნორმალიზაცია
- მემბრანული ტრანსპორტის უზრუნველყოფა
- მრავალი ენზიმის აქტივაცია
რეკომენდირებული დოზა ნატრიუმისა ბავშვებისათვის შეადგენს 600-დან 1700 მგრ-მდე, დიდებისათვის 1200-დან 2300 მგ-მდე. სუფრის მარილის სახით კი შეადგენს 3-დან 6 გრ-მდე დღეში.
თითქმის ყველა საკვები პროდუქტი შეიცავს ნატრიუმს, თუმცა ორგანიზმი დიდ წილს იღებს სწორედ სუფრის მარილიდან. მისი შეწოვა ძირითადად ხდება კუჭში და სწორ ნაწლავში. ვიტამინი D აუმჯობესებს ნატრიუმის ათვისებას, თუმცა, გადამლაშებული საკვები და ცილებით მდიდარი საკვები აფერხებს ნატრიუმის ნორმალურ შეწოვას. საკვებთან ერთად მიღებული ნატრიუმის რაოდენობა აჩვენებს ნატრიუმის შემცველობას შარდში.
ადამიანი, რომელსაც კვება დაბალანსირებული აქვს, არ შეიმჩნევა ნატრიუმის დეფიციტი, თუმცა, გარკვეული პრობლემა შეიძლება წარმოიშვას ვეგეტარიანული დიეტის დროს. დროებითი დეფიციტი შეიძლება წარმოიშვას შარდმდენი საშუალების, ფაღარათის, ჭარბი ოფლიანობის ან ჭარბი რაოდენობით წყლის მიღების შემთხვევაში. ნატრიუმის უკმარისობის სიმპტომებს წარმოადგენს წონის დაკარგვა, გულისრევა, გაზების წარმოქმნა კუჭ-ნაწლავის ტრაქტში. ხანგრძლივი დეფიციტი კი იწვევს კუნთების სპაზმს და ნევრალგიას.
ჭარბი ნატრიუმი იწვევს ფეხისა და სახის შესივებას, ასევე კალიუმის სწრაფად გამოდევნას შარდით. მაქსიმალური რაოდენობა მარილის, რომელიც შესაძლებელია გადამუშავებულ იქნას თირკმლების მიერ დაახლოებით შეადგენს 20-30 გრ-ს, უფრო მეტი რაოდენობა კი საშიშია ჯანმრთელობისათვის.
გამოყენება

მეტალური ნატრიუმი. ინახება ნავთში
ლითონური ნატრიუმი ფართოდ გამოიყენება პრეპარატულ ქიმიაში და მრეწველობაში (მათ შორის მეტალურგიაში), როგორც ძლიერი აღმდგენელი.
ნატრიუმი გამოიყენება საკმაოდ ენერგოტევადი ნატრიუმ-გოგირდოვანი აკუმულატორების წარმოებაში. იგი ასევე გამოიყენება სატვირთო მანქანებში გამომშვებ სარქველებში როგორც სითბოწამრთმევი დანამატი. იშვიათად, მეტალური ნატრიუმი გამოიყენება როგორც ელექტროგამტარი მასალა, რომელიც გათვალისწინებულია ძალიან მაღალი დენისათვის.
ნატრიუმის კალიუმთან, ასევე რუბიდიუმთან და ცეზიუმთან შენადნობები გამოიყენება როგორც მაღალეფექტური თბოგადამტანები. შენადნობს შემადგენლობით ნატრიუმი 12%, კალიუმი 47%, ცეზიუმი 41% ახასიათებს დნობის ტემპერატურის რეკორდულად დაბალი მაჩვენებელი Tდნ= - 78° C, ამიტომ იგი შეთავაზებულია როგორც მუშა სხეული იონური სარაკეტო ძრავებისათვის და თბოგადამტანი ატომური ენერგო დანადგარებისათვის. ნატრიუმი ასევე გამოიყენება მაღალი და დაბალი წნევის აირგანმუხტვად ნათურებში. მაღალი წნევის ნატრიუმიანი ნათურები წარმოადგენენ ერთ-ერთ ყველაზე ეფექტურ სინათლის წყაროს. ამ ტიპის ნათურები ფართოდ გამოიყენება ქუჩის განათებაში, იძლევიან კაშკაშა ყვითელ ფერს, ხანგრძლივობა შეადგენს 12-24 ათას საათს, ამიტომაც ისინი შეუცვლელია ქალაქის, არქიტექტურული და საწარმოო განათებისათვის.
მეტალური ნატრიუმი გამოიყენება ორგანული ნივთიერების თვისობრივი ანალიზისათვის.
ნატრიუმის ქლორიდი (სუფრის მარილი) - უძველესი დროიდან გამოიყენება კონსერვირებისათვის და გემოს მისაცემად.
ნატრიუმის აზიდი (NaN3) გამოიყენება როგორც მააზოტირებელი საშუალება მეტალურგიაში და ასევე ტყვიის აზიდის მისაღებად.
ნატრიუმის ციანიდი (NaCN) გამოიყენება ჰიდრომეტალურგიული მეთოდით ოქროს გამოსატუტად მთის ქანებიდან.
ნატრიუმის ქლორატი (NaClO3) გამოიყენება არასასურველი მცენარეების გასანადგურებლად რკინიგზის ლიანდაგებზე.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით



