"ქიმიის უწყებანი" ტომი:1, ნომერი:1, 17-22 გვ.
მელატონინისა და β-კარბოლინის ანალოგების შესახებ
ასოც. პროფესორი, საქართველოს ტექნიკური უნივერსიტეტი, 2335201
რეზიუმე: ექსპერიმენტალურად არის ნაჩვენები, რომ ეპიფიზის ჰორმონალური ნაერთის – მელატონინის და β-კარბოლინის ცხიმოვან-არომატული ანალოგები, რომლებიც მიეკუთვნებიან ზემოთ განხილული ნაერთების სერიას, სიმსივნის ზოგიერთი შტამის მიმართ ამჟღავნებენ კიბოს საწინააღმდეგო მოქმედებას.
საკვანძო სიტყვები: ეპიფიზი, გირჩისებრი ჯირჯვალი, მელატონინი, β-კარბოლინი
თანამედროვე ორგანული ქიმიის ერთ-ერეთ უმნიშვნელოვანეს ამოცანას წარმოადგენს მედიცინისა და სოფლის მეურნეობის გადაუდებელ მოთხოვნათა დასაკმაყოფილებლად ეფექტური ბიოლოგიურად აქტიური ნაერთების სინთეზი.
ახალი სამკურნალო პრეპარატების ძიებისათვის მოწოდებულია ორი ძირითადი პრინციპი, რომელთაგან პირველი მოიცავს ორგანული ნაერთების სკრინინგს, ანუ სინთეზირებული ნაერთების ბიოლოგიური აქტივობის შესწავლას სტანდარტული მეთოდების დახმარებით. ამის მაგალითს იძლევა აშშ-ში წარმოებული გრანდიოზული მასშტაბების კვლევები. ყოველწლიურად სინთეზირებული და ბიოლოგიურად შესწავლილი 40-50 ათასი პრეპარატიდან კლასიკური გამოცდისათვის რეკომენდაცია ეძლევა ერთ, ან უკიდურეს შემთხვევაში, ორ ნაერთს. მსოფლიოში დღეისათვის რეგისტრირებული და სამედიცინო პრაქტიკაში დანერგილია 4000-ზე მეტი სინთეზური პრეპარატი, ხოლო სამკურნალო საშუალებების საერთო რაოდენობა, რომლებიც ბუნებრივ ნაერთებს, ან ბუნებრივი და სინთეზური ნაერთების კომბინაციას წარმოადგენს. რამდენიმე ასეულ ათასს აღწევს [1,2].
მეორე მიმართულება, რომელიც ე.წ. ახალი, ბიოლოგიურად აქტიური ნაერთების მიზანდასახული სინთეზის სახელწოდებითაა ცნობილი, გულისხმობს ადრე დაგეგმილი ემპირიული კორელაციების განზოგადებას და გამოყენებას, რაც მომავალში ახალი ფიზიოლოგიურად აქტიური ნაერთების უფრო რაციონალური ძიების საშუალებას იძლევა.
მედიცინასა და სოფლის მეურნეობაში ხმარებული მრავალი სინთეზური პრეპარატი მიღებულია ცნობილი ბიოლოგიურად აქტიური ნივთიერებების სტრუქტურების მოდიფიკაციის საფუძველზე [3].
პოტენციური ბიოლოგიურად აქტიური ნაერთის სინთეზისათვის გამოსავალ პროდუქტებად შეიძლება გამოყენებულ იქნეს სხვადასხვა ალკალოიდები, ვიტამინები, ბიოგენური ამინები, სტეროიდული ჰორმონები, შაქრები, ამინომჟავები და სხვა ბუნებრივი ნაერთები.
ამ მხრივ აღსანიშნავია ეპიფიზი და მისი ძირითადი ჰორმონი – მელატონინი (N-აცეტილ-5-მეთოქსიტრიპტამინი), რომელიც გასული საუკუნის მეორე ნახევარში მსოფლიოს მეცნიერთა ყურადღების ცენტრში მოექცა და იგი სულ უფრო საინტერესო ხდება. ამის მიზეზს ერთი მხრივ წარმოადგენს მელატონინის ბიოლოგიური თვისებების საოცრად ფართო სპექტრი, ხოლო მეორე მხრივ, თვითონ ჯირკვალი ეპიფიზი – მუხუდოს მარცვლისოდენა ორგანო, რომელიც თავის ტვინის გეომეტრიულ ცენტრშია მოთავსებული (მას ასევე უწოდებენ “მესამე თვალს”).
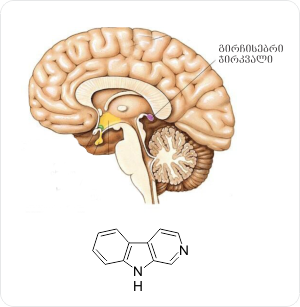
პირველი ცნობები ეპიფიზის, ანუ გირჩისებრი ჯირკვლის შესახებ ჯერ კიდევ 2 ათასი წლის გაჩნდა, თუმცა ორგანიზმში მისი ფუნქციური როლი ნეიროჰორმონ მელატონინის იდენტიფიკაციამდე გაურკვეველი რჩებოდა. დღეისათვის, მრავალრიცხოვანი გამოკვლევების საფუძველზე ცნობილია, რომ მელატონინი წარმოადგენს მრავალი ფიზიოლოგიური ფუნქციის რეგულატორსა და მოდულატორს [4,5].
მელატონინი, როგორც ბუნებრივი ქიმიური ნივთიერება შედის მთელი რიგი საკვები პროდუქტების შემადგენლობაში (ბრინჯი, ქერი, სიმინდი და ხორცი).
ორგანიზმში მელატონინი წარმოიქმნება ეპიფიზის უჯრედებში – პინეალოციტებში N-აცეტილსეროტონინისაგან. მისი სეკრეცია სისხლში ხდება ღამით. მელატონინის საშუალებით ეპიფიზი მონაწილეობს დღეღამურ ციკლში. დადგენილია, რომ ადამიანის ძილი მთლიანად დამოკიდებულია სინთეზირებული ჰორმონის რაოდენობაზე. ლიტერატურული მონაცემებით ეპიფიზში სეროტონინი გამომუშავდება დღისით და იგი მელატონინში გადადის ღამით. სინათლისა და სიბნელის ამგვარი მონაცვლეობა ასრულებს ერთგვარი ზამბარის როლს, რომელსაც მოძრაობაში მოყავს ეპიფიზში განლაგებული თავისებური ბიოლოგიური საათი [6,7]. აღსანიშნავია, რომ სწორედ ამ დროს იმუნური სისტემის აქტიურობა მაქსიმალურ პიკს აღწევს, ხოლო დღისით ჰორმონის სეკრეცია მცირდება [8,9]. ხშირ შემთხვევაში ნეიროდეგენერაციული პათოლოგია და სეზონური აფექტური აშლილობა გამოწვეულია მელატონინის ღამის სეკრეციის დაბალი დონით [10]. მელატონინი აქტიურად მონაწილეობს ენდოკრინული, იმუნური, ვეგეტატური და ცენტრალური ნერვული სისტემის რეგულაციაში [11], ავლენს ანტიოქსიდანტურ თვისებებს [12-14], წარმატებით გამოიყენება ოსტეოჰოროზის, გლაუკომის, ალცჰეიმერის, პარკისონის და სხვა დაავადებათა სამკურნალოდ [15,16]. მელატონინი ადვილად გადალახავს თავის ტვინის ჰემატოენცეფალურ ბარიერს და ხანგრძლივი მოხმარების შემთხვევაშიც კი არ იწვევს გვერდით მოვლენებს. მელატონინი ამჟამად რეკომენდირებულია აშშ-ში და ევროპის მრავალ ქვეყანაში, როგორც კვებითი დანამატი (აშშ-ის 1994 წლის აქტის შესაბამისად კვებითი დანამატის შესახებ – Dietary Supplement Health and Education Act).
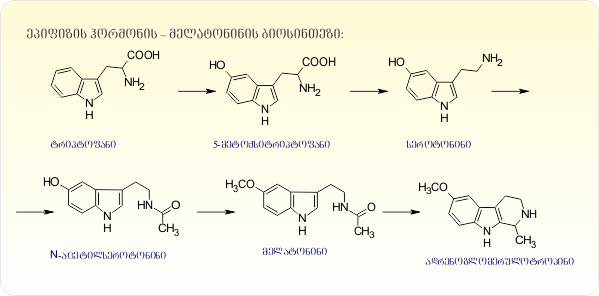
მრავალრივხოვანი გამოკვლევების საფუძველზე დადგენილია, რომ მელატონინი სელექციურად დამთრგუნველ მოქმედებას ავლენს კიბოს უჯრედების გამრავლებაზე და ამუხრუჭებს მათ მიტოზურ დაყოფას in vitro და in vivo პირობბებში. კერძოდ, in vitro ონკოსტატიკური ეფექტი ნაჩვენებია მკერდის ჯირკვლის კიბოსა და მელანომის უჯრედების კულტურებზე. ექსპერიმენტით დადგენილია აგრეთვე მისი მაინჰიბირებელი გავლენა საკვერცხეების კარცინომის. ნეირობლასტომების, ხორხის კიბოს, შარდის ბუშტისა და სიმსივნის სხვა სახეობათა მიმართ. ჯერჯერობით, სიმსივნის ზრდაზე მელატონინის მოქმედების მექანიზმი ბოლომდე არ არის გამოკვლეული [17].
აღსანიშნავია, რომ მელატონინის ციკლიზაციის პროდუქტი – ადრენოგლომერულოტროპინიც მაინჰიბირებელ გავლენას ახდენს ზოგიერთი სახის სიმსივნის ზრდაზე. საშვილოსნოს ყელის ბრტყელუჯრედოვანი კიბოთი დაავადებული პაციენტებისათვის ეპიფიზის ექსტრაქტის შეყვანა მკვეთრად აუმჯობესებს მათი ჯანმრთელობის მდგომარეობას, ხოლო ჯანმრთელ ორგანიზმში ეპიფიზის ფუნქციის დათრგუნვა კიბოს განვითარებას იწვევს. სტატიაში “ეპიფიზი და სიმსივნის ზრდა”, ვ.ნ. ანისიმოვი აღნიშნავს, რომ ჯერ კიდევ უცნობია, როგორც ეპიფიზის ექსტრაქტის კიბოს საწინააღმდეგო ეფექტის განმსაზღვრელი ნივთიერების ბუნება, ისე მათი მოქმედების მექანიზმი [18]. იგივე აზრს იზიარებენ მთელი რიგი ცნობილი ონკოლოგები, ამიტომაა, რომ ეპიფიზი და მისი მეტაბოლიზმის პროდუქტები უმნიშვნელოვანესი ფიზიოლოგიური ფუნქციების რეგულაციაში მათი როლის გარკვევის თვალსაზრისით, სულ უფრო მზარდ ყურადღებას იქცევენ [7,19,20]. უდავოა, რომ ამ რთული საკითხის გადაჭრაში მეცნიერებს დიდ დახმარებას გაუწევს გ.ა. ბუზნიკოვისა და მისი თანამოაზრეების კონცეფცია მედიატორების “კარნახით” უჯრედის დაყოფის მექანიზმის შესახებ. რომლის მიხედვითაც ორგანიზმის განვითარების ყველა სტადიაზე გადამწყვეტი როლი ენიჭება სეროტონინს, ტრიპტამინს და სხვა ბიოგენურ ამინებს [21]. ა.მ. ხელიმსკის მიხედვით, ეპიფიზის მიერ გამომუშავებული ჰორმონების, მათ შორის მელატონინის ბიოსინთეზის საწყისი პროდუქტია ტრიპტოფანი, რომლის გარდაქმნითაც მიიღება სეროტონინი. ამ უკანასკნელისაგან კი, ჯერ მიიღება N-აცეტილსეროტონინი, ხოლო შემდგომ – მელატონინი. მეტაბოლიზმის საბოლოო პროდუქტია ადრენოგლომერულოტროპინი [6,7].
ექსპერიმენტულ ქიმიოთერაპიაში მელატონინისა და მისი სტრუქტურული ანალოგების შესახებ ინფორმაცია არასაკმარისია. ამ საკითხით თავის დროზე დაინტერესებული იყვნენ და კვლევას აწარმოებდნენ ა. ელ-დომეირი და ტ. დას-გუფტა. მათ მიერ ნაჩვენები იყო, რომ ცხოველების ორგანიზმიდან ეპიფიზის ამოკვეთა იწვევს ტრანსპლანტირებული მელანომის სწრაფ ზრდას. ამ პროცესის ინჰიბირება შეიძლება კუნთში მელატონინის ახალი დოზის შეყვანით, ხოლო იმ ცხოველებში, რომლებთაც ეპიფიზი შენარჩუნებული აქვთ, მელატონინის დამატებითი დოზის შეყვანა სიმსივნის ზრდაზე გავლენას არ ახდენს [22].
დღეს, როცა ონკოლოგიური დაავადებებისაგან ყოველწლიურად იღუპება 6 მილიონი ადამიანი, განსაკუთრებულ მნიშვნელობას იძენს მედიკამენტოზური თერაპია, ანუ ქიმიოთერაპია [23,24].
ავთვისებიან სიმსივნეთა საწინააღმდეგო ეფექტური პრეპარატების შექმნის მიზნით დიდი ინტერესი გამოიწვია მელატონინისა და მისი სტრუქტურული ანალოგების მიღებამ და მათი ბიოლოგიური აქტიურობის შესწავლამ. პროფ. რ. ლაღიძისა და მისი თანამშრომლების მიერ ჩატარებულ იქნა მთელი რიგი ახალი სტრუქტურული ანალოგების სინთეზი. ნაჩვენები იქნა, რომ ეპიფიზის მეტაბოლიზმის პროდუქტის – მელატონინის ზოგიერთი ცხიმოვან-არომატული ანალოგები ავლენენ კობოსსაწინააღმდეგო აქტიურობას. სინთეზირებული ნაერთების ფიზიოლოგიური აქტიურობა შესწავლილ იქნა ქიმიური ნაერთების ბიოლოგიური კვლევის საკავშირო სამეცნიერო კვლევით ინსტიტუტში. დადგენილ იქნა, რომ 4-ფენილპენტანმჟავის 2-(5-მეთოქსიინდოლილ-3)-ეთილამიდი (I) ვირთხებზე დაკვირვების შედეგად ტვინისა და ღვიძლის მიტოხონდრიებში ჟანგვითი ფოსფორილირების პროცესებში ამჟღავნებს მაღალ აქტიურობას. ამასთან ნაჩვენებია, რომ ეს ნაერთი ასევე წარმოადგენს MAO-ს ზომიერ და ატფ-ის სუსტ ინჰიბიტორს.
სინთეზირებული ნაერთები აგრეთვე შესწავლილ იქნა საქართველოს ჯანმრთელობის სამინისტროს ონკოლოგიურ ცენტრში. ამ ნაერთების კიბოსსაწინააღმდეგო აქტიურობა შესწავლილ იქნა სიმსივნის 6 შტამზე, 3 მათგანი თაგვების (APЭ, S-37 და C-180) და 3 ვირთხებზე (C-45, M-1 და უოკერის კარცინოსარკომაზე). დადგენილ იქნა, რომ (I) ნაერთი ამღავნებს გამოხატულ კიბოსსაწინააღმდეგო აქტიურობას, ამუხრუჭებს სიმსივნის ზრდას АРЭ და М-1 შტამების მიმართ (10 მგ/კგ დოზით), 38 და 46.6%-ით, შესაბამისად. (I) ნაერთში არომატულ ბირთვში პარა-მდგომარეობაში მეთილის ჯგუფის შეყვანა – 4-ფენილ-პ-ტოლილპენტანმჟავის 2-(მეთოქსიინდოლილ-3)-ეთილამიდში (2), (I) ნაერთთან შედარებით კიბოსსაწინააღმდეგო აქტიურობა იზრდება 77.7 და 53.4%-მდე იმავე შტამების მიმართ, შესაბამისად.
ასევე შესწავლილ იქნა ნაერთი 4-პ-ქსილილპენტანმჟავის 2-(5-მეთოქსიინდოლილ-3)-ეთილბრომიდის ქიმიური აქტიურობა დოზით 1 და 3 მგ/კგ თაგვებზე და 25-35 მგ/კგ ვირთხებზე, შესაბამისად. დადგენილ იქნა, რომ იგი ამჟღავნებს კიბოსსაწინააღმდეგო აქტიურობას და იწვევს სიმსივნის ზრდის დამუხრუჭებას 44%-ით C-45 შტამზე, დოზით 35 მგ/კგ.
ნაერთი 4-N,N-დიეთილსულფონამიდო-პ-ქსილილპენტანმჟავის 2-(5-მეთოქსინდოლილ-3)-ეთილამიდი შესწავლილ იქნა თაგვებზე (20 მგ/კგ და ვირთხებზე 20 მგ/კგ, 30 მგ/კგ და 50 მგ/კგ დოზით ყველა ზემოდ აღნიშნულ ჯგუფებში ამჟღავნებს კიბოსსაწინააღმდეგო აქტიურობას, ამასთან სიმსივნის ზრდის დამუხრუჭების ყველაზე მაღალი პოტენციალი -53%, აღინიშნება M-1 შტამზე (50 მგ/კგ დოზით) [25-27].
ასევე ჩატარებულ იქნა მელატონინის დეზმეთოქსი ანალოგების სინთეზი 4-ფენილ-პენტანმჟავას, 4-პ-ტოლილპენტანმჟავას და 4-პ-ქსილილპენტანმჟავას ქლორ-ანჰიდრიდების ურთიერთქმედებით ამინებთან: ტრიპტამინთან, 7-მეთილტრიპტამინთან და ტრიპტოფანთან და მიღებულ იქნა მელატონინის ახალი ცხიმოვან-არომატული სტრუქტურული ანალოგები [28-30].
დიდი ყურადღება დაეთმო აგრეთვე ბის-ინდოლური ტიპის ნაერთების სინთეზს. ამ მიმართულებით კვლევისათვის მიზნად იქნა დასახული ინდოლის ორი ბირთვის შემცველი მელატონინის ანალოგების მიღება. ამ მიმართულებით ცნობილია გამოჩენილი მეცნიერის ნ.ნ. სუვოროვის და მისი თანამშრომლების მიერ ამ სფეროში მიღწეული შედეგები [31-33].
ზოგიერთი ორფუძიანი მჟავების (ქარვის, გლუტარის, ადიპინის, აზელაინის, სებაცინის, იზოფტალისა და ტერეფტალის) ქლორანჰიდრიდების ურთიერთქმედებით ტრიპტამინთან, 7-მეთილტრიპტამინთან და ტრიპტოფანთან მიღებული და დახასიათებულია საკმაოდ საინტერესო სტრუქტურის მქონე ბის-ინდოლური სტრუქტურის მქონე დიამიდები [34-37].
ბიოლოგიური გამოკვლევების შედეგად, რომელიც ჩატარებულ იქნა საქართველოსა და უცხოეთის მედიცო-ბიოლოგიური კვლევების სხვადასხვა ცენტრში, ნაჩვენებია, რომ ჩვენ მიერ სინთეზირებული მელატონინის ზოგიერთი ანალოგი ხასიათდება მაღალი კიბოსსაწინააღმდეგო აქტიურობით. რუსი ონკოლოგის ვ. ჩერნოვის მონაცემებით ზოგიერთი მათგანი ადვილად გადალახავს რა ჰემატოენცეფალურ ბარიერს, დიდი რაოდენობით გროვდება ექსპერიმენტული ცხოველის თავის ტვინის სიმსივნის უჯრედებში. მისივე აზრით, ეს ნაერთები მომავალში შესაძლებელია წარმატებით იქნას გამოყენებული თავის ტვინის სიმსივნეთა სამკურნალოდ [38, 39].
ალკალოიდ რეზერპინის ქიმიური აღნაგობის დადგენისა და ქიმიოთერაპიაში მისი როლის გარკვევის შემდეგ, მეცნიერები დაინტერესდნენ მედიცინაში მისი უფრო მარტივი სტრუქტურული ანალოგების გამოყენების საკითხით. ამ მიმართულებით ჩატარებული კვლევების შედეგმა უჩვენა, რომ β-კარბოლინი, რომელიც რეზერპინის უმნიშვნელოვანეს სტრუქტურულ რგოლს წარმოადგენს, ამჟღავნებს რეზერპინის მსგავს საინტერესო თვისებებს. კერძოდ, ჰიპოტენზიურ აქტიურობასთან ერთად მას ახასიათებს ანტიდეპრესანტული, სპაზმოლიტური, ტკივილგამაყუჩებელი და დამამშვიდებელი მოქმედება [40].
ცნობილია, რომ β-კარბოლინის ნაწარმები არალკილის ჯგუფებით ბირთვის პირველ მდგომარეობაში წარმოადგენენ ეპიფიზის მეტაბოლიზმის ერთ-ერთი პროდუქტის – ადრენოგლომრინოტროპინის ანალოგებს. ამ უკანასკნელის როლი ბიოქიმიურ პროცესებში ჯერ კიდევ სრულად არ არის გამოკვლეული და მეტად საინტერესოა მისი, როგორც კიბოსსაწინააღმდეგო პრეპარატის შესწავლა.
არსებობს β-კარბოლინის წარმოებულების მიღების სხვადასხვა მეთოდი [41,42], რომელთაგან ყველაზე გავრცელებულ მეთოდს წარმოადგენს შესაბამისი ინდოლილალკილამიდების ციკლის შეკვრა ბიშლერ-ნაპირალსკის რეაქციის პირობებში. 3,4-დიჰიდრო-β-კარბოლინის ციკლის შეკვრას ჩვეულებრივ აადვილებს ინდოლური ბირთვის მე-6 მდგომარეობაში ელექტროდონორული ჯგუფების შეყვანა. მაგალითად, მეთოქსი- ჯგუფისა [43,44].
ზემოაღნიშნულიდან გამომდინარე მიღებულ იქნა β-კარბოლინის ახალი ცხიმოვან-არომატული ანალოგები უფრო გრძელი გვერდითი ჯაჭვით და არომატულ ბირთვში სვადასხვა ჩამნაცვლებლებით. საწყის პროდუქტებად გამოყენებულ იქნა პროფ. რ. ლაღიძისა და მისი თანამშრომლების მიერ სინთეზირებული 4-არილპენტანმჟავები, რომელთა ქლორანჰიდრიდების ურთიერთქმედებით მეთოქსიტრიპტამინთან, ტრიპტამინთან და 7-მეთილტრიპტამინთან მიღებულ იქნა შესაბამისი მონო- და დიამიდები. მათი ციკლიზაციით ბიშლერ-ნაპირალსკის რეაქციის პირობებში მიღებულ იქნა შესაბამისი 3,4-დიჰიდრო- β-კარბოლინები, რომელთა აღდგენით (აბსოლიტური ეთილის სპირტისა და მეტალური ნატრიუმის მოქმედებით) მიღებულ იქნა შესაბამისი 1,2,3,4-ტეტრაჰიდრო - β-კარბოლინები [45,46].
ასევე მიღებულ იქნა 3,4-დიჰიდრო- β-კარბოლინები სხვადასხვა ფუნქციური (სულფონამიდური, ნიტრო- და ამინო-) ჯგუფებით არომატულ ბირთვში. ტრიპტამინისა და 7-მეთილტრიპტამინის დიამიდების შემთხვევაში ციკლიზაცია ერთდროულად მიმდინარეობს ორივე ამიდურ ჯგუფთან და მიიღება შესაბამისი ციკლური ნაერთები [47]
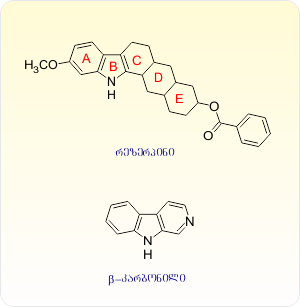
ქიმიური ნაერთების ბიოლოგიური კვლევის საკავშირო სამეცნიერო კვლევითი ინსტიტუტის მონაცემებით 6-მეთოქსი-1-(3-ფენილბუთილ)-, (2-პ-ტოლილბუტილ) და (2-პ-ეთილფენილბუტილ)-3,4-დიჰიდრო- β-კარბოლინები ხასიათდებიან სუსტი ჰიპოტენზიური აქტიურობით, ხოლო 6-ბენზილოქსი-1-(2-ფენილბუტილ)-3,4-დიჰიდრო-β-კარბოლინი ამჟღავნებს მაღალ ჰიპოტენზიურ აქტივობას.
შესრულებული სამუშაოების საფუძველზე პირველად ექსპერიმენტალურად იქნა ნაჩვენები, რომ ეპიფიზის ჰორმონალური ნაერთის – მელატონინის და β-კარბოლინის ცხიმოვან-არომატული ანალოგები, რომლებიც მიეკუთვნებიან ზემოთ განხილული ნაერთების სერიას, სიმსივნის ზოგიერთი შტამის მიმართ ამჟღავნებენ კიბოს საწინააღმდეგო მოქმედებას. შეიძლება ვივარაუდოთ, რომ ეს მონაცემები გახდება შემდგომი კვლევებისათვის სტიმული სინთეზირებულ იქნას მელატონინისა და β-კარბოლინის ახალი სტრუქტურული ანალოგები და შესწავლილ იქნას მათი ბიოლოგიური აქტიურობა.
ლიტერატურა
1. Браунштеин, А.Е. На стике химии и биологии. М.: Наука, 1987. с. 240.
2. Дорофеев В.И., Северцева О.В., Елизарьев В.Е. и др. Особенности иновационного процеса в фарматевтической промышленности. Актуальные проблемы создания новых лекарственных препаратов природного происхождения. 3-ый Международный съезд СПБ-Пушкиню 1999. с. 198-201.
3. Long J.P., Lands A.M. The influence of various spatial groups on Cholinolitic activity. J. Parm. Exp. Therap. 1957.V.120. p.46-51.
4. Анисимов В.Н. Физиологические функции эпифизаю Российский физиологический журнал им. И.М. Сеченева. 1977. т.83.№3. с. 1-13.
5. Малиновская Н.К. Роль мелатонина в организме человека. Клиническая медицина. 1998. №10. с.15-22.
6. Хелимский А.М. Вместилице душ. Ж. Химия и жизнь. 1980. №12. с. 51-54.
7. Чазов Е.И., Исаченков В.А. Эпифиз : »место и роль в системе нейроэндокринной регулации. М.: Наука. 1974.с. 3-55.
8. Davson d. et.al. intergrating the actions of melatonin on human physiology. Am. Med.1998.v.30.N1.p. 95-102.
9. Pevet P. Melatonin and biological rhythms. Therapic. 1998.v.53.N5. p.411-420.
10. Евтушенко Л.П. Мелатонин и его роль в экспериментальной и клинической неиро иммунологии. Журнал невропатологии и психиатрии. 1993. №3. с.93-99.
11. Maestroni G. J. The Immunoendocrine roll of melatonin. J. Pineal Res. 1993. v.14. p. 1-10.
12. Арушанян Э. Б., Бейер Э. И. Иммуноеропное свойства эпифизного мелатонина. Экспериментальная и клиническая фармакология. 2002. т.65. №5. с. 73-80.
13. Reiter R.J., Dun-xain, Mayo J.C. et.all. Melatonin as an antioxidant: biochemical mechanisms and pathophysiological implications in humans (review). Acta Biocemica Polonica. 2003. v. 50. N4. p,1129-1146.
14. Бачурин С.О. Медико-химические подходы к направленному пойску препаратов для лечения и предупреждения болезни Альцгеймера. Вопросы медицинской химии. т.47. №2. 2001. с. 35-37.
15. Арушанян Э.Б. Гормон эпифиза – мелатонина, новое ноотропное средство. Эксмеримен тальная и клиническая фармакология. 2005. т. 68. №3. с. 203-231.
16. Гаврилова С.И. Материалы 2-ой Россиской конференции. Болезнь Альцгеймера и старение . От неиробиологии к терапии. М.: 1999.с. 24-44.
17. Edward Millo, Ping Wu., Duglas Secly, Gordon Guyatt. Melatonin in the treatment of cancer, a systematic review of randomized controlled trials and meta analysis. J. Pineal Res. 2005. v.39. p. 360-366.
18. Анисимов В.Н.Эпифиз и опухолевый рост. Вопросы онкологии.1980. т.26. №8. с.97-105.
19. Хелиьский А.М.Эпифиз. М.: Медицина.1969. с. 100-106.
20. Анисимов В. Н., Хавинсон Р.Х., Морозов В.Г., Дильман В.Н. Сопоставление противоопухолевой активности эпифиза, гипотальмуса и сигетина у мышей с перевываемым раком молочной железы. Вопросы онкологии. 1973. т. 19. №10. с. 99-100.
21. Бузников Г.А. Клеточное деление под «диктовку» медиатора. Наука в СССР. 1987. №4. с. 22-29.
22. El-Domeiri A.A., Das-gupta T.K. Reversal by melatonin of the effect of pinealectomyon tumor growth. Cancer Res. 1973. V.31. N11. p. 2830-2833.
23. Гусцер Л.И. Эпидемиология опухолей : основные результаты исследований, приведенных в институте Экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины. Экспериментальная онкология. 2001. т. 23. №3. с. 223-235.
24. Маршак В.В. Онкологические заболевания. Профилактика и методы лечения. М.: изд. Новый издательский дом. 2004. с. 15.
25. Лагидзе Д.Р., Туркия Н.Г., Талаквадзе Л.Я., Асатиани В.В., Адамия И.К., Бенашвили Д.Ш. 2-(5-метоксииндолил-3)-этиламид 4-п-толилпентановой кислоты, обладающий
противоопухолевой активностью. А.С. СССР. №1021139. 1981.
26. Лагидзе Д.Р., Талаквадзе Л.Я., Лагидзе Р.М., Туркия Н.Г. 2-(5-метоксииндолил-3)-этиламид 4-(N,N-диэтилсульфонамида-п-ксилил)пентановой кислоты, обладающий противоопухолевой активностью. А.С. СССР № 788645. 1980.
27. Лагидзе Д.Р., Шарашидзе Л.К., Туркия Н.Г., Ревазишвили Т.Н., Талаквадзе Л.Я. Адамия И.К., Лагидзе Р.М. 2-(7-метоксииндолил-3)-этиламид 4-фенилпентановой к-ты, обладающий противоопухолевой активностью. А.С.СССР. №1314622. 1985.
28. Lagidze J,R., Talakvadze L.I., Revazishvili T.N., Lagidze R.M. Synthesis of 4-phenylbutylsulphonamido-, nitro- and aminoderivatives of triptamine. VI-th Symposium on chemistry of heterocyclic compounds. Brno. Czechoslovakia, july 4-7. 1978. p.5.
29. Лагидзе Д.Р., Талаквадзе Л.Я., Ревазишвили Т.Н., Умекашвили Л.Е., Лагидзе Р.М. Синтез амидов типа мелатонина на основе триптамина и 7-метилтриптамина. Сообщения АН ГССР, №2. 1985. с. 301-304.
30. Lagidze J.R., Talakvadze L.I., Revazishvili T.N., Lagidze R.M. The synthesis of the potential regulators of cell-divisions on the base of monobiogenic amines. 16-th International
Symposium on the Chemistry of Natural Products (IUPAC). Abstracts. Kioto Japan.1988.p.424.
31. Самсония Ш.А., Чикваидзе И.Ш., Суворов Н.Н. Некоторые реакции алкилирования бис-диметиламинопроизводных бис(5-индолилметана) Сообщ. АН ГССР. 1983, т.109. с. 73-76.
32. Самсония Ш.А., Чикваидзе И.Ш., Суворов Н.Н. Некоторые превращения бис(5- индолил) метана. АН ГССР.1982, т.108. №3. с. 563-566.
33. Самсония Ш.А. Исследоавния в области бифункциональных аналогов индола. V Всесоюзный колоквиум «Химия, биохимия и фармакология производных индола». Тбилиси. 1981. с. 31-32.
34. Lagidze J.R., Revazishvili T.N., Talakvadze L.I., Abesadze I.G., Lagidze R.M. Synthesis of dezmetoxy analogues of melatonin on the base of dicarbonic asids. Second International conference of chemistry and biotechnology of biologically active natural products. August, 15-19. 1983. Budupest. Hungary. p. 106-107.
35. Ревазишвили Т.Н., Талаквадзе Л.Я., Лагидзе Д.Р. Синтез амидов двухосновных кислот 7-метилтриптамина и продуктов их циклизации по Бишлера-Напиральскому. I Всесоюзная конференция «Химия, Биохимия и Фармакология призводных индола». Тбилиси. Тезисы докладов. 1986. с. 25.
36. ლ.თალაკვაძე, თ. რევაზიშვილი, ჯ. ლაღიძე. ზოგიერთი ბის-ინდოლური ნაერთის სინთეზი აზელაინის, სებაცინის მჟავების და 7-მეთილტრიპტამინის საფუძველზე. საქართველოს ქიმიური ჟურნალი. N4. 2008. გვ. 341-343.
37. ლ.თალაკვაძე, თ. რევაზიშვილი, ჯ. ლაღიძე. ინდოლის შემცველი ახალი დიამიდების და β-კარბოლინების სინთეზი 5-მეთოქსიტრიპტამინის საფუძველზე. საქართველოს ქიმიური ჟურნალი. 2010. V10. N1. გვ. 26-30.
38. Д.Р. Лагидзе, В.К. Махарадзе, Т.Н. Ревазишвили, В.А. Чернов, Ж.Ф. Преснова, Ю.Я. Ершов. Синтез и изучение противоопухолевой активности амидов карбоновых кислот триптамина и 7-метилтриптамина. Фармакокинетика противоопухолевых препаратов. Томск. Мат. Всесоюзного рабочего совещания по доклинической токсикологии. 1987. с. 28-31.
39. რევაზიშვილი თ., თალაკვაძე ლ., ლაღიძე ჯ. მელატონინის ზოგიერთი ახალი ცხიმოვან-არომატული ანალოგის ბიოლოგიური აქტივობა. საქართველოს ქიმიური ჟურნალი. 2006. ტ.6. N4. გვ. 440-446.
40. Woodword R.B., Bader F.E., Bickel H., Grey A.J., Kiersted R.W. The total synthesis of reserpine. J. Am. Chem. soc. 1956.v. 78. N9. p. 2023-2029.
41. Abramovich R.A., Spenser J.R. The carbolines. Advances in Heterocyclic Chemistry. Acad. Press.1964. v.3. p. 79-90.
42. Stuart K., Woo-Ming R. β-carboline alkaloids. Heterocycles. 1975. v. 3. N3. p.223-227.
43. Серей А.Р. О реакции Бишлера-Напиральского. Справочник по органическим реакциям. 1965. с. 33-36.
44. Пакет Л. Основы современной химии гетероциклических соединений. М.: Мир. 1971.с. 248-250.
45. Лагидзе Д.Р., Талаквадзе Л.Я., Лагидзе Р.М. Синтез новых жирноароматических аналогов норгармана. Сообщ. АН ГССР. 1975. т.80. №3. с. 597-600.
46. Лагидзе Д.Р., Талаквадзе Л.Я., Лагидзе Р.М. Способ получения 1-(3-арилбутил)-6-метокси или бензилокси)-1,2,3,4-тетрагидроноргармана. Авт. Свид. СССР. №495309. Опубл. в Б. Изобр. 1975.№6. с.57.
47. Лагидзе Д.Р., Талаквадзе Л.Я., Ревазишвили Т.Н., Лагидзе Р.М. Синтез β-карболинов на основе амидов адипиновой, изофталевой и 4-фенилпентановой кислот.Сщщбщ. АН ГССР. 1989. т.135. №2. с. 341-344.
გამოქვეყნებულია: 19-03-2013

