"ქიმიის უწყებანი" ტომი:6, ნომერი:1, 25-30 გვ.
აეროგელი-ყველაზე დაბალი სიმკვრივის მქონე მყარი ნივთიერება
რეზიუმე: სტატიაში განხილულია სინთეზური მასალა, აეროგელი, რომელიც უნიკალურია ექსტრემალურად დაბალი სიმკვრივისა და მაღალი თბოიზოლაციური თვისებების გამო. ზემოხსენებული თვისებები მისი ქიმიური შედგენილობით და სტრუქტურით აიხსნება, რადგან აეროგელი 1% ნანონაწილაკებისაგან და 99% ჰაერისაგან შემდგარი სუპერფოროვანი მასალაა. წარმოდგენილია მისი დამზადების ისტორია და ტექნოლოგია, ფიზიკური და ქიმიური თვისებები, გამოყენება ყოველდღიურ და სამეცნიერო სფეროებში.
საკვანძო სიტყვები: აეროგელი; ტეტრამეთოქსისილანი; სუპერკრიტიკული გაშრობა; თერმოიზოლატორი; ნანოღრუბელი.
ისტორიული რაკურსი. სამეცნიერო წყაროებში აეროგელი ასე განიმარტება: „გელისაგან ხელოვნურად სინთეზირებული სუპერფოროვანი მასალა, სადაც გელიდან თხევადი ნივთიერება გამოდევნილია და ჩანაცვლებულია აირით, ისე, რომ მისი სტრუქტურა არ იშლება“(ნახ.1). ეს განმარტება კი 1930 წელს ორი მეცნიერისთვის, სემუელ კისტლერისთვის და ჩარლზს ლერნდისთვის (ნახ. 2), სანაძლეოს პირობას წარმოადგენდა. მათ ასეთი მასალის შექმნით უნდოდათ თავისი, როგორც ქიმიური ინჟინრების შესაძლებლობებისთვის გაესვათ ხაზი და არც უფიქრიათ, თუ რაიმე აღმოჩენას უდებდნენ საფუძველს. საბოლოოდ, სანაძლეო სემუელ კისტლერმა მოიგო, თუმცა მის აღმოჩენას დიდი გამოხმაურება არ მოჰყოლია, რადგან ასეთ ნივთიერებას მაშინ არც პერსპექტივა და არც გამოყენება არ ჰქონდა.
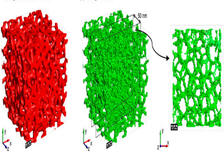
ნახ.1. აეროგელის სუპერფოროვანი სტრუქტურა
აქედან საკმაოდ დიდი ხნის შემდეგ, 1958 წელს, “NASA”(National Aeronautics and Space Administration-აერონავტიკისა და კოსმოსის ეროვნული ადმინისტრაცია) დაარსდა. მისი დაარსება კი, რა თქმა უნდა, კოსმოსურ მისიებს თავისთავად მოიაზრებდა. მარსმავლების კოსმოსური ხომალდების ინჟინრებისთვის გამოწვევა იყო, შეექმნათ ისეთი ტექნიკა, რომელიც გაუძლებდა კოსმოსის ტემპერატურულ ცვალებადობას. სწორედ „NASA”-ში გადახედეს კისტლერის კვლევებს თავიდან და აეროგელის დაბალი თბოგამტარობის გამო, განაახლეს მასზე კვლევები და მუშაობა და შემდგომში გამოიყენეს თავის ტექნიკაში
აეროგელის თვისებები და გამოყენება.

ნახ.2. სემუელ კისტლერის გამოსახულება (მარცხნივ) ,
ჩარლზ ლერნდის ფოტო არ მოიპოვება

ნახ.3. მოცემულ ფოტოს აეროგელების „მონა-ლიზას“ უწოდებენ, რადგან აეროგელის მთავარ თვისებას, თბოიზოლაციას, საუკეთესოდ აღწერს. ყვავილი, რომელიც მოთავსებულია აეროგელზე, მაღალი ტემპერატურის პირობებშიც კი არ განიცდის დეჰიდრატაციას და არ ჭკნება.

ნახ.4. კომეტის მტვერი აეროგელში

ნახ.5. აეროგელის ბლოკები

ნახ. 6. კომეტის მტვერის შესაგროვებელი მოწყობილობა თანამგზავრზე

ნახ.7. ჩერენკოვის გამოსხივება აეროგელში
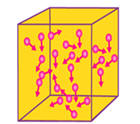
ნახ.8. ბრაუნის მოძრაობა. ნაწილაკები ეჯახებიან შემთხვევითად, კანონზომიერების გარეშე
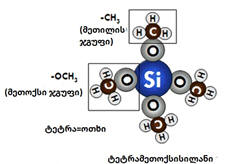
ნახ.9. ტეტრამეთოქსისილანი. სილიციუმის გარშემო ჟანგბადის ხიდებით დაკავშირებულია ოთხი მეთილის ჯგუფი. მოლეკულას ტეტრაედრული აღნაგობა აქვს.
პირველ რიგში, საყურადღებოა აეროგელის თბოიზოლაციის კარგი უნარი, რის გამოც დაინტერესდა “NASA” და განავითარა მისი დამზადების ტექნიკა. მარსზე ტემპერატურა მერყეობს -140°C-დან 20°C-მდე. ეს საკმაოდ სერიოზული ტემპერატურული გრადიენტია და შეუძლია ტექნიკის დაზიანება, რაც შეუძლებელს ხდის მარსზე გრძელვადიან ექსპედიციებს, თუმცა აეროგელისგან დამზადებული მარსის როვერი კარგად უმკლავდება ამ პრობლემას, არც მისი გადაცივება ხდება და არც გადახურება. შეიძლება ვიფიქროთ, რომ ჰაერივით კარგი თბოიზოლატორია, რადგან მისი 99% ჰაერისგან შედგება, თუმცა სინამდვილეში ბევრად უკეთესია, რასაც მისი სუპერფოროვანება განაპირობებს. მისი ფორები ძალიან პატარაა, ნანოზომისაა, ამიტომაც თბილ ან ცივ ჰაერს ძალიან უჭირს ფორებში დიფუზია და წინაღობების გადალახვა. ეს დაახლოებით იგივეა, ადამიანი დანიშნულების ადგილამდე პირდაპირი გზით მიდიოდეს ან ლაბირინთის გავლით. ლაბირინთში გავლას გაცილებით დიდ დროს მოანდომებს. სწორედ ლაბირინთს წარმოადგენს ეს ფორები. აეროგელი გამოიყენება კრიოგენიაშიც - გათხევადებული აირის დაბალ ტემპერატურაზე შესანახად (ნახ. 3).
აეროგელის ფიჭური, ფოროვანი სტრუქტურა თბოიზოლაციის გარდა, კიდევ სხვა მხრივაც შეიძლება იქნას გამოყენებული, რადგან ის არა მარტო თერმულ ენერგიას, მასში შეღწეული ნაწილაკების სიჩქარესაც ამცირებს. როდესაც “NASA”-ს ერთ-ერთმა პროფესორმა გადაწყვიტა კომეტის მტვრის შეგროვება მზის სისტემის წარმოშობის შესასწავლად, სწორედ აეროგელი მიიჩნია სწორ ხელსაწყოდ. კომეტები გამოტყორცნიან ნანონაწილაკებს, რაც განაპირობებს მათი ლუმინესცირებული კუდის არსებობას. გამოტყორცნილი ნაწილაკების სიჩქარე 6100 მ/წმ-ია. ასეთი სიჩქარით მოძრავი ნაწილაკები ეჯახებიან აეროგელის ბლოკებს, შეაღწევენ მასში, სიჩქარე შემცირდება და ჩაშენდება ბლოკებში (ნახ.4-6).
სუპერფოროვანი სტრუქტურა ასევე ხელსაყრელი აღმოჩნდა ჩერენკოვის მაღალი ენერგიის გამოსხივების მქონე ნაწილაკების დასათვლელად. სიჩქარე, რომლითაც სინათლე მოძრაობს მატერიაში, დამოკიდებულია მატერიის გვარობაზე და ზოგიერთ შემთხვევაში იმდენად დაბალია, რომ ელექტრონები მასზე სწრაფად მოძრაობენ. როდესაც ეს ხდება, კონუსის ფორმის ელექტრომაგნიტური ტალღები გამოსხივდება ელექტრონის ტრაექტორიის გასწვრივ, ამ დროს წარმოიქმნება ნათება (ამას ეწოდება ჩერენკოვის გამოსხივება) და ასე ხდება მაღალ ენერგიული ნაწილაკების აღმოჩენა ნაწილაკების რეაქტორში. აეროგელის შემთხვევაში მისი სუპერფოროვანი ქსელი საშუალებას იძლევა შეანელოს სინათლის სიჩქარე და, რადგანაც აეროგელი გამჭირვალეა, კარგად ჩანს ჩერენკოვის ნათება. ამ მეთოდს იყენებენ CERN-ის ლაბორატორიაში, ადრონულ კოლაიდერში (ნაწილაკების ამაჩქარებელი რეაქტორი) მაღალ ენერგიული დამუხტული ნაწილაკების გამოსავლენად. (ნახ.7).
აეროგელს ახასიათებს ჰიდროფობურობა, რის გამოც აპირებენ მის გამოყენებას წყალქვეშა ნავთობის მილსადენების დასაფარად. ამისათვის აეროგელის ძალიან თხელი შრეც კი საკმარისი იქნება. ზოგჯერ მილებიდან შეიძლება ნავთობმა გაჟონოს, რაც ოკეანის ცოცხალი სამყაროსთვის დამღუპველია, აეროგელი კი ჰიდროფობურობის გამო შეიწოვს ამ ნავთობს და არ ჩაიღვრება ოკეანეში. ასევე აეროგელი, რადგან თბოიზოლატორია, მუდმივ ტემპერატურას უნარჩუნებს მილებს და, შესაბამისად, ნავთობის ნაკადსაც მუდმივი დინება ექნება.[6,7]
ნახ.3. მოცემულ ფოტოს აეროგელების „მონა-ლიზას“ უწოდებენ, რადგან აეროგელის მთავარ თვისებას, თბოიზოლაციას, საუკეთესოდ აღწერს. ყვავილი, რომელიც მოთავსებულია აეროგელზე, მაღალი ტემპერატურის პირობებშიც კი არ განიცდის დეჰიდრატაციას და არ ჭკნება.
აეროგელის დამზადება.
აეროგელის განმარტება: „გელი რომლის ფორებიდანაც გამოდევნილია წყალი და ჩანაცვლებულია ჰაერით“, თვითონ არის მისი დამზადების მოკლე ინსტრუქცია. ლოგიკურია, იმისათვის, რომ გელი აეროგელად გარდავქმნათ, ჯერ შესაბამისი გელი უნდა დავამზადოთ, გელის დასამზადებლად კი კოლოიდური ხსნარია საჭირო.
გელი შედგება მყარი ნანონაწილაკების ქსელისაგან და ამ ქსელს შორის სივრცეში სითხეა. სწორედ, ამ ქსელის მისაღებად საჭიროა კოლოიდური ხსნარი, სადაც დისპერსული გარემოც და დისპერსული ფაზაც თხევად მდგომარეობაშია. დისპერსული ფაზის სახით შეგვყავს ხსნარში ის ნანონაწილაკები, რომლებმაც შემდეგ ქსელი, მყარი ჩარჩო უნდა შექმნას. კოლოიდური ხსნარი გელად გარდაქმნას დაიწყებს, როდესაც ნანონაწილაკები შეჯგუფდებიან, ამ დროს ისინი შემთხვევითად გადაადგილდებიან (ბრაუნის მოძრაობით), ერთმანეთს ეჯახებიან და ეწებებიან. ზოგიერთი ნანონაწილაკისთვის ეს ძალიან მარტივია, რადგან ისეთი ფუნქციური ჯგუფი აქვს, რომ მარტივად კონდენსირდება. ზოგიერთს კი დამატებითი ნივთიერება სჭირდება. როდესაც პოლიმერიზაცია დასრულდება, ნანონაწილაკები უმოძრაო ხდება. ამ პროცესს გელწარმოქმნა ეწოდება.
გელწარმოქმნის დროს მნიშვნელოვანია ტემპერატურის გათვალისწინება. რეაქციები, რომლებიც პოლიმერიზაციის დროს მიმდინარეობს, დამოკიდებულია ტემპერატურაზე, ტემპერატურის გაზრდით პოლიმერიზაცია შეგვიძლია დავაჩქაროთ. დაბალი ტემპერატურის შემთხვევაში კი გელწარმოქმნას შეიძლება თვეები დასჭირდეს, მაგრამ თუ ძალიან მაღალია ტემპერატურა, გროვები ფორმირდება და ნანონაწილაკები გამოილექება. ამიტომ ტემპერატურა სწორად უნდა შეირჩეს. ჯობს ნელა წარიმართოს და კარგი ხარისხის აეროგელი წარმოიქმნას, ვიდრე სტრუქტურა დაიშალოს მაღალი ტემპერატურის გამო.
ზემოთ მოცემული ინფორმაცია აეროგელის დამზადების შესახებ ძალიან ზოგადია და მხოლოდ წარმოდგენას ქმნის. უკეთ გასარკვევად უმჯობესია კონკრეტული შედგენილობის აეროგელის დამზადების პროცესის გაცნობა. ამ მიზნით, განვიხილოთ ყველაზე დახვეწილი და კარგად გამოკვლეული SiO2-ის აეროგელის დამზადების ტექნიკა.
სილიციუმის ოქსიდის აეროგელის სინთეზის პირველ საფეხურზე, კოლოიდურ ხსნარს ამზადებენ. სადაც წყლიან და გამხსნელიან გარემოში (მეთანოლი, ეთანოლი, აცეტონი) დისპერსიული ფაზის სახით ალკოქსიდი, კერძოდ, ტეტრამეთოქსისილანი შეჰყავთ (ნახ.9). ამ მოლეკულაში სილიციუმთან ოთხი ჟანგბადის ხიდით მეთილის ჯგუფებია დაკავშირებული. რადგან ალკოქსიდი არაპოლარული მოლეკულაა, წყალს არ შეუძლია მისი გახსნა, ამას ორგანული გამხსნელი აკეთებს. წყალი კი ნანონაწილაკებს
მთლიან მოცულობაზე ანაწილებს. მას შემდეგ, რაც კოლოიდური ხსნარი წარმოიქმნება, ის უნდა გარდაიქმნას გელად, პოლიმერიზაციის რეაქციების საშუალებით. გელწარმოქმნის პროცესში სამი ძირითადი რეაქცია მიმდინარეობს:
- პოლიმერიზაციის რეაქციების წინამორბედი ჰიდროლიზის რეაქციაა, მეთოქსისილანის ჰიდროლიზის დროს მეთოქსისილანი წყლის მოლეკულიდან წყალბადის კატიონს მიიერთებს და მეთილის ჯგუფის ადგილს დაიკავებს, წარმოქმნილ Si-O-H ჯგუფს სილანოლის ჯგუფს უწოდებენ. მისი წარმოქმნა პოლიმერიზაციის რეაქციებისთვის არის აუცილებელი, რადგან OH-ჯგუფები მარტივად კონდენსირდებიან ერთმანეთთან. წყლის მოლეკულიდან გამოთავისუფლებული OH-ჯგუფი კი მეთილის ჯგუფს შეუერთდება და მეთანოლი გამოიყოფა ამ რეაქციის დროს.
- სილანოლის ჯგუფები კონდენსირდებიან ერთმანეთთან და წარმოიქმნება Si-O-Si სილოქსანის ხიდი, ამ კონდენსაციის დროს გამოიყოფა წყალი.
- ასევე პოლიმერიზაციის რეაქცია შეიძლება წარიმართოს სილანოლის ჯგუფსა და მეთოქსი ჯგუფს შორის, სადაც მეთილის და ჰიდრროქსიდის ჯგუფის ურთიერთქმედებით მეთანოლი გამოიყოფა და ორ კონდესირებულ მოლეკულას შორის სილოქსანის ხიდი წარმოიქმნება (ნახ.10).
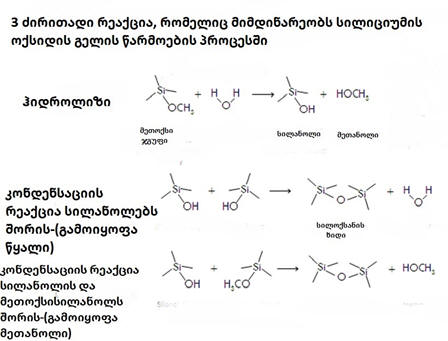
ნახ.10. სილიციუმის დიოქსიდის გელის მიღების რეაქციები ალკოქსიდის ტექნიკით
სილიციუმის თითოეული ატომი ოთხ სილოქსანის ხიდს ქმნის და ამის შედეგად ხდება პოლიმერიზაცია. მიღებული ნანონაწილაკების ემპირიული ფორმულა SiO2-ია.თუმცა უფრო ზუტი ჩანაწერი იქნება (SiO4)n. საყურადღებოა, რომ ხიდების ფორმირებაში ყველა მოლეკულა არ იღებს მონაწლეობას და ინარჩუნებს -OH- და CH3 ჯგუფებს, რომლებთაც ტერმინალური ეწოდებათ.
მას შემდეგ, რაც ნანონაწილაკების ქსელი წარმოიქმნება, მისი ფორები ამოვსებულია წყლით და გამხსნელით, თუმცა ამის გარდა სხვა ნარჩენებიცაა (მათ შორის კატალიზატორების). გელის ნარჩენებისგან გასასუფთავებლად მიმართავენ მარტივ ტექნიკას, გაჟღენთვას. ამისათვის იყენებენ ორგანულ გამხსნელს (მეთანოლი, ეთანოლი, აცეტონი). გელს ათავსებენ გამხსნელში რამდენიმე დღე, მინარევები დიფუზირდება გარეთ და გამხსნელი კი ფორებში შედის, ვიდრე წონასწორობა არ დამყარდება გარეთ გამოსული ნარჩენებისა და შიგნით შესული გამხსნელის კონცენტრაციებს შორის.[1,2,3]
გელიდან აეროგელის მიღება:
საბოლოო ეტაპი გელიდან სითხის გამოდევნა და მისი ჰაერით ჩააცვლებაა. ეს ყველაზე რთული ეტაპია და სპეციფიკურ ტექნიკას მოითხოვს. ჩვეულებრივ, თუ გელს სითხეს აორთქლებით მოვაშორებთ, მაშინ მისი სტრუქტურა დაიშლება ზედაპირის დაჭიმულობის და კაპილარული სტრესის გამო. ეს მოვლენა ატომების მოძრაობით სითხეში ატომებს უფრო დიდი კინეტიკური ენერგია აქვთ, ვიდრე მყარ მდგომარეობაში, ამიტომაც ნაწილაკები უფრო სწრაფად მოძრაობენ და ასევე საკმარისად ახლოს არიან ერთმანეთთან, რომ მათ შორის მიზიდულობის ძალები ურთიერთქმედებდეს, რის შედეგადაც ატომები გადაებმება ერთმანეთს და სწორედ ამ მომენტს ეწოდება ზედაპირული დაჭიმულობა (ნახ.11.). წარმოვიდგინოთ, რომ ფოროვანი ქსელის მოლეკულები არიან მაგნიტები, ფორები კი მეტალის თხელი ფირფიტები. თუ ერთ-ერთ მაგნიტს გამოვქაჩავთ მას წამოყვება ყველა დანარჩენი, სანამ ამ მაგნიტს არ ამოვაძრობთ ქსელიდან. შემდეგ მაგნიტების გროვა უკან დაბრუნდება, რომ ცარიელი სივრცე ამოავსოს და მეტალის ფირფიტებს კიდევ უფრო მიუახლოვდებიან და ასე დაპატარავდება თანდათან მაგნიტებისა და მეტალის ფირფიტების სტრუქტურა. სტრუქტურის ამგვარ დეფორმაციას ეწოდება კაპილარული სტრესი, რომელსაც ზედაპირული დაჭიმულობა განაპირობებს. (მაგნიტების მაგალითი ზედაპირულ დაჭიმულობას წარმოადგენს, მიზიდულობის გამო) და რომ არა ის, მაშინ გელის სტრუქტურაც აღარ დაიშლებოდა, რადგან წყლის აორთქლება აღარ გამოიწვევდა გელის დაპატარავებას და ჩამოშლას.
ცხადია, გელიდან სითხის გამოდევნა კაპილარული სტრესის და ზედაპირული დაჭიმულობის არ არსებობის პირობებში უნდა მოხდეს. სწორედ ეს წარმოადგენს აეროგელის მიღების სირთულეს, რომელიც სუპერკტიტიკული გაშრობის დახმარებით დაძლიეს. ეს გულისხმობს გელიდან სითხის გამოდევნას კონკრეტულ ტემპერატურასა და წნევაზე (კრიტიკული წერტილი), როდესაც ფორებში მოთავსებული სუბსტრატის სითხისა და აირის ფაზები განურჩეველია (ნახ.12). როგორ შეიძლება რაიმე სუბსტრატი სითხეც იყოს და აირიც ერთდროულად? წარმოვიდგინოთ, სითხე დალუქულ სივრცეში, რომელიც არ აფეთქდება, თუ წნევას და ტემპერატურას გავზრდით. ტემპერატურის გაზრდასთან ერთად უფრო მეტი მოლეკულა გადავა ორთქლის ფაზაში. ორთქლის ფაზაში გადასვლა იგივეა, რაც აირის ფაზაში, აირის ფაზა კი გულისხმობს, რომ მოლეკულებმა უფრო დიდი კინეტიკური ენერგია შეიძინეს და უფრო სწრაფად მოძრაობენ, ვიდრე სითხეში. რადგან დახურული კონტეინერი გვაქვს და, შესაბამისად, შეზღუდული მოცულობა, აირის მოლეკულები ვერ გაფართოვდება ისე როგორც, ნახ.11.3-ზეა ნაჩვენები და ზუსტად ისეთი დისტანციით არიან მოლეკულები ერთმანეთთან განლაგებული, როგორც სითხეში (ნახ.11.2). თუმცა მაღალი კინეტიკური ენერგიის მქონე მოლეკულები იმდენად სწრაფად ჩაუვლიან გვერდს ერთმანეთს,რომ მიზიდულობის ძალები მოლეკულებს შორის ვეღარ ასწრებს ამ მოლეკულების ერთმანეთზე გადაბმას დ,ა, შესაბამისად ზედაპირული დაჭიმულობაც აღარ გვაქვს. ეს გულისხმობს, რომ მივიღეთ სუბსტრატი, რომელსაც აქვს როგორც აირის, ისე სითხის თვისებები, ორი ფაზა უკვე განურჩეველია. მიღებულ სუბსტრატს სუპერკრიტიკულ სითხეს უწოდებენ. ის საკმაოდ უცნაური სუბსტანციაა, რადგან გაჯერებულია როგორც სითხე და სითბოსაც სითხის მსგავსად ატარებს, (შეხებისას შეიგრძნობა ისევე, როგორც სითხე), მაგრამ ამავდროულად ფართოვდება და იკუმშება, როგორც აირი. სუპერკრიტიკულ ნივთიერებას შეუძლია გახსნას ისეთი ნივთიერებები, რასაც ის თხევად მდგომარეობაში ვერ ხსნიდა. (ნახ.13) [4]
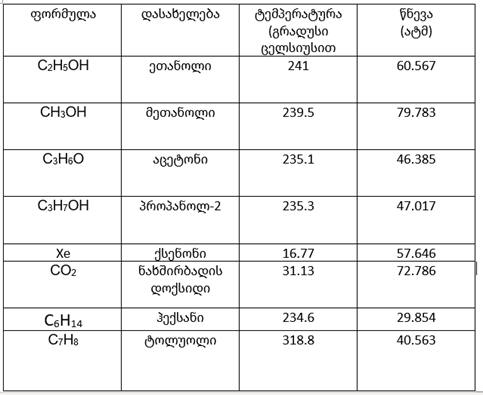
შენიშვნა: გელის მოთავსება სუპერკრიტიკული გაშრობის დროს იმავე ხსნარშიც არის შესაძლებელი, რომელიც მის ფორებში იყო თავდაპირველად, თუმცა ძირითადად გელს ჯერ ნახშირბადის დიოქსიდით გაჟღენთავენ, საწყის გამხსნელს გამოაძევებენ ფორებიდან და ამის შემდეგ ისევ ნახშირბადის დოქსიდის ხსნარში მოათავსებენ სუპერკრიტიკული გაშრობის დროსაც. მიზეზი მარტივია. CO2 სუპერკრიტიკულ წერტილს თითქმის ოთახის ტემპერატურაზე აღწევს, დაბალი ტემპერატურა და წნევა კი უფრო უსაფრთხოა და შესაბამისად მოსახერხებელი.(ცხრილი.1.)
ცხრილი.1. ცხრილში მოცემულია რომელი ნივთიერება რა ტემპერატურასა და წნევაზე აღწევს კრიტიკულ წერტილს.
SiO2-ის აეროგელის სტრუქტურა: მას შემდეგ რაც სუპერკრიტიკული გაშრობა დამთავრდება, მიიღება აეროგელის ქსელი - მყარი ჩარჩო, რომელიც შედგება SiO2-ის ოქსიდის ნანონაწილაკებისაგან, ისევე როგორც მინა, კვარცი და ქვიშა. ეს ნანონაწილაკები აგლომერირდენიან სფერულ ნაწილაკებად, რომლებიც შემდეგ ძაფებივით გადაებმებიან ერთმანეთს. ეს სტრუქტურა ელექტრო მასკანირებელ მიკროსკოპში კარგად ჩანს (ნახ.15). თავდაპირველი აეროგელი წებოვანია, რადგან მისი ტერმინალური ჯგუფები (Si-OH) პოლარულია და სუსტ წყალბადურ ბმებს ამყარებენ, რაც აეროგელს ჰიდროფილურს ხდის და როდესაც მის ზედაპირზე წყალი ხვდება, სტრუქტურაც იშლება. აეროგელის ჰიდროფილურობა საკმაოდ არახელსაყრელი თვისებაა, თუმცა შესაძლებელია მისი OH ჯგუფში წყალბადის ჩანაცვლება ნაკლებად პოლარული რადიკალით, რის შემდეგაც უკვე წყალგამძლე ხდება.
მეტალის აეროგელი: აეროგელი მხოლოდ SiO2-ისგან არ მზადდება, ის ბევრად უფრო ფართო ცნებას წარმოადგენს. შეიძლება იყოს ნახშირის, მეტალის ოქსიდის ან ქალკოგენებისგან დამზადებული. მეტალის აეროგელი უახლოეს ხანებამდე არ არსებობდა, რადგან არ იყო და არც ახლა არის მეტალის ნანონაწილაკებისგან შემდგარი გელის სინთეზის ტექნოლოგია. მაგრამ რადგანაც აეროგელი ორ კრიტერიუმს უნდა აკმაყოფილებდეს: 1) 50%-ზე მეტი მისი შედგენილობის ჰაერი უნდა წარმოადგენდეს; 2) სუპერფოროვანი უნდა იყოს, მეტალის აეროგელი მაინც მიიღეს, მაგრამ არა კოლოიდური ხსნარის და გელის დახმარებით.
 ნახ.13. სუპერკრიტიკული სითხე |
 ნახ.14. აეროგელი ელექტრო მასკანირებელ მიკროსკოპში |
რატომ არის მნიშვნელოვანი მეტალის აეროგელი?! პირველი, რაც მათ უნიკალურს ხდის, მათი ზედაპირის ფართობია. მეტალის აეროგელი კარგი ელექტროგამტარია. ასევე რბილი მეტალების აეროგელმა აჩვენა უფრო დიდი კატალიზური აქტივობა (ზედაპირის ფართობის გამო), ვიდრე თვითონ რბილმა მეტალებმა. მაგალითად, ოქრო საერთოდ არ არის კატალიზატორი , თუმცა მისი აეროგელი ეფექტურად აკატალიზებს ზოგიერთ ჟანგვით რეაქციას, მაგალითად, ოთახის ტემპერატურაზეც კი ჟანგავს CO-ს CO2-მდე. ასევე კიდევ უფრო კარგი ისაა, რომ რკინისა და ნიკელის აეროგელებმა შეიძლება ჩაანაცვლოს პალადიუმი, რუბიდიუმი და პლატინა, როგორც კატალიზატორები, რომლებიც ძვირია და შეზღუდული რაოდენობითაა.
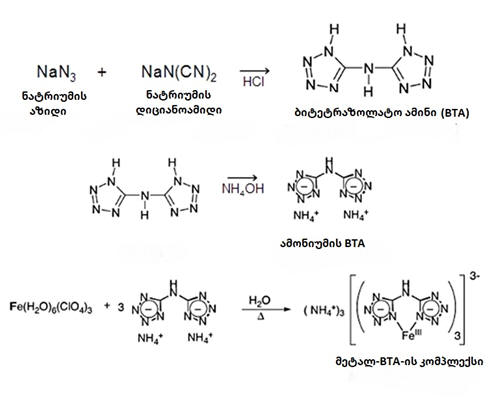
ნახ.15. მეტალ-BTA-ის კომპლექსური ნაერთის მიღება
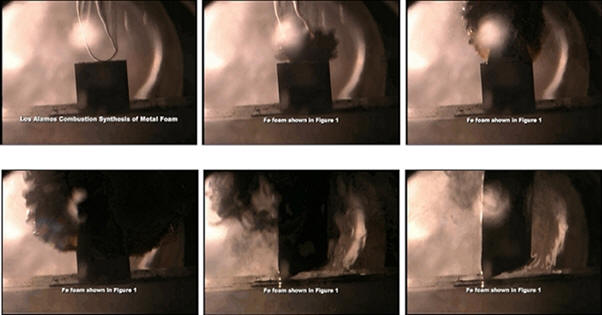
ნახ.16 დახურულ ჭურჭელში მაღალი წნევის პირობებში მეტალ-BTA-ს საფანტს ეხებიან გახურებული მავთულით. აალების შემდეგ კი ჩანს როგორ იზრდება მოცულობაში საფანტი.
მეტალის აეროგელის კიდევ ერთი მომხიბვლელი თვისება წყალბადის აკუმულაციის უნარია. ამას პალადიუმის და მაგნიუმის აეროგელები უზრუნველყოფენ თავისი ფოროვანი სტრუქტურით. თანამედროვე წყალბადის შემნახველების მთავარი პრობლემაა ისაა, რომ ძალიან სწრაფად ითვისებენ წყალბადს და წარმოქმნიან ჰიდრიდებს, თუმცა წყალბადის უკან გამოთავისუფლება რთულია და დიდ დროს მოითხოვს (ამიტომაც ეს ტექნოლოგია ვერ გამოიყენება მანქანებში). აეროგელის სტრუქტურა პოტენციურად შესაძლებელს ხდის წყალბადის სწრაფ გამოთავისუფლებას.
მეტალის აეროგელის დამზადება: პროფესორმა ბრაის ტეფენმა განავითარა მეტალის ფოროვანი აეროგელის დამზადების ტექნოლოგია. მისი დამზადების ისტორია ასეთია: პროფესორი ტეფენი მუშაობდა გარდამავალი მეტალების კომპლექსურ ნაერთებზე, სადაც მეტალი დაკავშირებულია ბიტეტრააზოლამინთან (BTA). თავიდან ეს ნაერთები განკუთვნილი იყო ფერადი

ნახ.17. მარჯვნივ მეტალ-BTA-ის კომპლექსური ნაერთის საფანტია, მარცხნივ კი მისი აალების შემდეგ დარჩენილი ნანოღრუბელი
ნახ.18 მეტალის აეროგელის სტრუქტურა ელექტრულ მასკანირებელ მიკროსკოპში
პიროტექნიკისთვის (გარდამავალ მეტალებს აქვთ ფერადი ალი). ტეპენს აინტერესებდა, როგორ დაიწვებოდა ეს ნაერთი დახურულ ჭურჭელში მაღალი წნევის პირობებში. ამისათვის გამოიყენა დაპრესილი საფანტის სახით მეტალ-BTA-ს კომპლექსი (ნახ.16.). დახურული ჭურჭელი სავსე იყო ინერტული აირით (ამ შემთხვევაში არგონით). საფანტს პროფესორი გახურებული მავთულით შეეხო და დაახლოებით ერთ წამში ნაცვლად იმისა რომ აორთქლდენულიყო, საფანტი აალდა და მოცულობაში გაიზარდა. წვის შემდეგ დარჩა ღრუბლისებური მასა (ნახ.17). ამ მასის ანალიზით დადგინდა, რომ ის 50% მეტალი იყო და 50% პროცენტი ნარჩენები, რომელსაც კომპლექსური ნაერთი შეიცავდა. მიღებული მასა იყო ძალიან ფოროვანი, ისეთი, როგორც აეროგელისთვისაა დამახასიათებელი.მეტალის ფოროვან მასას ნანოღრუბელი უწოდეს. ნანოღრუბლის თვისებები იმაზეა დამოკიდებული, თუ რომელი მეტალისგან შედგება. მაგალითად, სპილენძის ნანოღრუბელი არის მყარი, მტკიცე, დრეკადი და მარტივად დასამუშავებელი. რკინის კი ნაცარს უფრო ჰგავს და როგორც ქაღალდი ისე იწვის და სპეციალური დამუშავება უნდა გასამაგრებლად. [5]
დასკვნა: დასასრულს, აეროგელის წარმოება და გამოყენება დღეს ერთ-ერთი ყველაზე განვითარებადი სფეროა ქიმიაში. SiO2-ის აეროგელმა სრული ევოლუცია განიცადა 1930
წლიდან დღემდე. მისი დამზადების ტექნოლოგია დაიხვეწა და არაერთი გამოყენებაც ჰპოვა. თუმცა ჯერ კიდევ განვითარების პროცესშია სხვა შემადგენლობის აეროგელებიც: მეტალის, მეტალის ოქსიდის, ქალკოგენების, ნახშირის და ა. შ. ეს მატერია ნამდვილად იმსახურებს, არაერთ კვლევას და განვითარებას. მთავარი გამოწვევა მისი დამზადების პროცესში ისაა, რომ მივიღოთ სუპერფოროვანი სტრუქტურა, რომლის ფორებში 50%-ზე მეტი ჰაერი იქნება. SiO2-ის შემთხვევაში ეს გელის დამზადებით და სუპერკრიტიკული გაშრობით მოხერხდა, თუმცა სხვა ელემენტების შემთხვევაში ასე არ ხდება და ჯერ კიდევ ბევრი კვლევაა და ექსპერიმენტია აუცილებელი მათგან აეროგელის სტრუქტურის მისაღებად.
ბიბლიოგრაფია:
- Kistler, S. S. „Coherent expanded aerogels and jellies“. Nature (London, United Kingdom), 127, 741, 1931.
- Kistler, S. S. „Coherent expanded aerogels“. Journal of Physical Chemistry, 36, 52-64, 1932.
- Tillotson, T. M.; Hrubesh, L. W. „Transparent ultralow-density silica aerogels prepared by a two-step sol-gel process“. Journal of Non-Crystalline Solids, 145(1-3), 44-50,1992.
- Smith, Douglas M.; Deshpande, Ravindra; Brinker, C. Jeffrey. „Preparation of low-density aerogels at ambient pressure for thermal insulation“. Ceramic Transactions, 31, 71-80, 1993.
- B.C. Tappan, M.H. Huynh, M.A. Hiskey, D.E. Chavez, E.P. Luther, J.T. Mang, S.F. Son. „Ultralow-Density Nanostructured Metal Foams: Combustion Synthesis, Morphology, and Composition“. American Chemical Society, 128(20), 6589-6594,2006.
- https://curator.jsc.nasa.gov/stardust/aerogel.cfm. უკანასკნელად გადამოწმებულია-31.05.2022
- https://www.youtube.com/watch?v=qnOoDE9rj6w
გამოქვეყნებულია: 13-03-2023

