ცერიუმი
ცერიუმი წარმოადგენს ქიმიურ ელემენტს, რომლის სიმბოლოა Ce და ატომური ნომერი 58. იგი რბილი, მოვერცხლისფრო, დრეკადი მეტალია, რომელიც ადვილად იჟანგება ჰაერზე. მას სახელი მიეცა ჯუჯა პლანეტის ”Ceres” მიხედვით (თვითონ პლანეტას ჰქვია რომაული ნაყოფიერების ქალღმერთის სახელი). ცერიუმი ყველაზე გავრცელებული იშვიათ მიწათა მეტალია, რომელიც დედამიწის ქერქში 0.0046%-ია წონის მიხედვით. იგი გვხვდება ბევრ მინერალში, რომელთაგან ყველაზე მნიშვნელოვანია მონაციტი და ბასთნეზიტი. მრავალმხრივია ცერიუმის კომერციული გამოყენება. ის გამოიყენება როგორც კატალიზატორი და ასევე მინისა და ემალის დანამატი, მათი შეფერილობის შესაცვლელად და სხვა. ცერიუმის ოქსიდი მინის გასაპრიალებელი ფხვნილების მნიშვნელოვანი კომპონენტია და გამოიყენება ფლუორესცენციული ნაერთებში.
ისტორია
ცერიუმი აღმოჩენილ იქნა ბასთნეზიტში შვედეთში ჯ. ბერცელიუსის (Jöns Jakob Berzelius) და უ. ჰისინგერის (Wilhelm Hisinger) მიერ. მათგან დამოუკიდებლად მ. კლაფროტმა (Martin Heinrich Klaproth) 1803 წელს აღმოაჩინა გერმანიაში.
ბერცელიუსმა ცერიუმს უწოდა სახელი პლანეტა ცერეს მიხედვით, რომელიც აღმოჩენილი იქნა ორი წლით ადრე (1801 წელს). ცერიუმი გამოყოფილი იქნა მისი ოქსიდის სახით და ეწოდა ceria.
იშვიათ მიწათა ელემენტების აღმოჩენის პირველ ეტაპზე ითვლებოდა, რომ ძლიერი ფუძე თვისებისა და კალციუმის და მაგნიუმის მსგავსად ორვალენტიანები იყვნენ. მაგრამ ცერიუმი სამვალენტიანად მიიჩნეოდა ჟანგვითი რიცხვების შეფარდებით 1.5.
გავრცელება

ალანიტი
ცერიუმი, იშვიათ მიწათა ელემენტებში ყველაზე გავრცელებულია და იგი დედამიწის ქერქის 0.0046% შეადგენს წონის მოხედვით. იგი გვხვდება მინერალებში: ალანიტი (ცნობილია აგრეთვე როგორც ორტიტი) - Ca, Ce, La, Y)2(Al, Fe)3(SiO4)3(OH), მონაციტი (Ce, La, Th, Nd, Y)PO4, ბასთნეზიტი (Ce, La, Y)CO3F, ჰიდროქსი ბასთნეზიტი (Ce, La, Nd)CO3(OH, F), რადოფანი (Ce, La, Nd)PO4-H2O, ცირკონი (ZrSiO4) და სინქიზიტი Ca(Ce, La, Nd, Y)(CO3)2F. დღეისათვის მონაციტი, ალანიტი და ბასთნეზიტი წარმოადგენს ცერიუმის, თორიუმის და სხვა იშვიათ მიწათა მეტალების მისაღებად მომარაგების წყაროს, რაც დიდი ხნის წინ იყო ცნობილი.
იზოტოპები
ცერიუმი ბუნებაში გავრცელებულია ოთხი სტაბილური იზოტოპის სახით: 136Ce, 138Ce, 140Ce და 142Ce. ამათგან ყველაზე გავრცელებულია142Ce და 140Ce (88.48% ბუნებრივი გავრცელება).
ასევე დახასიათებულია 26 რადიოიზოტოპი, რომელთაგან 144Ce (ნახევარდაშლის პერიოდი 284.893 დღე), 139Ce (ნახევარდაშლის პერიოდი 137.640 დღე) და 141Ce (ნახევარდაშლის პერიოდი 32.501 დღე). დანარჩენი რადიოიზოტოპის ნახევარდაშლის პერიოდია 4 დღე, მათგან უმეტესობისათვის, ნახევარდაშლის პერიოდი წარმოადგენს 10 წუთზე ნაკლებს. ამ ელემენტს აქვს აგრეთვე 2 ბეტა მდგომარეობა.
ცერიუმის იზოტოპების ატომური წონები მერყეობს 123 u (123Ce)-დან 152 u (152Ce)-მდე.
ფიზიკური თვისებები
ცერიუმი მოვერცხლისფრო მეტალია. იგი მიეკუთვნება ლანთანოიდების ჯგუფს. ცერიუმი ფერითა და ბზინვარებით ჰგავს რკინას, მაგრამ იგი რბილია და არის როგორც ჭედადი, ასევე დრეკადი მეტალი. ცერიუმს სხვა ელემენტებთან შედარებით გააჩნია სიდიდით მეორე თხევადობის რიგი 2648 C° (795 °C-დან 3443 °C-მდე) ან 4766 F° (1463 °F-დან 6229 °F-მდე)(პირველ ადგილზეა თორიუმი).
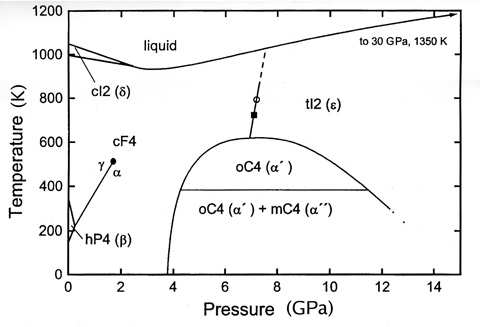
ცერიუმის ფაზური დიაგრამა
ცერიუმი განსაკუთრებით საინტერესოა თავისი ცვალებადი ელექტრონული სტრუქტურის გამო. შიგა 4f დონის ენერგია, ძალიან ახლოსაა გარე სავალენტო ელექტრონების ენერგიასთან და ძალიან მცირე ენერგიაა საჭირო ამ ელექტრონების დონეების შესაცვლელად. ეს იწვევს ორმაგი სავალენტო მდგომარეობის გაზრდას. მაგალითად, ცერიუმზე მაღალი წნევის ან დაბალ ტემპერატურის მოქმედებით მოცულობის 10% ცვლილება ხდება. ამ დროს (გაცივებისას ან შეკუმშვისა) ვალენტობა იცვლება 3-დან 4-მდე. დაბალ ტემპერატურაზე ცერიუმის ქცევა რთულია. ცნობილია მისი ოთხი ალოტროპიული მოდიფიკაცია: ცერიუმი ოთახის ტემპერატურაზე და ატმოსფერულ წნევაზე წარმოადგენს g-ცერიუმს. –16 °C ტემპერატურამდე გაცივების დროს, g-ცერიუმი იცვლება b-ცერიუმით. დარჩენილი g-ცერიუმი –172 °C-ზე გაცივებისას გადადის a-ცერიუმში და მთლიანად გარდაიქმნება –269 °C-ზე. a-ცერიუმის სიმკვრივეა 8.16; d-ცერიუმი არსებობს 726 °C ტემპერატურაზე მაღლა ატმოსფერულ წნევაზე, თხევადი ცერიუმი უფრო მკვრივია, ვიდრე ლღობის წერტილზე მისი მყარი ფორმა.
ქიმიური თვისებები
ცერიუმი ძლიერი აღმდგენი აგენტია და ჰაერზე 65 - 80 °C ტემპერატურაზე იწვის სპონტანურად. ცერიუმის წვის შესაჩერებლად, წყალი არ გამოიყენება, რადგანაც ცერიუმი მოქმედებს წყალთან, წყალბადის გამოყოფით.
მეტალი ცერიუმი ჰაერზე ნელა შავდება და სწრაფად იწვის 150 °C-ზე ცერიუმ(IV) ოქსიდის წარმოქმნით.
Ce + O2 → CeO2
ცერიუმი ძლიერ ელექტროდადებითია, ნელა რეაგირებს ცივ წყალთან, ხოლო საკმაოდ სწრაფად - ცხელ წყალთან ცერიუმის ჰიდროქსიდის წარმოქმნით.
2 Ce(მყ) + 6 H2O (სითხე) → 2 Ce(OH)3 (ხსნ.) + 3 H2 (აირი)
მეტალი ცერიუმი მოქმედებს ყველა ჰალოგენთან:
2 Ce (მყ) + 3 F2 (აირი) → 2 CeF3 (მყ) [თეთრი]
2 Ce (მყ) + 3 Cl2 (აირი) → 2 CeCl3 (მყ) [თეთრი]
2 Ce (მყ) + 3 Br2 (აირი) → 2 CeBr3 (მყ) [თეთრი]
2 Ce (მყ) + 3 I2 (აირი) → 2 CeI3 (მყ) [ყვითელი]

ცერიუმ მონიუმნიტრატი
-sulfat.jpg)
ცერიუმის (IV) სულფატი
ცერიუმი სწრაფად იხსნება განზავებულ გოგირდმჟავაში და წარმოქმნის უფერო Ce(III) იონების შემცველ ხსნარს, რომელიც შედის [Ce(OH2)9]3+ კომპლექსში.
2 Ce (მყ) + 3 H2SO4 (ხსნ.) → 2 Ce3+ (ხსნ.) + 3 SO2−4 (ხსნ.) + 3 H2 (აირი)
ნაერთები
ცერიუმ(IV) მარილები (ცერიტები) ნარინჯისფერი, წითელი ან ყვითელი ფერისაა, მაშინ როცა ცერიუმ(III) (cerous) მარილები ჩვეულებრივ თეთრი ან უფერულია. ორივე დაჟანგულობის მდგომარეობაში შთანთქავს ულტრაიისფერ სხივებს. ცერიუმ(III) გამოიყენება უფერო მინების დასამზადებლად. ცერიუმი შეიძლება ადვილად აღმოვაჩინოთ იშვიათ მიწათა ნარევებში ძლიერ მგრძნობიარე თვისებითი ტესტით: ამონიუმისა და წყალბადის ზეჟანგის ნარევის დამატება ლანტანოიდების წყალხსნარზე, ცერიუმის არსებობის შემთხვევაში იძლევა მუქ ყავისფერ შეფერილობას.
ცერიუმი ამჟღავნებს +2, +3 და +4 დაჟანგულობის ხარისხს. +2 მდგომარეობა იშვიათია და იგი შეინიშნება CeH2, CeI2 და CeS-ის შემთხვევაში.
ცერიუმის ყველაზე გავრცელებული ნაერთია ცერიუმ(IV) ოქსიდი (CeO2), რომელიც გამოიყენება, როგორც ”სამკაულების შესაფერადებლად” (შესაწითლებლად), ასევე გამოიყენება ზოგიერთი თვითგასუფთავებადი ღუმელების კედლებში.
ტიტრაციაში გამოყენებული დამჟანგველი აგენტებია ამონიუმის ცერიუმ(IV) სულფატი (ცერიტ ამონიუმ სულფატი, (NH4)2Ce(SO4)3) და ამონიუმის ცერიუმ(IV) ნიტრატი (ცერიტ ამონიუმ ნიტრატი ანუ CAN, (NH4)2Ce(NO3)6).
ცერიუმი აგრეთვე წარმოქმნის ქლორიდს CeCl3, რომელიც გამოიყენება ორგანულ ქიმიაში კარბონილის ჯგუფებზე რეაქციის ჩასატარებლად.
ცერიუმის სხვა ნაერთებია: ცერიუმ(III) კარბონატი (Ce2(CO3)3), ცერიუმ(III) ფთორიდი (CeF3), ცერიუმ(III) ოქსიდი (Ce2O3), ასევე ცერიუმ(IV) სულფატი (ცერიტ სულფატი Ce(SO4)2) და ცერიუმ(III) ტრიფლატი (Ce(OSO2CF3)3).
ცერიუმის ორი ჟანგვითი მდგომარეობა ფუძე თვისებებით განსხვავდება ერთმანეთისაგან: ცერიუმ(III) წარმოადგენს ძლიერ ფუძეს სხვა სამვალენტიან ლანთანოიდებთან შედარებით, ხოლო ცერიუმ(IV) სუსტი ფუძეა.
ეს განსხვავება საშუალებას იძლევა მნიშვნელოვნად ადვილად გამოიყოს და გასუფთავდეს იგი სხვა ლანთანოიდებისაგან. გამოიყენება შემდეგი მეთოდები:
- ჰიდროქსიდების ნარევის განზავებული აზოტმჟავით გამოტუტვა: სამვალენტიანი ლანთანოიდები იხსნება ცერიუმისაგან თავისუფალ პირობებში და სამვალენტიანი ცერიუმი რჩება უხსნად ნალექში, რომელიც შემდგომ შეიძლება გასუფთავდეს სხვადასხვა მიზნებისათვის.
- ცერიუმის გამოლექვა ნიტრატის ან ქლორიდის ხსნარისაგან, კალიუმის პერმანგანატისა და ნატრიუმის კარბონატის გამოყენებით, მოლური თანაფარდობით 1:4.
- იშვიათმიწათა ნიტრატების ხსნარების დუღილი კალიუმის ბრომატთან და მარმარილოს ნატეხებთან.
ცერიუმის მიღების ადრეულ სამრეწველო მეთოდში ცერიუმ(IV) ხსნარს აზოტმჟავაში ემატებოდა განზავებული გოგირდმჟავა. რეაქციის შედეგად ცერიუმ(IV) ფუძე მარილის სახით ილექებოდა, ხოლო სამვალენტიანი ლანთანოიდები რჩებოდა ხსნარში. თუმცა ძლიერ პრობლემური იყო ნალექის მთლიანად გამოყოფა გაფილტვრით ნარევის მაღალი კოროზიული თვისების გამო.
მოგვიანებით უპირატესობა მიენიჭა იშვიათ მიწათა მეტალების გამოყოფის კლასიკურ მეთოდს. ამ სტრატეგიის თანახმად ცერიუმი ნარევიდან თავიდანვე გამოიყოფა.
თუმცა ცერიუმის გასუფთავების ყველა მეთოდი არ ეყრდნობა მის ფუძიანობას. ცერიუმის ამონიუმ ნიტრატი (ამონიუმჰექსანიტრატცერატის(IV)) კრისტალიზაცია აზოტმჟავისაგან, წარმოადგენს გასუფთავების ერთ-ერთ მეთოდს. ცერიუმ (IV) ნიტრატი (ჰექსანიტროცერიუმმჟავა) უფრო ადვილად ექსტრაგირდება სხვადასხვა გამხსნელებში (მაგალითად, ტრი-ნ-ბუტილფოსფატი), ვიდრე სხვა სამვალენტიანი ლანთანოიდები.
ცერიუმ(IV) ძლიერი დამჟანგველია მჟავა პირობებში, მაგრამ მდგრადია ტუტე გარემოში, სადაც ცერიუმ(III) ხდება ძლიერი აღმდგენი. იგი ადვილად იჟანგება ატმოსფერული ჟანგბადით (O2).
მიღება
დაქუცმაცებული მინერალების ნარევს ამუშავებენ ცხელი, კონცენტრირებული გოგირდმჟავით, რომლის დროსაც მიიღება იშვიათ მიწათა ელემენტების წყალში ხსნადი სულფატები. მჟავა ფილტრატს ანეიტრალებენ ნატრიუმის ჰიდროქსიდით pH 3–4-მდე. ხსნარიდან გამოილექება თორიუმი ჰიდროქსიდის სახით და სცილდება ხსნარს. ამის შემდეგ ხსნარი მუშავდება ამონიუმის ოქსალატით, რათა იშვიათ მიწათა ელემენტები გადავიდეს შესაბამის უხსნად ოქსალატებში. ეს უკანასკნელები შემდგომი გამოწვით გადადის ოქსიდებში. ოქსიდები იხსნება აზოტმჟავაში, სადაც ძირითადი კომპონენტი ცერიუმია, რომლის მარილებიც აზოტმჟავაში უხსნადია.
მეტალური ცერიუმი მიიღება მეტალოთერმული აღდგენის ტექნოლოგიებით, როგორიცაა ცერიუმის ფთორიდების ან ქლორიდების აღდგენა კალციუმით ან ცერიუმის ქლორიდების (ან სხვა ჰალოგენიდების) ნალღობის ელექტროლოზით. მეტალოთერმული ტექნოლოგიები გამოიყენება მაღალი სისუფთავის ცერიუმის მისაღებად.
გამოყენება
ცერიუმ(III) ოქსიდის მთავარი ტექნოლოგიური გამოყენება მდგომარეობს იმაში, რომ იგი ახდენს ძრავიდან გამონაბოლქვი CO-ს შემცირებას. პრაქტიკულად, ცერიუმის ოქსიდი ამ მიზეზით ემატება საწვავს. გარდა ამისა, ცერიუმის ოქსიდის მნიშვნელოვანი გამოყენებაა, მისი მოხმარება ნახშირწყალბადების კატალიზში და თვითგასუფთავებად ღუმელებში.
ცერიუმ(IV) ოქსიდი წარმოადგენს ერთ-ერთ ყველაზე ეფექტურ აგენტს ოპტიკური კომპონენტების მინარევების დასალექად. მისი ნაერთები გამოიყენება მინის წარმოებაში როგორც გამაუფერულებელი კომპონენტი. მაგალითად, ცერიუმ(IV) ოქსიდი, ტიტან(IV) ის ოქსიდთან ერთად მინას აძლევს ოქროსფერ-ყვითელ შეფერვას. იგი მინას ანიჭებს ულტრაიისფერი სხივების სელექციური შთანთქმის უნარს.
ცერიუმის ოქსიდს გააჩნია მაღალი რეფრაქციული ინდექსი და მისი დამატება ემალს ხდის მეტად შუქმედეგს.
ცერიუმ(IV) ოქსიდი თორიუმის, ლანთანის, მაგნიუმის ან იტრიუმის ოქსიდებთან ერთად გამოიყენება პირიფორულ შენადნობების სახით (მაგალითად, გაზის განათების სისტემები - უესლბახი).
სხვა იშვიათ მიწათა მეტალების ოქსიდებთან ერთად იგი განიხილება როგორც მყარი ელექტროლიტი.
ცერიუმის ტრადიციული გამოყენებაა პიროფორულ მასალად გამოყენება. იგი შედის მიშმეტალის შენადნობის შემადგენლობაში.
ცერიუმი გამოიყენება სანთებლის კაჟქვებში, რადგანაც ცერიუმი ძლიან ემსგავსება გოგირდს და ჟანგბადს. მას იყენებენ ალუმინისა და რკინის შენადნობების სახით სხვადასხვა მიზნებისათვის.
ფოლადში ცერიუმი დეგაზიფიცირდება და ხელს უწყობს სულფიდების და ოქსიდების აღდგენას. იგი უჟანგავი ფოლადის წარმოებაში გამოიყენება დამლექავი აგენტის სახით.
ცერიუმის შენადნობები გამოიყენება მუდმივ მაგნიტში და ვოლფრამის ელექტროდებში.
ცერიუმ(IV) სულფატი გამოიყენება როგორც მოცულობითი დამჟანგველი აგენტად რაოდენობით ანალიზში. ცერიუმ ამონიუმის ნიტრატი ორგანულ ქიმიაში წარმოადგენს ერთ ელექტრონიან დამჯანგველს და საწყის სტანდარტს რაოდენობით ანალიზში.
ბიოლოგიური როლი
ცერიუმის ბიოლოგიური როლი ცოცხალ ორგანიზმებში არ არის ცნობილი, თუმცა ცერიუმის ოქსალატი წარმოადგენს გულისრევის საწინააღმდეგო საშუალებას.
ცერიუმი იშვიათ მიწათა მეტალების მსგავსად ხასიათდება დაბალი ტოქსიკურობით.
ცერიუმის წვის დროს გამოყოფილი ორთქლი ტოქსიკურია.
ცხოველები, ცერიუმის დიდი დოზით ინექციის დროს იღუპებიან გულ-სისხლძარღვთა კოლაფსის გამო.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით



