ტექნეციუმი
ტექნეციუმი არის ქიმიური ელემენტი ატომური ნომრით 43. მისი სიმბოლოა Tc. იგი წარმოადგენს ქიმიურ ელემენტს უმცირესი წონით, რომელსაც არ გააჩნია არც ერთი სტაბილური იზოტოპი, მისი ყველა ფორმა რადიოაქტიურია. ტექნეციუმი ბუნებაში გვხვდება ძალიან უმნიშვნელო რაოდენობით როგორც ურანის საბადოს სპონტანური დაშლის პროდუქტი. იგი ასევე მიიღება მოლიბდენის საბადოზე ნეიტრონების მოქმედებით. ტექნეციუმი წარმოადგენს მოვერცხლისფრო-რუხი ფერის გარდამავალ მეტალს და ქიმიური თვისებებით ახლოსაა მანგანუმთან და რენიუმთან.
ტექნეციუმის თვისებები ელემენტის აღმოჩენამდე იწინასწარმეტყველა დიმიტრი მენდელეევმა, რომელმაც ელემენტთა პერიოდულობის ცხრილში გამოტოვა ადგილი უცნობი ელემენტისათვის და უწოდა ”ეკამანგანუმი”. 1937 წელს ტექნეციუმი (ტექნეციუმ-37 იზოტოპი) გახდა პირველად ხელოვნურად მიღებული ელემენტი, საიდანაც წარმოდგა მისი სახელი ტექნიკური ანუ ხელოვნური.
ბირთვული იზომერის ტექნეციუმ-99-მეტას სიცოცხლის ხანგრძლივობა ძლიერ მცირეა და ახასიათებს g-სხივების გამოყოფა. მას ძირითადად ბირთვულ მედიცინაში დიაგნოსტიკური ტესტირებისათვის იყენებენ. ტექნეციუმ-99 კი გამოიყენება, როგორც b-ნაწილაკების წყარო. მისი დღეგრძელი ორი იზოტოპი კომერციულად მიიღება ბირთვულ რეაქტორში ურან-235-ის დაშლით. 1952 წელს წითელ გიგანტზე, რომელიც მილიონი წლისაა, ტექნეციუმ-98-ის აღმოჩენამ (რადგანაც მის არც ერთ იზოტოპს არა აქვს ნახევარდაშლის პერიოდი 4.2 მილიონ წელზე მეტი) გაამყარა თეორია, რომ ვარსკვლავებზე შეიძლება წარმოიქმნას მძიმე ელემენტები.
ისტორია
1860 წლიდან 1871 წლამდე ელემენტების პერიოდულობის ცხრილში ტექნეციუმის ადგილი თავისუფალი იყო. დიმიტრი მენდელეევმა მას ადგილი მიუჩინა მოლიბდენსა (42 ელემენტი) და რუთენიუმს (44 ელემენტი) შორის. 1871 წელს მან იწინასწარმეტყველა, რომ მას მაგნიუმის მსგავსი თვისებები ექნებოდა და უწოდა ”ეკამანგანუმი”.
1937 წელს კ. პერიმ და ე. სეგრემ მოლიბდენის ატომის ბირთვის ნეიტრონებით დაბომბვით პირველად მიიღეს ტექნეციუმი მცირე რაოდენობით. იგი არის ხელოვნურად მიღებული პირველი ელემენტი.

ურანის მადანი ტექნეციუმის მოიცავს კვალის სახით
გავრცელება და წარმოება
დედამიწის ქერქში ტექნეციუმი გვხვდება მხოლოდ ურანის საბადოს სპონტანური დაშლის დროს. 1კგ ურანი შეიცავს მხოლოდ 1 ნანოგრამ (10-9გ) ტექნეციუმს. ზოგიერთ წითელ გიგანტურ ვარსკვლავზე აღმოჩენილია ტექნეციუმის არსებობა. ეს წითელი გიგანტები ცნობილია, როგორც ტექნეციუმის ვარსკვლავები.
ტექნეციუმ-99 (9943Tc) მიიღება როგორც ურან-235 (23592U), ასევე პლუტონიუმ-239-ის დაშლით. მსოფლიო მარაგის 2/3 მოდის კანადასა და ნიდერლანდებში.
იზოტოპები
ტექნეციუმი, ატომური ნომრით (Z) 43, წარმოადგენს ყველაზე მცირე რიგობრივი ნომერის მქონე ელემენტს პერიოდულობის ცხრილში, რომელიც მხოლოდ რადიოაქტიურია. მეორე რადიოაქტიური ელემენტია პრომეთიუმი - ატომური ნომრით 61.
ყველაზე მდგრადი რადიოაქტიური იზოტოპებია: ტექნეციუმ-98 (ნახევარდაშლის პერიოდი 4.2 მილიონი წელი), ტექნეციუმ-97 და ტექნეციუმ-99 (ნახევარდაშლის პერიოდი 211.000 წელი). ოცდაათი დანარჩენი რადიოიზოტოპი შეიძლება დახასიათდეს მასით 85-დან 118-მდე, რომელთაგან უმეტესობის ნახევარდაშლის პერიოდი ერთ საათზე ნაკლებია. გამონაკლისია ტექნეციუმ-93 (ნახევარდაშლის პერიოდი 2.73 საათი), ტექნეციუმ-94 (ნახევარდაშლის პერიოდი 4.88 საათი), ტექნეციუმ-95 (ნახევარდაშლის პერიოდი 20 საათი) და ტექნეციუმ-96 (ნახევარდაშლის პერიოდი - 4.3 დღე).
ფიზიკური თვისებები
ტექნეციუმი მოვერცხლისფრო-რუხი ფერის რადიოაქტიური მეტალია, რომელიც გარეგნულად ჰგავს პლატინას. იგი ჩვეულებრივ მიიღება მონაცისფრო ფხვნილის სახით. ატომური ტექნეციუმისათვის დამახასიათებელია გამოსხივების ზოლები შემდეგ ტალღის სიგრძეზე: 363.3 ნმ, 403.1 ნმ, 426.2 ნმ, 429.7 ნმ და 485.3 ნმ.
სუფთა ტექნეციუმს აქვს ჰექსაგონალური კრისტალური მესერი თხელ ფენებში წახნაგცენტრირებული ფორმით. მისი მეტალური ფორმა (სუსტად) პარამაგნიტურია. სუფთა მეტალური ტექნეციუმის მონოკრისტალი ხდება ზეგამტარი 7.46 K ტემპერატურაზე დაბლა. ტექნეციუმის სიმკვრივეა 11.480 გ/სმ3, Tლღ = 2200°C, Tდუღ = 4600°C.
ქიმიური თვისებები
ტექნეციუმს პერიოდულობის ცხრილში მეშვიდე ჯგუფში უკავია ადგილი მანგანუმსა და რენიუმს შორის. პერიოდულობის კანონის თანახმად, მისი ქიმიური თვისებები არის შუალედური ამ ორ ელემენტს შორის, რომელთაგან ტექნეციუმი უფრო ემსგავსება რენიუმს, განსაკუთრებით მისი ქიმიური ინერტულობით და ტენდენციით, წარმოქმნას კოვალენტური ბმები.
მანგანუმისაგან განსხვავებით, ტექნეციუმი ადვილად არ წარმოქმნის კატიონს. ტექნეციუმის გავრცელებული ჟანგვითი რიცხვია +4, +5 და +7. იგი იხსნება სამეფო წყალში, აზოტმჟავაში და კონცენტრირებულ გოგირდმჟავაში, მაგრამ არ იხსნება არც ერთი კონცენტრაციის მარილმჟავაში.
ტექნეციუმის ურთიერთქმედებით წყალბადთან წარმოიქმნება უარყოფითად დამუხტული ჰიდრიდ იონი [TcH9]2−, რომელსაც გააჩნია [ReH9]2−-ის მსგავსი კრისტალური სტრუქტურა. იგი წარმოადგენს ტრიგონალურ პრიზმს, რომლის ცენტრშიც მოთავსებულია ტექნეციუმის ატომი, კუთხეებში კი - ექვსი წყალბადის ატომი. დანარჩენი სამი წყალბადი წარმოქმნის სამკუთხედს, რომელიც კვეთს პრიზმას მის ცენტრში.
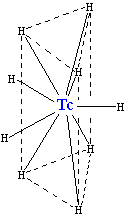
ტექნეციუმის ჰიდრიდი
ამ კომპლექსის კოორდინაციული რიცხვია 9 (იგულისხმება, რომ ტექნეციუმის ატომს აქვს ცხრა მეზობელი), რომელიც წარმოადგენს უმაღლესს ტექნეციუმის კომპლექსისათვის. კომპლექსში ორი წყალბადის ატომი შეიძლება ჩანაცვლდეს ნატრიუმის (Na+) ან კალიუმის (K+) იონებით.
ტექნეციუმის მეტალური ფორმა ჰაერზე მსუბუქად შავდება. მისი ფხვნილისებრი ფორმა იწვის ჟანგბადში. ცნობილია მისი ორი ოქსიდი: TcO2 და Tc2O7. დაჟანგვის პირობებში, როდესაც ატომები კარგავს ელექტრონებს, მიიღება ტექნეციუმ(VII) ტექნეცატ იონის -TcO4- სახით.
400 -450 °C-ზე ტექნეციუმის ოქსიდები წარმოქმნიან მკრთალ-ყვითელ ჰეპტოქსიდს.
4 Tc + 7 O2 → 2 Tc2O7
სადაც Tc-O ბმის სიგრძეა 167 -184 პიკომეტრი, ხოლო O-Tc-O კუთხე შეადგენს 180°.
ტექნეციუმ ჰეპტოქსიდი წარმოადგენს ნატრიუმის პერტექნეტატის პრეკურსორს.
Tc2O7 + 2 NaOH → 2 NaTcO4 + H2O
შავი ფერის ტექნეციუმ დიოქსიდი (TcO2) შეიძლება მივიღოთ ჰეპტოქსიდის ტექნეციუმით ან წყალბადით აღდგენით.
პერტექნეციუმ მჟავა (HTcO4) მიიღება Tc2O7-ის ურთიერთქმედებით წყალთან ან დამჟანგველ მჟავებთან: მაგალითად, აზოტმჟავასთან, გოგირდმჟავასთან, სამეფო წყალთან. შედეგად მიიღება მუქი წითელი, ჰიგროსკოპული (წყალმშთანთქმელი) ნივთიერება, რომელიც წარმოადგენს მჟავას და ადვილად იძლევა პროტონებს.
პერტექნეტატი ხშირად გამოიყენება წყალში ხსნადი Tc-ის იზოტოპების, როგორიცაა 99მეტაTc და აგრეთვე კატალიზატორის მისაღებად.
ტექნეციუმი წარმოქმნის მრავალ სულფიდს. TcS2 მიიღება ტექნეციუმის პირდაპირი ურთიერთქმედებით გოგირდთან, ხოლო Tc2S7 წარმოიქმნება პერტექნეციუმმჟავისაგან
2 HTcO4 + 7 H2S → Tc2S7 + 8 H2O
ამ რეაქციაში ტექნეციუმი არ აღდგება, როგორც ეს ხდება მანგანუმთან მსგავს რეაქციაში. გაცხელებით ტექნეციუმ ჰეპტასულფიდი იშლება დისულფიდად და ელემენტალურ გოგირდად.
Tc2S7 → 2 TcS2 + 3 S
ანალოგიური რეაქცია გვხვდება სელენთან და ტელურთან.
ცნობილია ტექნეციუმის რამდენიმე სახის დაჯგუფება Tc4, Tc6, Tc8 და Tc13. ყველაზე სტაბილურია Tc6 და Tc8 დაჯგუფებები, რომელთაც აქვთ პრიზმის ფორმა, სადაც ტექნეციუმის ატომების ვერტიკალური წყვილი დაკავშირებულია სამმაგი ბმით და პლანარული ატომები კი ერთმაგი ბმით. თითოეული Tc ატომი წარმოქმნის ექვს ბმას, ხოლო დარჩენილი სავალენტო ელექტრონები გაჯერებულია ერთი აქსიალური და ორი ხიდური ლიგანდის ჰალოგენატომებით, როგორიცაა ქლორი ან ბრომი.
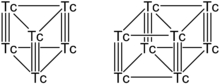
Tc6 და Tc8 ტექნეციუმის კლასტერები
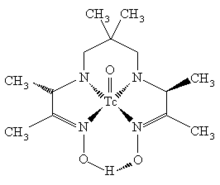
ტექნეციუმის ორგანული კომპლექსი
ტექნეციუმი წარმოქმნის მრავალ ორგანულ კომპლექსს, რომლებიც კარგადაა შესწავლილი, რადგანაც მათ დიდი მნიშვნელობა აქვთ ბირთვულ მედიცინაში. ტექნეციუმის კარბონილი Tc2(CO)10 წარმოადგენს თეთრ, მყარ ნაერთს. მის მოლეკულაში ტექნეციუმის ორი ატომი სუსტადაა დაკავშირებული ერთმანეთთან, ხოლო თითოეული ატომი გარშემორტყმულია ოქტაედრულად ხუთი კარბონილის ლიგანდით. ტექნეციუმის ატომებს შორის ბმის სიგრძე შეადგენს 303 პიკომეტრს. ორი მეტალური ტექნეციუმის ატომებს მსგავს კარბონილებს წარმოქმნის მანგანუმი და რენიუმი.
ტექნეციუმის კომპლექსები ორგანული ლიგანდებით ჩვეულებრივ გამოიყენებიან ბირთვულ მედიცინაში. იგი შეიცავს უნიკალურ Tc-O ფუნქციურ ჯგუფს, რომელიც ორიენტირებულია მოლეკულის სიბრტყისა, სადაც შეიძლება ჟანგბადის ატომი ჩანაცვლდეს აზოტის ატომით.
გამოყენება
ტექნეციუმ-99 გამოიყენება სამედიცინი ტესტების რადიოაქტიულ იზოტოპებში, მაგალითად, რადიოაქტიული კვალის სახით იგი აღმოჩენილი იქნა ადამიანის ორგანიზმში. ტექნეციუმ-99 წარმოადგენს b-სტანდარტს რადიომერტიასა და დოზიმეტრიაში.
ტექნეციუმმა გამოყენება ჰპოვა, როგორც კოროზიის ინჰიბიტორმა. განსაკუთრებული ანტიკოროზიული მედეგობის გამო ტექნეციუმი გამოიყენება, როგორც კონსტრუქციული მასალა რეაქტორების და ზუსტი ხელსაწყოების მშენებლობაში. მაღალი ლღობის ტემპერატურა საშუალებას იძლევა ტექნეციუმი გამოყენებულ იქნეს მაღალტემპერატურულ თერმოელემენტებში.
რენიუმის და პალადიუმის მსგავსად, ტექნეციუმი გამოიყენება კატალიზატორად. ზოგიერთ რეაქციაში, მაგალითად, იზოპროპილის სპირტის დეჰიდრირებისას იგი გაცილებით ეფექტური კატალიზატორია, ვიდრე რენიუმი ან პალადიუმი.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით