| წინა ელემენტი |
|
შემდეგი ელემენტი |
სახე
მოვერსცლისფერო–ნაცრისფერი
ძირითადი თვისებები
| დასახელება, სიმბოლო, ნომერი |
ბარიუმი, Ba, 56 |
| წარმოთქმა |
|
| ელემენტის კატეგორია |
ტუტე მიწა მეთალი |
| ჯგუფი, პერიოდი, ბლოკი |
2, 6, s |
| ატომური მასა |
137.33 გ მოლი-1 |
| ელექტრონული კონფიგურაცია |
[Xe] 6s2 |
| ელექტრონები ორბიტალებზე |
2, 8, 18, 18, 8, 2 |
ფიზიკური თვისებები
| აგრეგატული მდგომარეობა |
მყარი |
| სიმკვრივე |
3.51 გ სმ-3 |
| სიმკვრივე თხევად მგდომარეობაში (ლღობის ტემპერატურაზე) |
3.338 გ სმ-3 |
| ლღობის ტემპერატურა |
1000 K, 727˚C |
| დუღილის ტემპერატურა |
2170 K, 1897 ˚C, 3447 ˚F |
| კრიტიკული წერტილი |
|
| დნობის სითბო |
7.12 კჯ მოლი-1 |
| აორთქლების სითბო |
140.3 კჯ მოლი-1 |
| სპეციალური სითბოტევადობა |
(25 ˚C) |
| ორთლის წნევა | ||||||||||||||
|
ატომური თვისებები
| ჟანგვითი რიცხვები |
2 |
| ელექტროუარყოფითობა |
0.89 (პოლინგის შკალა) |
| იონიზაციის ენერგიები |
I: 502.9 კჯმოლი-1 |
| ატომური რადიუსი |
222 pm |
| კოვანელტური რადიუსი |
215 pm |
| ვან დერ ვაალსის რადიუსი |
268pm |
სხვადასხვა
| კრისტალური სტრუქტურა |
კუბური მოცულობითად ცენტრირებული |
| მაგნიტური მოწესრიგებულობა |
პარამაგნიტური |
| კუთრი ელექტრული წინაღობა |
(20˚C) 332ნΏ მ |
| სითბოგამტარობა |
(300 K) 18.4 ვტმ-1K-1 |
| სითბოგადაცემა |
(25˚C) 20.6 µm m-1K-1 |
| ბგერის სიჩქარე |
(20˚C) 1620მ/წმ |
| იუნგის მოდული |
13 გპა |
| შერის მოდული |
4.9 გპა |
| ბულკის მოდული |
9.6 გპა |
| სიმტკიცე მოსის მიხედვით |
1.25 |
| CAS-ის რეფისტრაციის ნომერი |
7440-39-3 |
მდგრადი იზოტოპები
| იზოტოპი | NA | ნახევარ-სიცოცხლე | DM | DE(MeV) | DP |
| 130Ba | 0.106% | 130 მდგრადია 74 ნეიტრონით | |||
| 132Ba | 0.101% | 132Ba მდგრადია 76 ნეიტრონით | |||
| 133Ba | სინთ | 10.51 წ | ε | 0.517 | 133Cs |
| 134Ba | 2.417% | 134 Ba მდგრადია 78 ნეიტრონით | |||
| 135Ba | 6.592% | 135Ba მდგრადია 79 ნეიტრონით | |||
| 136Ba | 7.854% | 136Ba მდგრადია h 80 ნეიტრონით | |||
| 137Ba | 11.23% | 137Ba მდგრადია 81 ნეიტრონით | |||
| 138Ba | 71.7% | 138Ba მდგრადია 82 ნეიტრონით | |||
ბარიუმი
ბარიუმი - მენდელეევის პერიოდული სისტემის მეექვსე პერიოდის მეორე ჯგუფის მთავარი ქვეჯგუფის ელემენტი, ატომური ნომერი 56. აღინიშნება სიმბოლით Ba (ლათ. Barium). მარტივი ნივთიერება ბარიუმი - რბილი, ჭედადი ტუტემიწა ლითონი მოვერცხლისფრო-თეთრი ფერის. ხასიათდება მაღალი ქიმიური აქტივობით.
ისტორია
ბარიუმი აღმოჩენილ იქნა ბარიუმის ოქსიდის (BaO) სახით 1774 წ. კარლ შეელეს მიერ. 1808 წ. ინგლისელმა ქიმიკოსმა გემფრი დევიმ ბარიუმის ჰიდროქსიდისა და ვერცხლისწყლის კათოდის სველი ელექტოლიზით მიიღო ბარიუმის ამალგამა; გახურებისას, ვერცხლისწყლის აორთქლებით გამოყო ლითონი ბარიუმი.
სახელწოდების წარმომავლობა
თავის სახელწოდება მიიღო ძვ.-ბერძნ. βαρύς - «მძიმე», რადგან მისი ოქსიდი (BaO) იქნა დახასიათებული როგორც მაღალი სიკვრივის მქონე, რაც ასეთი ნივთიერებებისთვის მეტად უჭვეულო იყო.

ბარიტი
ბუნებაში არსებობა
ბარიუმის არსებობა დედამიწის ქერქში შეადგენს მასის 0,05 %; ზღვის წყალი ბარიუმს საშუალოდ შეიცავს 0,02 მგ/ლ. ბარიუმი აქტიურია, ის შედის ტუტემიწა ლითონების ქვეჯგუფში და მინერალებში კავშირები საკმაოდ მტკიცე აქვს. ძირითადი მინერალებია: ბარიტი (BaSO4) და ვიტერიტი (BaCO3).
ბარიუმის იშვიათი მინერალებია: ცელზიანი ან ბარიუმის მინდვრის შპატი (ბარიუმის ალუმოსილიკატი), გიალოფანი (ბარიუმისა და კალიუმის შერეული ალუმოსილიკატი), ნიტრობარიტი (ბარიუმის ნიტრატი) და სხვა.
ადგილმდებარეობის ტიპები
მინერალური ასოციაციის მიხედვით ბარიტების მადნები იყოფიან მონომინერალურად და კომპლექსურად. კომპლექსურები იყოფიან ბარიტო-სულფიდურიან (შეიცავენ ტყვიის, თუთიის, ზოგჯერ სპილენძის სულფიდებს და რკინის კოლჩედანს, იშვიათად Sn, Ni, Au, Ag), ბარიტო-კალციტიანი (შეიცავს 75 % კალციტებს), რკინა-ბარიტიანი (შეიცავს მაგნეტიტს, გემატიტს,ზედა ზონებში გეტიტს და ჰიდროგეტიტს) და ბარიტო-ფლიუორიტული (ბარიტისა და ფლიუორიტის გარდა შეიცავს კვარცს და კალციტს, მცირე მინარევების სახით ზოგჯერ შეიცავს თუთიის, სპილენძის, ყიისა და ვერცხლისწყლის სულფიდებს).
პრაქტიკულობის თვალსაზრისით ინტერსს იწვევს ჰიდროთერმული ძარღური მონომინერალური, ბარიტო-სულფიდური და ბარიტი- ფლიუორიტული საბადოები. საწარმოო მნიშვნელობა აქვს ასევე ზოგ მეტასომატიკურ პლასტურ საბადოებს. დანალექ საბადოებს, რომლებიც წარმოადგენს ტიპიურ წყლის აუზების ქიმიურ დანალექს, რაც ძაან იშვიათად გვხვდება.
საბადოები
ყველაზე მსხვილი საბადოები მდებარეობს რუმინეთის, აშშ, საფრანგეთის ტერიტორიაზე.
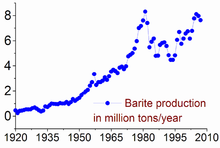
ბარიუმის წარმოება მსოფლიო მასტაბით
იზოტოპები
ბუნებრივი ბარიუმი შედგება შვიდი სტაბილური იზოტიპის ნარევისაგან: 130Ba, 132Ba, 134Ba, 135Ba, 136Ba, 137Ba, 138Ba. ბოლო წარმოადგენს ყველაზე გავრცელებულს (71,66 %). ცნობილია ბარიუმის რადიოაქტიური იზოტოპები, ყველაზე მნიშვნელოვანი მათ შორის არის 140Ba. ის წარმოიქმნება ურანის თორიუმის და პლუტონიუმის დაშლისას.
მიღება
ბარიუმის მისაღებად ნედლეულად ძირითად გამოიყენება - ბარიტის კონცენტრატი (80-95 % BaSO4), რომელსაც თავის მხრივ მიიღებენ ბარიტის ფლოტაციით. შემდეგში ბარიუმის სულფატს კოქსით აღადგენენ ან ბუნებრივი გაზით:
BaSO4 + 4С = BaS + 4CO↑
BaSO4 + 2CH4 = BaS + 2С + 4H2O↑.
შემდეგ სულფიდს გახურებით აჰიდროლიზებენ ბარიუმის ჰიდროქსიდამდე Ba(OH)2 ან CO2 ის მოქმედებით გარდაქმნის უხსნად ბარიუმის კარბონატად BaCO3, რომელიც გადჰყავთ ბარიუმის ოქსიდში BaO (გახურება 800 °C Ba(OH)2-ის და 1000 °C-ზე მეტი BaCO3):
BaS + 2H2O = Ba(OH)2 + H2S↑
BaS + H2O + CO2 = BaCO3 + H2S↑
Ba(OH)2 = BaO + H2O↑
BaCO3 = BaO + CO2↑
ბარიუმ ლითონს მიიღებენ ოქსიდის - ალუმინით აღდგენით. ალუმინით ვაკუუმში 1200—1250°С:
4BaO + 2Al = 3Ba + BaAl2O4.
ბარიუმს წმენდენ ვაკუუმში გატარებით ან დნობის ზონით.
ფიზიკური თვისებები
ბარიუმი მოვერცხლისფრო-თეთრი ჭედადი ლითონია. მკვეთრი დარტყმით სკდება. არსებობს ორი ბარიუმის ალოტროპიული მოდიფიკაცია: 375 °C-მდე მდგრადია α-Ba კუბური მოცულობით-ცენტრირებული ბადით (პარამეტრი а = 0,501 ნმ), ზემოთ მდგრადია β-Ba.
ამებიაზის რადიოგრამა
სიმაგრე მინერალოგიური შკალათი 1,25;
ბარიუბს ლითონს ინახავენ ნავთში
ქიმიური თვისებები
ბარიუმი ტუტემიწა ლითონია. ინტენსიურად იჟანგება ჰაერზე, და წარმოქმნის ბარიუმის ოქსიდს ბარიუმის ნიტრიდს Ba3N2, ხოლო უმნიშვნელო გახურებით აალდება. ენერგიულად მოქმედებს წყალთან, სადაც წარმოიქმნებოდა ბარიუმის ჰიდროქსიდი Ba(ОН)2:
Ba + 2Н2О = Ba(ОН)2 + Н2↑
აქტიურად მოქმედებს გაზავებულ მჟავეების ხსნართან. ბარიუმის ბევრი მარილი უხსნადია ან ნახევრად უხსნადია: ბარიუმის სულფატი BaSO4, ბარიუმის სულფიტი BaSO3, ბარიუმის კარბონატი BaCO3, ბარიუმის ფოსფატი Ba3(PO4)2. ბარიუმის სულფიდი BaS, კალციუმის სულფიდისაგან განსხვავებთ რომელის კარგად ხსნადია CaS.
ადვილად შედის რეაქციაში ჰალოგენებთან, და წარმოქმნის ჰალოგენიდებს.
წყალბადთან გახურებისას წარმოქმნის ბარიუმის ჰიდრიდს BaH2, რომელიც თავის მხრივ ლითიუმის ჰიდრიდთან LiH ერთად იძლევა კომპლექსს Li[BaH3].
გახურებისას რეაგირებს ამიაკთან:
6Ba + 2NH3 = 3BaH2 + Ba3N2
ბარიუმის ნიტრიდი Ba3N2 გახურებისას ურთიერთქმედებს CO, და წარმოქმნის ციანიდს:
Ba3N2 + 2CO = Ba(CN)2 + 2BaO
თხევად ამიაკთან იძლევა ლურლ ხსნარს, საიდანაც შეიძლება ამიაკატის გამოყოფა [Ba(NH3)6], რომელსაც ოქროსფერი ბზინვარება აქვს და ადვილად იშლება NH3-ის გამოყოფით. პლატინის კატალიზატორის არსებობისას ამიაკატი იშლება ბარიუმის ამიდის წარმოქმნით:
[Ba(NH3)6] = Ba(NH2)2 + 4NH3 + Н2
ბარიუმის კარბიდი BaC2 შეიძლება მიღებულ იქნას ბარიუმის ოქსიდის ღუმელში ნახშირთან ერთად გახურებით.
ფოსფორთან ქმნის ფოსფიდს Ba3P2.
ბარიუმი აღადგენს ოქსიდებს, ლითონების ჰალოგენიდებს და სულფიდებს შესაბამისი ლითონების წარმოქმნამდე.

მწვანე ფერის ბარიუმის შემცველი მაშხალები
ხარისხობრივი და რაოდენობრივი ანალიზი
ხარისხობრივად ხსნარებში ბარიუმი აღმოჩნდება ნალექების მოსვლისას ბარიუმის სულფატი BaSO4, რომელიც განსხვავდება შესაბამის კალციუმის სულფატისაგან და სტრონციუმის სულფატისაგან ძალიან დაბალი ხსნადობით არაორგანულ მჟავებში.
ნატრიუმის როდიზონატი ბარიუმის ნეიტრალურ მარილებიდან გამოყოფს დამახასიათებელ წითელ ნალექს ბარიუმის როდიზონატს. რეაქცია მეტად მგრძნობიარეა, სპეციფიკურად, იძლევა საშუალებას განისაზღვროს ბარიუმის იონების 1 ნაწილი ხსნარის 210000 ნაწილზე.
ბარიუმის ნაერთები ცეცხლის ალს აძლევენ მოყვითალო-მომწვანო ფერს (ტალღის სიგრძე 455 და 493 ნმ).
რაოდენობრივად ბარიუმს განსაზღვრავენ გრავიმეტრიის მეთოდით BaSO4 ან BaCrO4 -ის სახით.
გამოყენება
გეტერნური მასალის ხარისხში გამოყენება
ლითონური ბარიუმი ხშირად გამოიყენება შენადნობში ალუმინთან ერთად და გამიყენება როგორც აირშთამთქმელი (გეტერა) მაღალვაკუუმურ ელექტრო მოწყობილობებში.
ანტიკოროზიული მასალა
ბარიუმი ემატება ცირკონთან ერთად თხევადლითონურ თბომატარებელში (ნატრიუმის, კალიუმის, რუბიდიუმის, ლითიუმის, ცეზიუმის შენადნობი) უკანსკნელთა აგრესიულობის შესამცირებლად მილსადენებთან და მეტალურგიაში.
ოპტიკა
ბარიუმის ფტორიდი გამოიყენება მონოკრისტალის სახით ოპტიკაში (ლინზები, პრიზმები).
პიროტექნიკა
ბარიუმის პეროქსიდი გამოიყენება პიროტექნიკაში და როგორც დამჟანგავი. ბარიუმის ნიტრატი და ბარიუმის ქლორატი გამოიყენება პიროტექნიკაში ალის ფერის შესაღებად (მწვანე ცეცხლი).
ატომურ-წყალბადის ენერგეტიკა
ბარიუმის ქრომატი გამოიყენება წყალბადისა და ჟანგბადის მისაღებად თემოქიმური ხერხით (ოკ-რიჯის ციკლი, აშშ).
მაღალტემპერატურული ზეგამტარობა
ბარიუმის ოქსიდი სპილენძის ოქსიდთან და იშვიათმიწა ლითონებთან ერთად გამოიყენება ზეგამტარ კერამიკის სინთეზისათვის რომელიც მუშაობს თხევადი აზოტის ტემპერატურაზე და კიდევ უფრო მაღლა.
ბირთვული ენერგრტიკა
ბარიუმის ოქსიდი გამოიყენება სპეციალური მინის ხარშვის დროს - რომელიც გამოიყენება ურანის ღეროების დასაფარად. ერთერთი ყველაზე გავრცელებული ტიპის მინას აქვს შემდეგი შემადგენლობა - (ფოსფორის ოქსიდი - 61 %, ВаО - 32 %, ალუმინის ოქსიდი - 1,5 %, ნატრიუმის ოქსიდი - 5,5 %). ატომური მრეწველობისათვის მინის ხარშვისას გამოიყენება ასევე ბარიუმის ფოსფატი.
დენის ქიმიური წყაროები
ბარიუმის ფტორიდი გამოიყენება მყარისხეული ფტორიონულ აკუმულატორულ ბატარეებში,როგორც ფტორიდული ელექტროლიტის კომპონენტი.
ბარიუმის ოქსიდი გამოიყენება მძლავრ სპილენძჟანგიან აკუმულატორებში, როგორც აქტიური მასის კომპონენტი (ბარიუმის ჟანგი-სპილენძის ჟანგი).
ბარიუმის სულფატი გამოიყენება როგორც უარყოფითი ელექტროდის აქტიური მასის გამფართოვებელი ტყვია-მჟავური აკუმულატორების წარმოებისას.
ფასები
ლითონური ბარიუმი ზოდებში 99.9 % სიწმინდის მისი ფასი მერყეობს მიახლოებით 30 დოლარი 1 კგ-ზე.
ბიოლოგიური როლი
ბარიუმის ბიოლოგიური როლი საკმაოდ არაა შესწავლილი. ცხოვრებისათვის აუცილებელი მიკროელემენტების რიცხვში ის არ შედის. ბარიუმის ხსნადი მარილები ძლიერი საწამლავებია.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით



