| წინა ელემენტი |
|
შემდეგი ელემენტი |
სახე

უფერული გაზი, ანათებს მეწამულ ფერად მაღალი ძაბვის ქვეშ მოთავსებისას
ძირითადი თვისებები
| დასახელება, სიმბოლო, ნომერი |
ჰელიუმი, He, 2 |
| წარმოთქმა |
|
| ელემენტის კატეგორია |
კეთილშობილი გაზი |
| ჯგუფი, პერიოდი, ბლოკი |
18, 1, s |
| ატომური მასა |
4.002602(2) გ მოლი-1 |
| ელექტრონული კონფიგურაცია |
1s2 |
| ელექტრონები ორბიტალებზე |
ფიზიკური თვისებები
| აგრეგატული მდგომარეობა |
გაზი |
| სიმკვრივე |
0.1786 გ სმ-3 |
| სიმკვრივე თხევად მგდომარეობაში (ლღობის ტემპერატურაზე) |
გ სმ-3 |
| ლღობის ტემპერატურა |
0.95 K, -272.20 ˚C |
| დუღილის ტემპერატურა |
4.22 K, −268.93 ˚C, −452.07 ˚F |
| კრიტიკული წერტილი |
|
| დნობის სითბო |
0.0138 კჯ მოლი-1 |
| აორთქლების სითბო |
0.0829 კჯ მოლი-1 |
| სპეციალური სითბოტევადობა |
(25 ˚C) |
| ორთლის წნევა | ||||||||||||||
|
ატომური თვისებები
| ჟანგვითი რიცხვები | |
| ელექტროუარყოფითობა |
- (პოლინგის შკალა) |
| იონიზაციის ენერგიები |
I: 2372.3 |
| ატომური რადიუსი |
pm |
| კოვანელტური რადიუსი |
28 pm |
| ვან დერ ვაალსის რადიუსი |
140pm |
სხვადასხვა
| კრისტალური სტრუქტურა |
ჰექსაგონალური მჭიდროდ შეკრული |
| მაგნიტური მოწესრიგებულობა |
დიამაგნიტური[1] |
| კუთრი ელექტრული წინაღობა |
(20˚C) ნΏ მ |
| სითბოგამტარობა |
(300 K) 0.1513 ვტმ-1K-1 |
| სითბოგადაცემა |
(25˚C) µm m-1K-1 |
| ბგერის სიჩქარე |
(20˚C) 972მ/წმ |
| იუნგის მოდული |
გპა |
| შერის მოდული |
გპა |
| ბულკის მოდული |
გპა |
| სიმტკიცე მოსის მიხედვით | |
| CAS-ის რეფისტრაციის ნომერი |
7440-59-7 |
მდგრადი იზოტოპები
| იზოტოპი | NA | ნახევარ-სიცოცხლე | DM | DE(MeV) | DP |
| 3He | 0.000137% | 3He სტაბილურია 1 ნეიტრონით | |||
| 4He | 99.999863% | 4He სტაბილურია 2 ნეიტრონით | |||
ჰელიუმი
ჰელიუმი არის ქიმიური ელემენტი, რომლის ატომური ნომრია 2, ხოლო ატომური მასა - 4.002602. იგი გამოისახება სიმბოლოთი He. ჰელიუმი უფერო, უსუნო, უგემო, არატოქსიკური ინერტული აირია და პერიოდულ სისტემაში კეთილშობილი აირების ჯგუფის სათავეში დგას. ყველა დანარჩენ ელემენტებს შორის დუღს და ლღვება ყველაზე დაბალ ტემპერატურაზე.
ისტორია
მეცნიერული აღმოჩენა
1868 წელს ფრანგმა ასტროლოგმა პიერ ჯანსენმა (Pierre Janssen) მზის სხივებში პირველმა აღმოაჩინა ყვითელი სპექტრალური ხაზი და გამოთქვა მოსაზრება, რომ ეს სპექტრი ეკუთვნოდა ახალ ელემენტს. შემდგომში ინგლისელმა ასტრონომმა ნორმან ლოქკეირმა (Norman Lockyer) შეისწავლა ეს ყვითელი სპექტრი და ინგლისელ ქიმიკოსს ე. ფრანკლენდთან ერთად მას უწოდა ჰელიუმი (ჰელიოს - მზე). 1903 წელს ჰელიუმის დიდი მარაგი იქნა აღმოჩენილი ბუნებრივი გაზის საბადოებში აშშ-ში. ამიტომ აშშ დღესდღეისობით წარმოადგენს ჰელიუმის უმსხვილეს მომწოდებელს.
1882 წელს იტალიელმა ფიზიკოსმა ლუიჯი პალმიერიმ (Luigi Palmieri) პირველმა აღმოაჩინა ჰელიუმი დედამიწაზე ვულკან ვეზუვის (იტალიურად: Monte Vesuvio) D3 სპექტრალური ანალიზის დროს.
1895 წლის 26 მარტს შოტლანდიელმა ქიმიკოსმა სერ უილიამ რამზეიმ (Sir William Ramsay) იშვიათ მინერალ კლევეიტში მყოფი აირის შესწავლისას დედამიწაზე ჰელიუმი აღმოჩინა. რამზეი ეძებდა არგონს, მაგრამ ექსპერიმენტით მიღებული გაზებიდან აზოტისა და ჟანგბადის მოცილების შემდეგ დარჩენილი გაზისათვის შენიშნა ისეთივე კაშკაშა ყვითელი ხაზი, რომელიც შეესაბამებოდა მზის სისტემის D3 სპექტრს.
წყალბადის შემდეგ ჰელიუმი სამყაროში გავრცელებით მეორე ელემენტია, იგი ჩვენი გალაქტიკის 24%-ს შეადგენს. სპექტრალური ანალიზი გვიჩვენებს, რომ იგი არსებობს ატმოსფეროში. ჰაერში იგი არის 0.0005% მოცულობის მიხედვით.ჰელიუმის დიდი მარაგი იქნა აღმოჩენილი ბუნებრივ გაზებში (ზოგიერთში 10%-მდე). არათავისუფალი სახით იგი არსებობს მრავალ მინერალში, როგორიცაა კლევეიტი, რანიტი, მონაციტი და სხვა. აგრეთვე გავრცელებულია რადიოაქტიურ მინერალურ წყაროებში.
ექსტრაქცია და გამოყენება
1903 წელს აშშ-ში შეიქმნა გაზის გეიზერი (გაზის სვეტი). ქიმიკოსებმა ჰამილტონ კედიმ (Hamilton Cady) და დავიდ მაკფარლენდმა (David McFarland) გეიზერში გაზის ნიმუშების შესწავლისას აღმოაჩინეს,რომ იგი შედგებოდა მოცულობით 72% აზოტისაგან, 15% მეთანისაგან, 1% წყალბადისა და 12% უცნობი გაზისაგან. შემდგომი ანალიზის შედეგად დადგინდა, რომ უნცობ გაზში 1.84% ჰელიუმი იყო. მიღებული მონაცემებიდან დდგინდა, რომ დედამიწაზე იშვიათი აირი ჰელიუმი დიდი რაოდენობით იყო კონცენტრირებული ბუნებრივი გაზების საბადოებში. ამ მხრივ განსაკუთრებით მდიდარია კანსასის შტატის სამხრეთაღმოსავლეთით, ასევე ტეხასსა და ოკლაჰომაში არსებული საბადოები. ამან საშუალება მისცა შეერთებულ შტატებს გამხდარიყო ლიდერი მსოფლიოს ჰელიუმით მომარაგებაში. დიდი ხნის განმავლობაში აშშ-ს წილი ჰელიუმის მსოფლიო წარმოებაში 90%-ს შეადგენდა. დანარჩენს აწარმოებდა კანადა, პოლონეთი და რუსეთი. 2000 წელს აშშ-ში ჰელიუმზე მოთხოვნა გაიზარდა 15 მილიონ კგ-მდე წელიწადში. მოთხოვნის შესაბამისად იზრდება მისი ფასი, რომელიც 2002-2007 წლების განმავლობაში გაორმაგდა.
წარმოებაში ჰელიუმს ღებულობენ ბუნებრივი აირიდან ღრმა გაცივების მეთოდით. აირადმა ჰელიუმმა დიდი გამოყენება ჰპოვა მეტალების ავტოგენური დამუშავების დროს, საკვები პროდუქტების კონსერვირებისათვის და ა.შ. იმის გამო, რომ ჰელიუმს აქვს მაღალი თბოშემცველობა, დაბალი სიმკვრივე, დაბალი ხსნადობა და ინერტულობა, გამოიყენება ატომურ ენერგეტიკაში და მრეწველობაში. იგი ფართოდ გამოიყენება ფიზიკურ ლაბორატორიებში, როგორც გამაცივებელი აგენტი.
4He და ასევე 3He გამოიყენება ძირითადად ტემპერატურის მზომ ნაერთებად გაზურ თერმომეტრებში 80-დან 1°K-მდე ტემპერატურულ ინტერვალში. 3He ერთადერთი ნაერთია, რომელიც შეიძლება გამოყენებულ იქნეს ტემპერატურის გასაზომად 1°K-ზე დაბლა.

გაზის განმუხტვის მილაკი, შევსებული სუფთა ჰელიუმით

ჰელიუმის სარეკლამო ნათურა
ჰელიუმმა დიდი გამოყენება ჰპოვა დირიჟაბლების და საჰაერო ბურთების წარმოებაში. მიუხედავად იმისა, რომ ჰელიუმის მასა ორჯერ მეტია წყალბადის მოლეკულის მასაზე, მისი ამწევი ძალა შეადგენს წყალბადის ამწევი ძალის 92%, ხოლო მისი ქიმიური ინერტულობა გამორიცხავს ცეცხლის გაჩენის საფრთხეს.
იზოტოპები
ცნობილია ჰელიუმის რვა იზოტოპი, მაგრამ მათგან სტაბილურია მხოლოდ ჰელიუმ-3 და ჰელიუმ-4. დედამიწის ატმოსფეროში 4He მილიონ ატომზე მოდის 3He-ის ერთი ატომი. მათი შემცველობის შეფარდება იცვლება იმაზე დამოკიდებულებით, თუ საიდან არის იგი მიღებული, თუმცა ნარევში ყოველთვის მეტია ჰელიუმ-4. რადიოაქტიური ელემენტების ალფა-დაშლით წარმოიქმნება და ამ ელემენტთა მინერალებში გროვდება 4He (1გ ურანის დაშლის პროდუქტებთან წონასწორობაში იძლევა 1.1 × 10-7 სმ3 ჰელიუმს წელიწადში). მინერალში ჰელიუმის რაოდენობის შეფარდებით საწყის ნივთიერებასთან შეიძლება განისაზღვროს ამ უკანასკნელის აბსოლიტური ასაკი (ე.წ. ჰელიუმის მეთოდი), თუმცა უნდა აღინიშნოს, რომ ასეთი განსაზღვრისათვის გამოსადეგია მხოლოდ ზოგიერთი მინერალი განსაკუთრებული კრისტალური სტრუქტურით (მაგ. სამარსკიტი, ხლოპინიტი, მაგნეტიტი, შინიტი, კოლუმბიტი და სხვა), რომელთაც აქვთ უნარი დაიჭირონ რადიოაქტიური ჰელიუმი.
3He, 4He და 6He იზოტოპები შედგებიან ორი პროტონისა და 1,2,და 4 ნეიტრონისაგან შესაბამისად. 4He ბირთვი ანუ ალფა-ნაწილაკები ძლიერ მდგრადია და იგი ფართოდ გამოიყენება სხვადასხვა ბირთვულ რეაქციებში.
შესაძლებელია სხვადასხვა ნაერთების დაშლით მიღებულ იქნეს ჰელიუმის ეგზოტიკური იზოტოპები. ყველაზე მცირე ნახევარდაშლის პერიოდი აქვს ჰელიუმ-5 (7.6 × 10-22 წმ). ჰელიუმ-6 იშლება ბეტა-ნაწილაკების გამოყოფით. მისი ნახევარდაშლის პერიოდია 0.8 წმ. ჰელიუმ-7 აგრეთვე გამოყოფს ბეტა-ნაწილაკებს. ჰელიუმ-7 და ჰელიუმ-8 წარმიქმნებიან ჩვეულებრივ ბირთვულ რეაქციებში. ჰელიუმ-6 და ჰელიუმ-8 ცნობილი არიან როგორც ბირთვული ”halo”-ს შემცველები. ჰელიუმ-2 (ორი პროტონი და არც ერთი ნეიტრონი) წარმოადგენს რადიოიზოტოპს, რომელიც პროტონის გამოყოფის შემდეგ გარდაიქმნება პროტიუმად (წყალბადი), რომლის ნახევარდასლის პერიოდია 3 × 10-27 წმ.
შენაერთები
ჰელიუმის ვალენტობა ნულის ტოლია. იგი ნორმალურ პირობებში უმოქმედოა. ჰელიუმს შეუძლია წარმოქმნას არასტაბილური ნაერთები (რომლებიც ცნობილია როგორც ეგზიმერები”excimers”) ვოლფრამთან, იოდთან, ფტორთან, გოგირდთან და ფოსფორთან მხოლოდ ნაპერწკლური განმუხტვით ან ელექტრონებით დაბომბვით ან სხვა პირობების დროს. ამავე გზით მიიღება მოლეკულური ნაერთები: HeNe, HgHe10 და WHe2 და მოლეკულური იონები He+2, He2+2, HeH+ და HeD+. თეორიულად შესაძლებელია სხვა ნაერთებიც, როგორიცაა მაგალითად ჰელიუმის ფტორიდი (HHeF), რომელიც აღმოჩენილ იქნა 2000 წელს. იგი უნდა იყოს HarF-ის ანალოგი. გამოთვლებმა უჩვენა, რომ ორი ახალი ჰელიუმ-ჟანგბად შემცველი ნაერთი შეიძლება იყოს მდგრადი. ასევე 2005 წელს ტაივანში მომუშავე მეცნიერების მიერ თეორიულად იქნა შემოთავაზებული მეტასტაბილური [F– HeO] ანიონის წარმოებულის ორი ახალი ნაერთის მოლეკულური ფორმულა. თუ ასეთი ნაერთების არსებობა ექსპერიმენტალურად დადასტურდა, მაშინ ბოლო მოეღება ჰელიუმის ქიმიურ ინერტულობას.
მყარი და თხევადი ფაზები
მყარი ფაზა
მრავალი სხვა ელემენტისგან განსხვავებით ჰელიუმი თხევად აგრეგატულ მდგომარეობას ინარჩუნებს აბსოლუტური ნულის ქვემოთ ნორმალური წნევის პირობებში. ჰელიუმი მყარდება 1–1.5 K (დაახლოებით –272 °C ) ტემპერატურაზე დაახლოებით 25 ბარ (2.5 მპა) წნევის პირობებში. ხშირად ძნელია ჰელიუმის მყარი და თხევადი ფორმების გარჩევა, რადგანაც ორივე ფაზის გარდატეხის მაჩვენებელი ძალიან ახლოსაა ერთმანეთთან. მყარ ფაზას აქვს მკვეთრი ლღობის წერტილი და კრისტალური სტრუქტურა, მაგრამ იგი ადვილად იკუმშება. ლაბორატორიულ პირობებში წნევის ქვეშ შეიძლება მისი მოცულობის შემცირება 30%-მდე. როცა მოცულობითი დრეკადობა არის 50მპა, ჰელიუმის დრეკადობა 50-ჯერ მეტია, ვიდრე წყლისა. მყარი ჰელიუმის სიმკვრივეა 0.214 ± 0.006 გ/მლ 1.15 K - ის და 66 ატმ. წნევის დროს.

ჩვეულებრივი სითხეებისაგან განსხვავებით ჰელიუმ II ცოცდება ზედაპირზე ერთიანი დონის მისაღწევად. თუ ჰელიმიუმ II-ით შევსებულ წურჭელში მოვათავსებთ მეორე ჭურჭელს, მცირე ხნის შემდეგ დონეები გათანაბრდება. გარდა ამისა ჰელიუმი აცოცდება გარე გახშული კონტეინერის შიგა კედლებზეც.თუ იგი დახშული არ იქნება, ჰელიუმი გარეთაც გამოაღწევს და გაუჩინარდება.
თხევადი ჰელიუმი
თხევადი ჰელიუმი წარმოადგენს მსუბუქ, უფერო გამჭვირვალე სითხეს.
კეეზის მიერ (1926 წ. ) შენუშნული იქნა, რომ 2.172°K-ზე თხევად 4 He-ში, რომელიც იმყოფება ნაჯერი ორთქლის წნევის ქვეშ (37.80 მმ ვერცხლისწყლის სვეტისა) ადგილი აქვს ფაზურ გადასვლებს.მან ამ ტემპერატურის ზემოთ ჰელიუმს უწოდა ჰელიუმ I, ხოლო ქვემოთ - ჰელიუმ II. ჰელიუმ I მკვეთრად განსხვავდება ჰელიუმ II-გან. სხვა კრიოგენური სითხეების მსგავსად ჰელიუმ I მთელ მოცულობაში დუღს გაცხელებისას და იკუმშება, როდესაც ტემპერატურა ლამბდა წერტილის ქვემოთაა. ჰელიუმ I-ს აქვს დაბალი სიბლანტე. მისი სიმკვრივეა 0.145 გ/მლ.
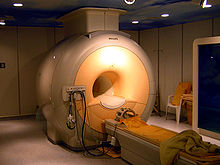
თხევადი ჰელიუმი გამოიყენება თანამედროვე მაგნიტური რეზონანსული სკანერების მუდმივი მაგნიტების გასაცივებლად.

ჰელიუმი სისმუბუქის გამო ხშირად გამოიყენება დირიჟაბლების შესავსებად.
ჰელიუმ II მშვიდი სითხეა. იგი ლამბდა წერტილის ქვემოთ იწყებს მისთვის არაჩვეულებრივი ხასიათის გამომჟღავნებას. ჰელიუმ II-ის დუღილი შეუძლებელია მაღალი თერმული გამტარობის გამო. გაცხელებისას იგი შთანთქავს ენერგიას და იწყება სითხის აორთქლება პირდაპირ აირად. ჰელიუმ II-ის თერმული გამტარობა ყველა ცნობილ ნაერთზე დიდია, იგი მილიონჯერ მეტია ვიდრე ჰელიუმ I-ის თერმული გამტარობა და რამოდენიმე ასეულჯერ მეტი სპილენძთან შედარებით. ჰელიუმ II-ში ადგილი აქვს თერმომექანიკურ ეფექტს ( შადრევან ეფექტი).
თუ ჰელიუმს მოვათავსებთ მილში და მის ქვედა ნაწილს გავაცხელებთ, მილის ზედა ნაწილიდან თხევადი ჰელიუმის დაიწყებს ამოსვლას შადრევანივით. ადგილი აქვს უკუეფექტსაც - ე.წ. მექანოკალორიულ ეფექტს. როდესაც ჭურჭელში შედის ჰელიუმი, ჭურჭელში ტემპერატურა მცირდება. ჰელიუმ II-ის კაპილარში ამოსვლის დროს აღმოჩნდა, რომ მისი სიბლანტე გაცილებით ნაკლებია, ვიდრე ჰელიუმ I-ისა. ეს თვისება - გაიაროს ვიწრო კაპილარი, რომლის დროსაც არ ავლენს სიბლანტეს (1938 წ.ნ. კაპიცა) ეწოდება ზედენადობა.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით


