| წინა ელემენტი |
|
შემდეგი ელემენტი |
სახე

ძირითადი თვისებები
| დასახელება, სიმბოლო, ნომერი |
ალუმინი, Al, 13 |
| წარმოთქმა |
|
| ელემენტის კატეგორია |
პოსტ-გარდამავალი მეტალი |
| ჯგუფი, პერიოდი, ბლოკი |
13, 3, p |
| ატომური მასა |
26.9815386(13) გ მოლი-1 |
| ელექტრონული კონფიგურაცია |
[Ne] 3s2 3p1 |
| ელექტრონები ორბიტალებზე |
2, 8, 3 |
ფიზიკური თვისებები
| აგრეგატული მდგომარეობა |
მყარი |
| სიმკვრივე |
2.70 გ სმ-3 |
| სიმკვრივე თხევად მგდომარეობაში (ლღობის ტემპერატურაზე) |
2.375 გ სმ-3 |
| ლღობის ტემპერატურა |
933.47 K, 660.32 ˚C |
| დუღილის ტემპერატურა |
2792 K, 2519 ˚C, 4566 ˚F |
| კრიტიკული წერტილი |
|
| დნობის სითბო |
10.71 კჯ მოლი-1 |
| აორთქლების სითბო |
294.0 კჯ მოლი-1 |
| სპეციალური სითბოტევადობა |
(25 ˚C) |
| ორთლის წნევა | ||||||||||||||
|
ატომური თვისებები
| ჟანგვითი რიცხვები |
3, 2, 1 |
| ელექტროუარყოფითობა |
1.61 (პოლინგის შკალა) |
| იონიზაციის ენერგიები |
I: 577.5 კჯ.მოლი |
| ატომური რადიუსი |
143 pm |
| კოვანელტური რადიუსი |
121±4 pm |
| ვან დერ ვაალსის რადიუსი |
184 pm |
სხვადასხვა
| კრისტალური სტრუქტურა |
ზედაპირცენტრირებული კუბისებური |
| მაგნიტური მოწესრიგებულობა |
პარამაგნიტური |
| კუთრი ელექტრული წინაღობა |
(20˚C) 28.2ნΏ მ |
| სითბოგამტარობა |
(300 K) 237 ვტმ-1K-1 |
| სითბოგადაცემა |
(25˚C) 23.1 µm m-1K-1 |
| ბგერის სიჩქარე |
(20˚C) ფურცლ.5,000მ/წმ |
| იუნგის მოდული |
70 გპა |
| შერის მოდული |
26 გპა |
| ბულკის მოდული |
76 გპა |
| სიმტკიცე მოსის მიხედვით |
2.75 |
| CAS-ის რეფისტრაციის ნომერი |
7429-90-5 |
მდგრადი იზოტოპები
| იზოტოპი | NA | ნახევარ-სიცოცხლე | DM | DE(MeV) | DP |
| 26Al | კვალი | 7.17×105y | β+ | 1.17 | 26Mg |
| ε | - | 26Mg | |||
| γ | 1.8086 | - | |||
| 27Al | 100% | 27Al მდგრადია 14 ნეიტრონით | |||
ალუმინი
ალუმინი Al (ლათ. Aluminium)- მენდელეევის პერიოდული სისტემის მესამე პერიოდის, მესამე ჯგუფის მთავარი ქვეჯგუფის ელემენტია, მისი ატომური ნომერია - 13. ალუმინი მიეკუთვნება მსუბუქი ლითონების ჯგუფს. იგი დედამიწის ქერქში ყველაზე გავრცელებული ელემენტია ჟანგბადისა და სილიციუმის შემდეგ. მარტივი ნივთიერება ალუმინი (CAS-ნომერი: 7429-90-5) - მსუბუქი, მჩატე, პარამაგნეტიკური მოვერცხლისფრო-მოთეთრო ფერის ლითონია, ჩამოისხმება და ადვილად ღებულობს ფორმას, დაყალიბებისა და მექანიკური დამუშავების შედეგად. ალუმინს ახასიათებს მაღალი თბოგამტარობა და ელექტროგამტარობა, კოროზიისადმი მდგრადია, რაც გამოწვეულია მის ზედაპირზე მტკიცე ალუმინის ოქსიდის აპკის სწრაფი წარმოქმნით, რომელიც იცავს ზედაპირს ჟანგბადთან შემდები ზემოქმედებისაგან.
ისტორია
ალუმინი პირველად მიღებულ იქნა ჰანს ქრისტიან ერსტედის მიერ 1825 წ. ალუმინის ქლორიდზე კალიუმის ამალგამის ზემოქმედებით და ვერცხლისწყლით მისი შემდგომი მოცილებით.
მიღება
ალუმინის მიღების თანამედროვე მეთოდი შემუშავებულ იქნა ერთმანეთისაგან დამოუკიდებლად ამერიკელი ჩარლზ მარტინ ჰოლლისა და ფრანგი პოლ ლუი ტუსენ ერუს მიერ 1886 წ. ამ მიღების მეთოდით- ალუმინის ოქსიდი Al2O3 იხსნება კრიოლიტის ნადნობში Na3AlF6 და შემდგომი ელექტროლიზით კოქსის ან გრაფიტის ელექტროდების გამოყენებით. მიღების ეს მეთოდი საჭიროებს ელექტროენერგიის დიდ ხარჯს, და ამიტომაც მასზე მოთხოვნა მხოლოდ XX საუკუნეში გაიზარდა.
1 ტ. (შავი) ალუმინისათვის საჭიროა 1.920 ტ. ალუმინის ოქსიდი, 0.065 ტ კრიოლიტი, 0.035 ტ ალუმინის ფტორიდი, 0.600 ტ. ანოდური მასა და 17 ათასი კვტ•სთ მუდმივი ელექტროდენის ენერგია.
ფიზიკური თვისებები
ალუმინის მიკროსტრუქტურა ზოდის ზედაპირზე, 99.9998% სიწმინდის ალუმინი, სექტორის ზომა 55 × 37 მმ., მოვერცხლისფრო-მოთეთრო ფერის მსუბუქი ლითონი, სიმკვრივე - 2,7 გ/სმ³, ტექნიკური ალუმინის დნობის ტემპერატურა - 658 °C, ხოლო მაღალი სიწმინდის ალუმინისათვის - 660 °C, დნობის კუთრი სითბო - 390 კჯ/კგ, დუღილის ტემპერატურა - 2500 °C, აორთქლების კუთრი სითბო - 10,53 მჯ/კგ, ჩამოსხმული ალუმინის დროებითი წინაღობა - 10-12 კგ/მმ², დეფორმირებულის - 18-25 კგ/მმ², შენადნობების - 38-42 კგ/მმ².
ბრინელის მეთოდის მიხედვით სიმაგრე - 24-32 კგს/მმ², მაღალი პლასტიკურობა: ტექნიკურისათვის - 35 %, სუფთასთვის - 50 %, ბრტყელდება თხელ ფურცლად კილიტადაც კი. იუნგას მოდული - 70 გპა.
ალუმინს ახასიათებს მაღალი ელექტროგამტარობა (0,0265 მკომ•მ) და მაღალი თბოგამტარობა (1.24×10−3 ვტ/(მ•К). მას აქვს სინათლის მაღალი არეკვლის თვისება, სუსტი პარამაგნეტიკია, გრძივი გაფართოების ტემპერატურული კოეფიციენტით 24.58×10−6 К−1 (20-200 °C).
ალუმინი თითქმის ყველა ლითონთან შენადნობებს წარმოქმნის. ყველაზე ცნობილი შენადნობებია მაგნიუმთან და სპილენძთან (დურალუმინი), სილიციუმთან (სილუმინი).
ალუმინი ბუნებაში
ბუნებრივი ალუმინი პრაქტიკულად მთლიანად შედგება მხოლოდ ერთი სტაბილური იზოტოპისაგან 27Al, რადიოაქტიური იზოტოპის 26Al -ის ნაშთებით (ნახევრადდაშლის პერიოდით 720 ათასი წელი), რომელიც წარმოიქმნება ატმოსფეროში კოსმოსური სხივების პროტონების მიერ არგონის ბირთვების ბომბარდირების დროს.
ალუმინს ბუნებაში გავრცელების მიხედვით უჭირავს პირველი ადგილი ლითონებს შორის და მე-3 ადგილი ელემენტებს შორის. სხვადასხვა მკვლევართა მიხედვით ალუმინის შემცველობა დედამიწის ქერქში შეადგენს მისი მასის 7.45% -დან 8.14 %-ს.
ალუმინი ბუნებაში, თავისი ქიმიური აქტივობის გამო, თითქმის არ გვხვდება თვითნაბადი სახით (თუმცა არსებობს გამონაკლისიც). ზოგიერთი მათგანი:
- ბოქსიტები - Al2O3 • H2O (SiO2, Fe2O3, CaCO3 მინარევებით)
- ნეფელინი - KNa3[AlSiO4]4
- ალუნიტი - (Na/K)2SO4 • Al2(SO4)3 • 4Al(OH)3
- თიხამიწა (კაოლინების ქვიშის SiO2, კირქვების CaCO3, მაგნეზიტების MgCO3 ნარევი)
- კორუნდი (საფირონი, ლალი) - Al2O3
- მინდვრის შპატი (ფელდშპატი) - (K,Na)2O • Al2O3 • 6SiO2, Ca[Al2Si2O8]
- კაოლინიტი - Al2O3 • 2SiO2 • 2H2O
- ბერილი (ზურმუხტი, აკვამარინი) - 3ВеО • Al2О3 • 6SiO2
- ქრიზობერილი (ალექსანდრიტი) - BeAl2O4.
თვითნაბადი ალუმინის წარმოქმნა შესაძლებელია სპეციფიკურ და აღმდგენ გარემო პირობებში.
ბუნებრივი წყლები ალუმინს შეიცავს მცირეტოქსიკური ქიმიური ნაერთების სახით, მაგ., ალუმინის ფტორიდი. კატიონის ან ანიონის ტიპი დამოკიდებულია, პირველ რიგში, წყლის გარემოს მჟავიანობაზე. ალუმინის კონცენტრაცია წყლის ზედაპირზე მერყეობს 0.001-დან 10 მგ/ლ-მდე, ხოლო ზღვის წყალში 0.01 მგ/ლ-მდე.
ქიმიური თვისებები
ნორმალურ პირობებში ალუმინი დაფარულია ოქსიდის მტკიცე თხელი ფენით და ამიტომ ის არ რეაგირებს კლასიკურ დამჟანგავებთან: H2O (t°); O2, HNO3-თან (გახურების გარეშე). ამის გამო ალუმინი პრაქტიკულად არ განიცდის კოროზიას და ფართოდ გამოიყენება თანამედროვე ინდუსტრიაში. ალუმინის ოქსიდის აპკის დარღვევის ან დაშლის შემთხვევაში (მაგ., ამონიუმის მარილების ხსნარები NH4+, ცხელ ტუტეებთან კონტაქტის დროს ან ამალგამაციის შედეგად), ალუმინი გამოდის როგორც აქტიური აღმდგენი ლითონი.
ალუმინი ადვილად რეაგირებს მარტივ ნივთიერებებთან:
ჟანგბადთან-
4Al + 3O2 = 2Al2O3
ჰალოგენებთან-
2Al + 3Br2 = 2AlBr3
სხვა არალითონებთან გაცხელების თანხლებით, გოგირდთან ალუმინის სულფიდის წარმოქმნით:
2Al + 3S = Al2S3
აზოტთან, ალუმინის ნიტრიდის წარმოქმნით:
2Al + N2 = 2AlN
ნახშირბადთან, ალუმინის კარბიდის წარმოქმნით:
4Al + 3С = Al4С3
ალუმინის სულფიდისა და კარბიდის ჰიდროლიზით:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
წყალთან, დამცავი ოქსიდის აპკის მოცილების შემდეგ,(მაგ., ამალგამირება ან ტუტეების ცხელი ხსნარები):
2Al + 6H2O = 2Al(OH)3 + 3H2
ტუტეებთან (ტეტრაჰიდროქსოალუმინატების და სხვა ალუმინატების წარმოქმნით):
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
2(NaOH × H2O) + 2Al = 2NaAlO2 + 3H2
ადვილად იხსნება მარილმჟავაში და განზავებულ გოგირდმჟავაში:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(განზ.) = Al2(SO4)3 + 3H2
გახურებისას იხსნება მჟავებში - დამჟანგავებში, რომლებიც წარმოქმნიან ალუმინის ხსნად მარილებს:
2Al + 6H2SO4(კონც.) = Al2(SO4)3 + 3SO2 + 6H2O
Al + 6HNO3(კონც.) = Al(NO3)3 + 3NO2 + 3H2O
აღადგენს ლითონებს მათი ოქსიდებიდან (ალუმინოთერმია):
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + Cr2O3 = Al2O3 + 2Cr
წარმოება
ბოქსიტი
ალუმინის წარმოებაზე მოგვითხრობს ერთი ლამაზი მაგრამ, არარეალური ლეგენდა «Historia naturalis».“ ერთხელ რომის იმპერატორ ტიბერიუსთან (42 წ. ჩ.წ.ა. - 37 წ. ახ.წ.ა.) მივიდა იუველირი ლითონის შეუვალი სასადილო თეფშით, რომელიც დამზადებული იყო თითქოს თიხამიწისაგან, - Al2O3. თეფში იყო ძალიან ნათელი და ბრჭყვიალა, როგორც ვერცხლი. ყველა ნიშნებით ეს თეფში უნდა ყოფილიყო ალუმინის. ამ დროს ოქრომჭედელი ამტკიცებდა, რომ მხოლოდ მან და ღმერთებმა იციან, თუ როგორ მიიღონ ეს ლითონი თიხიდან. ტიბერიუსი, იმის შიშით რომ თიხისგან იოლად მისაღები ლითონი ოქროსა და ვერცხლს გააუფასიურებდა, ბრძანა, ყოველ შემთხვევაში, მოეჭრათ თავი ამ ადამიანისთვის“. აშკარაა, ეს ლეგენდა მეტად საეჭვოა, რადგანაც თვითნაბადი ალუმინი ბუნებაში არ გვხვდება თავისი აქტიური ბუნების გამო და რომის იმპერიის დროს, შეუძლებელი იქნებოდა ისეთი ტექნიკური საშუალებების არსებობა რითაც შეძლებდნენ თიხამიწიდან ალუმინის მიღებას.
მხოლოდ 2000 წლის შემდეგ - 1825 წ., დანიელმა ფიზიკოსმა ჰანს ქრისტიან ერსტედმა მიიღო რამოდენიმე მილიგრამი ალუმინი, ხოლო 1827 წ. ფრიდრიხ ვიოლერმა შეძლო ალუმინის ნაწილაკების გამოყოფა, რომლების ჰაერზე მომენტალურად იფარებოდა ალუმინის ოქსიდის თხელი აპკით.
XIX ს-ის ბოლომდე ალუმინს სამრეწველო მაშტაბებით არ აწარმოებდნენ.
მხოლოდ 1854 წ. ენრი ეტიენ სენტ-კლერ დევილიმ გამოიგონა ალუმინის სამრეწველო წარმოების პირველი ხერხი, ნატრიუმისა და ალუმინის ორმაგი ქლორიდიდან NaCl × AlCl3 ლითონური ნატრიუმის მიერ ალუმინის გამოძევების საფუძველზე. 1855 წ. მიღებულ იქნა პირველი ალუმინის ზოდი რომლის მასა იყო 6-8 კგ. 36 წლის განმავლობაში, 1855-დან 1890 წ-მდე სანამ გამოიყენებოდა სენტ-კლერ დევილის მეთოდი, მიღებულ იქნა სულ 200 ტ. ლითონური ალუმინი. 1856 წ. მანვე მიიღო ალუმინი ნატრიუმ-ალუმინის ქლორიდის შენადნობის ელექტროლიზის შედეგად.
1885 წ., გერმანიის ქალაქ გმელინგემში რუსი მეცნიერის ნიკოლოზ ბეკოტოვის ტექნოლოგიის საფუძველზე აგებულ იქნა ალუმინის წარმოების ქარხანა. ბეკეტოვის ტექნოლოგია ბევრად არ განსხვავდებობა დევილის მეთოდისაგან, მაგრამ იყო შედარებით უფრო იოლი და დაფუძნებული იყო კრიოლიტისა (Na3AlF6) და მაგნიუმის ურთიერთქმედებაზე. 5 წლის განმავლობაში ამ ქარხანაში მიღებულ იქნა 58 ტ. ალუმინი - ალუმინის მსოფლიო მარაგის მეოთხედი, რომელიც ქიმიური მეთოდით მიღებულ იქნა 1854წ.-დან 1890წ.-მდე პერიოდში.
მეთოდი, რომელიც თითქმის ერთდროულად გამოგონილ იქნა ჩარლზ მარტინ ჰოლის მიერ აშშ-ში და პოლ ლუი ტუსენ ერუს მიერ საფრანგეთში 1886 წ. ეფუძნებოდა თიხამიწიდან (ალუმინის ოქსიდი) ელექტროლიზით ალუმინის მიღებას, რომელიც გახსნილი იყო გადნობილ კრეოლიტში, რომელმაც საფუძველი ჩაუყარა ალუმინის წარმოების თანამედროვე მეთოდს. ამის შემდეგ ელექტროტექნიკის განვითარებასა და დახვეწის შედეგად, ალუმინის წარმოებაც თანდათან იხვეწებოდა.
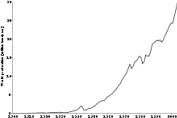
ალუმინის წარმოება
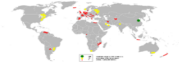
ამუმინის მოპოვება მსოფლიოში

ალუმინის რეციკლიზაციის ემბლემა და კოდი
1932 წელს სსრკ-ში ალუმინის პირველი ქარხანა აშენებულ იქნა ქ. ვოლხოვოში.
მეორე მსოფლიო ომმა მნიშვნელოვნად მისცა ალუმინის წარმოებას სტიმული. 1939 წ. ალუმინის მსოფლიო წარმოებამ სსრკ-ის ჩაუთვლელად, შეადგინა 620 ათასი ტ, ხოლო უკვე 1943 წ. გაიზარდა 1.9 მლნ. ტ-მდე.
1956 წ. მსოფლიოში წარმოებდა 3.4 მლნ. ტ. პირველადი ალუმინი, 1965 წ. – 5.4 მლნ. ტ, 1980 წ. – 16.1 მლნ. ტ, 1990 წ. - 18 მლნ. ტ.
2007 წ. მსოფლიოში წარმოებულ იქნა 38 მლნ. ტ. პირველადი ალუმინი, ხოლო 2008 წ. – 39.7 მლნ. ტ. წარმოების ლიდერები არიან:
- ჩინეთი (2007 წ. აწარმოა 12.60 მლნ. ტ, ხოლო 2008 – 13.50 მლნ. ტ)
- რუსეთი (3.96/4.20)
- კანადა (3.09/3.10)
- აშშ (2.55/2.64)
- ავსტრალია (1.96/1.96)
- ბრაზილია (1.66/1.66)
- ინდოეთი (1.22/1.30)
- ნორვეგია (1.30/1.10)
- არაბთა გაერთიანებული საემიროები (0.89/0.92)
- ბაჰრეინი (0.87/0.87)
- სამხრეთ აფრიკის რესპუბლიკა (0.90/0.85)
- ისლანდია (0.40/0.79)
- გერმანია (0.55/0.59)
- ვენესუელა (0.61/0.55)
- მოზამბიკი (0.56/0.55)
- ტაჯიკეთი (0.42/0.42).
ბოქსიტების მსოფლიო მარაგი პრაქტიკულად უსაზღვროა, ანუ ის მოთხოვნის დინამიკაზე შეუდარებლად დიდია. არსებულ სიმძლავრეებს შეუძლიათ აწარმოონ 44.3 მლნ. ტ. პირველადი ალუმინი წელიწადში. საჭიროა გავითვალიცწინოთ, რომ მომავალში შესაძლებელია ალუმინის გამოყენების ორიენტაცია გადატანილ იქნას კომპოზიციურ მასალებზე.
გამოყენება
ალუმინის ნაჭერი და ამერიკული მონეტა. ალუმინი ფართოდ გამოიყენება როგორც კონსტრუქციული მასალა. ალუმინის ძირითადი ღირსებებია - სიმსუბუქე, ტვიფვრისადმი მიდრეკილება, კოროზიისადმი მდგრადობა (ჰაერზე ალუმინი წამიერად იფარება მტკიცე Al2O3 -ის დამცველი აპკით, რომელიც ეწინააღმდეგება მის შემდგომ ჟანგვას), მაღალი თბოგამტარობა, მისი შენაერთების არატოქსიკურობა. კერძოდ კი, ამ თვისებებმა ალუმინი მეტად პოპულარული გახადა სამზარეულო ჭურჭელის წარმოებაში, ალუმინის კილიტის (ფოლგის) წარმოებაში კვების მრეწველობაში და დაფასოებაში.
ალუმინის ძირითად ნაკლს როგორც კონსტრუქციული მასალა წარმოადგენს - მცირე სიმტკიცე, ამიტომაც მას შეადნობენ სპილენძის და მაგნიუმის მცირე რაოდენობასთან (შენადნობს ეწოდება დურალუმინი).
ალუმინის ელექტროგამტარობა შეადგენს 1.7-ჯერ ნაკლებს ვიდრე სპილენძისა, ამასთან ალუმინი ორჯერ იაფია, ვიდრე სპილენძი. ამიტომაც ის ფართოდ გამოიყენება ელექტროტექნიკაში მავთულების წარმოებისათვის, მათი ეკრანირებისათვის და მიკროელექტრონიკაში ჩიპების წარმოებისას. ალუმინის დაბალ ელექტროგამტარობას (37 1/ომი) სპილენძთან შედარებით (63 1/ომი) აკომპენსირებენ გამტარების განივი კვეთის დიამეტრის გაზრდით. ალუმინის ნაკლს როგორც ელექტროტექნიკური მასალა წარმოადგენს მტკიცე ოქსიდის აპკის არსებობა მის ზედაპირზე, რომელიც ართულებს რჩილვას.
თვისებათა კომპლექსის დამსახურებით ალუმინი ფართოდ გამოიყენება თბოდანადგარებში.
ალუმინი და მისი შენადნობები ინარჩუნებენ სიმტკიცეს ძალიან დაბალი ტემპერატურის დროსაც.
მაღალი არეკვლის კოეფიციენტი სიიაფესთან და დეპონირების (ზედაპირის თხელი ფენით დაფარვა) სიიოლესთან კომბინაციაში ალუმინი წარმოადგენს იდეალურ მასალას სარკეების წარმოებისათვის.
საშენი მასალების წარმოებაში როგორც აირწარმომქმნელი აგენტი.
ალიტირებით ფოლადსა და სხვა შენადნობებს ანიჭებენ კოროზიამდგრადობას და გამობრძმედილობას, მაგალითად შიგა წვის ძრავებში - სარქველები, ტურბინებში - ნიჩბები (მხრები), ნავთობის პლათფორმაზე, თბოგამცვლელ ტექნიკაში, ასევე ცვლის თუთირებას.
ალუმინის სულფიდი გამოიყენება გოგირდწყალბადის წარმოებისათვის.
მიმდინარეობს კვლევა ალუმინის ქაფის შემუშავებაზე, როგორც განსაკუთრებულად მტკიცე და მსუბუქი მასალა, როგორც აღმდგენელი, როგორც ტერმიტების კომპონენტი, ნარევები ალუმოთერმიისათვის.
ალუმინს გამოიყენებენ იშვიათი ლითონების აღსადგენად მათი ოქსიდებიდან ან ჰალოგენიდებიდან, ასევე როგორც შენადნობებს ალუმინის საფუძველზე.
სუფთა ალუმინს როგორც კონსტრუქციულ მასალას თითქმის არ გამოიყენებენ, იხმარება მხოლოდ მისი შენადნობები.
ალუმინის ნაგლინი ალუმინო-მაგნიუმიანი Al – Mg (სერია 5ххх). Al – Mg სისტემის შენადნობები ხასიათდებიან დამაკმაყოფილებელი სიმტკიცის, კარგი პლასტიკურობის, ძალიან კარგი შედუღების და კოროზიისადმი მდგრადობის შეხამებით. ამის გარდა, ეს შენადნობები გამოირჩევიან მაღალი ვიბრომდგრადობით.
ამ სისტემის შენადნობებში, მაგნიუმის შემადგენლობა განისაზღვრება 6%-ით, იქმნება შეერთების ევტექტიკური სისტემა Al3Mg2-სა და ალუმინის საფუძველზე მყარ ნარევს შორის. მრეწველობაში ფართოდ გამოიყენება შენადნობები სადაც Mg-ის შემცველობა მერყეობს 1-დან 5%-მდე. Mg-ის შემცველობის ზრდასთან ერთად იზრდება შენადნობის სიმტკიცეც. მაგნიუმის ყოველი პროცენტი ზრდის სიმტკიცის ზღვარს 30 მპა-ით, ხოლო დენადობის ზღვარს - 20 მპა-ით. ამასთან ფარდობითი დაგრძელება მცირდება უმნიშვნელოდ და 30-35 %-ის ფარგლებშია. შენადნობები, რომლებიც მაგნიუმს შეიცავენ 3%-მდე (მასის მიხედვით) სტრუქტურულად სტაბილურია ოთახის და შედარებით მაღალი ტემპერატურის დროს. მაგნიუმის კონცენტრაციის ზრდასთან ერთად შენადნობის სტრუქტურა არასტაბილური ხდება. ამას გარდა, მაგნიუმის შემადგენლობის ზრდა 6%-ზე მაღლა იწვევს შენადნობის კოროზიისადმი მდგრადობის გაუარესებას. Al - Mg სისტემის შენადნობების სიმტკიცის მაჩვენებლების გასაუმჯობესებლად ხდება ლეგირება ქრომით, მანგანუმით, ტიტანით, სილიციუმით, ან ვანადიუმით. ამ სისტემის შენადნობებში სპილენძისა და რკინის მოხვედრას არიდებენ, რადგანაც ისინი ამცირებენ კოროზიისადმი მდგრადობას და შედუღაბებას.
ალუმინო-მანგანუმიანი Al – Mn (სერია 3ххх). ამ სისტემის შენადნობები ფლობენ კარგ სიმტკიცეს, პლასტიკურობას და ტექნოლოგიურობას, მაღალ კოროზიულ მდგრადობას და კარგ შედუღაბებას.
Al - Mn სისტემის შენადნობების ძირითადი მინარევებია რკინა და სილიციუმი. ორივე ეს ელემენტი ამცირებს მანგანუმის გახსნას ალუმინში. წვრილმარცვლოვანი სტრუქტურის მისაღებად ამ სისტემის შენადნობებს უწევენ ტიტანით ლეგირებას. საკმარისი რაოდენობის მანგანუმის არსებობა უზრუნველყოფს სტრუქტურის სტაბილურობას ოთახისა და უფრო მაღალი ტემპერატურის პირობებში.
ალუმინო-სპილენძიანი Al–Cu (Al–Cu–Mg) (სერია 2ххх). ამ სისტემის შენადნობების მექანიკური თვისებები თერმოგამოწრთობის მდგომარეობაში ზოგჯერ აჭარბებს და აღემატება კიდეც დაბალნახშირბადიანი ფოლადების მექანიკურ თვისებებს. ეს შენადნობები მაღალტექნოლოგიურნი არიან. მაგრამ მათ აქვთ არსებითი ნაკლოვანებებიც - კოროზიისადმი დაბალი წინააღმდეგობა, რაც საჭიროებს დამცველი ფენის აუცილებელ გამოყენებას.
ლეგირებისათვის გამოიყენება მანგანუმი, სილიციუმი, რკინა და მაგნიუმი. ამასთან ყველაზე ძლიერ გავლენას თვისებებზე ახდენს უკანასკნელი: მაგნიუმით ლეგირება (პასტით დაფარვა) შესამჩნევად ადიდებს სიმტკიცის და დენადობის ზღვარს. სილიციუმის დამატება შენადნობში ზრდის მის ხელოვნურ დაბერებას. რკინითა და ნიკელით ლეგირება ამაღლებს მეორე სერიის შენადნობების მხურვალმედეგობას.
Al–Zn–Mg (Al–Zn–Mg–Cu) სისტემის შენადნობები (სერია 7ххх). ამ სისტემის შენადნობები ფასობენ თავისი მაღალი სიმტკიცით და კარგი ტექნოლოგიურობით. სისტემის წარმომადგენელი - შენადნობი 7075 წარმოადგენს ყველაზე მტიცეს ალუმინიან შენადნობებს შორის. ასეთი მაღალი სიმტკიცის ეფექტი მიიღება თუთიის (70%) და მაგნიუმის (17.4%) მაღალი ხსნადობით მაღალი ტემპერატურის დროს, რომელიც მკვეთრად მცირდება გაცივებისას.
მაგრამ მნიშვნელოვან ნაკლს წარმოადგენს კოროზიისადმი მკვეთრად დაბალი მდგრადობა ძაბვის ქვეშ ყოფნისას. კოროზიისადმი მდგრადობის გაზრდა ძაბვის ქვეშ შესაძლებელია სპილენძით ლეგირებით (პასტით დაფარვა). აღსანიშნავია 60-იან წლებში აღმოჩენილი კანონზომიერება: შენადნობებში ლითიუმის შემცველობა ანელებს ბუნებრივ და აჩქარებს ხელოვნურ დაბერებას. ამას გარდა, ლითიუმის არსებობა ამცირებს შენადნობის კუთრ წონას და მნიშვნელოვნად ზრდის დრეკადობის მოდულს. ამ აღმოჩენის საფუძველზე შემუშავებულ იქნა ახალი სისტემის შენადნობები Al–Mg–Li, Al–Cu–Li и Al–Mg–Cu–Li.
ალუმინო-სილიციუმიანი შენადნობებს (სილუმინი) ჩამოასხამენ და ყველაზე ხშირად მათგან ასხამენ მექანიზმების კორპუსებს.
კომპლექსური შენადნობები ალუმინის საფუძველზე : ავიალი.

ალუმინის ძარის მქონე აუსტინ A40
ალუმინი გადაფის ზეგამტარ მდგომარეობაში 1,2 კელვინი ტემპერატურის დროს.
ალუმინი როგორც დანამატი სხვა შენადნობებში
ალუმინი წარმოადგენს მნიშვნელოვან კომპონენტს ბევრი შენადნობისათვის. მაგალითად, ალუმინიან ბრინჯაოში ძირითად კომპონენტებს წარმოადგენენ - სპილენძი და ალუმინი. მაგნიუმიან შენადნობებში დანამატად ყველაზე ხშირად გამოიყენება ალუმინი. სპირალებისა და ხვიების დასამზადებლად (სხვა შენადნობებთან ერთად) ელექტროგამახურებელ დანადგარებში გამოიყენებენ ფექრალს (Fe, Cr, Al).
საიუველირო ნაკეთობები
როდესაც ალუმინი ძალიან ძვირი ღირდა, მისგან ამზადებდნენ სხადასხვა საიუველირო ნაკეთობებს. მაგალითად ნაპოლეონ III შეუკვეთა ალუმინის ფოლაქები, ხოლო მენდელეევს 1889 წ. აჩუქეს სასწორი რომლის თეფშები ოქროსა და ალუმინის იყო. მოდა მასზე უცებვე გავიდა, როდესაც აღმოჩენილ იქნა მიღების ახალი ტექნოლოგიები, რითაც მისი თვითღირებულება საკმაოდ დაეცა. ეხლა ალუმინი ზოგჯერ გამოიყენება ბიჟუტერიის წარმოებისას.
მინის წარმოება
მინის წარმოებაში გამოიყენება ალუმინის ფტორიდი, ფოსფატი და ოქსიდი.
კვების მრეწველობა

ალუმინის ქაფი
ალუმინი რეგისტრირებულია როგორც კვების დანამატი Е173.
ალუმინი და მისი შენაერთები სარაკეტო ტექნიკაში
ალუმინი და მისი შენაერთები გამოიყენებიან როგორც მაღალეფექტური სარაკეტო საწვავი ორკომპონენტიან სარაკეტო საწვავებში და როგორც საწვავი კომპონენტი მყარ სარაკეტო საწვავებში. ალუმინის შემდეგი შენაერთები წარმოადგენენ უდიდეს პრაქტიკულ მნიშვნელობას როგორც სარაკეტო საწვავი:
ალუმინის ფხვნილი როგორც საწვავი მყარ სარაკეტო საწვავებში. გამოიყენება ასევე ფხვნილის სახით და სუსპენზიის სახით ნახშიწყალბადებში.
- ალუმინის ჰიდრიდი.
- ალუმინის ბორანატი.
- ტრიმეთილალუმინი.
- ტრიეთილალუმინი.
- ტრიპროპილალუმინი.
ტოქსიკურობა
ალუმინი გამოირჩევა უმნიშვნელო ტოქსიკური მოქმედებით, მაგრამ ბევრი ალუმინის ხსნადი არაორგანული შენაერთები წყალში ინარჩუნებენ ხსნადობას დიდი დროის განმავლობაში და შეუძლიათ ნეგატიური ზემოქმედება ადამიანზე და სხვა თბილსისხლიან ცხოველებზე სასმელი წყლის მეშვეობით. ყველაზე საწამლავია ალუმინის ქლორიდები, ნიტრატები, აცეტატები, სულფატები და სხვა. ადამიანზე ტოქსიკურ მოქმედებას იწვევს (ორგანიზმში მოხვედრის შემთხვევაში) ალუმინის შენაერთების შემდეგი დოზები (მგ/კგ სხეულის წონასთან):
- ალუმინის აცეტატი - 0.2-0.4
- ალუმინის ჰიდროქსიდი - 3.7-7.3
- ალუმინის შაბი - 2.9.
პირველ რიგში მოქმედებენ ნერვიულ სისტემაზე (გროვდებიან ნერვულ ქსოვილებში, რაც იწვევს ცნს-ის ფუნქციის მძიმე დარღვევებს). მიუხედავად ამისა ალუმინის ნეიროტოქსიკური თვისებების შესწავლა დაიწყეს 1960 წლებში, რადგანაც ლითონის დაგროვებას ორგანიზმში ეწინააღმდეგება მისი გამოყვანის მექანიზმები. ჩვეულებრივ პირობებში შარდთან ერთად დღე-ღამის განმავლობაში გამოიყოფა 15 მგ-მდე ელემენტი. შესაბამისად, ნეგატიურ ეფექტს იწვევს ადამიანში რომელთაც თირკმლების ფუნქციის დარღვევა აღენიშნებათ.
სამეურნეო-სასმელ წყალში ალუმინის ნორმატიული შემცველობა შეადგენს 0.2 მგ/ლ. ამასთან მისი შემცველობა შეიძლება გაზრდილ იქნას 0.5 მგ/ლ-მდე მთავარი სახელმწიფო სანიტარული ექიმის რეკომენდაციით.
ზოგიერთი ბიოლოგიური კვლევების შედეგად ორგანიზმში ალუმინის მოხვედრა მიჩნეულ იქნა ალცგეიმერის დაავადების გამომწვევ ფაქტორად. მაგრამ ეს კვლევა გვიან გაკრიტიკებულ იქნა და მათ შორის კავშირი უარყოფილი იქნა.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით



