J. Geo. Chem. Soc., 2021, Vol. 1, Issue: 1, pp. 17 - 22
ინდოლო[7,6-g]ინდოლისა და ბენზო[e]პიროლო[3,2-g]ინდოლის ახალი ბენზიმიდაზოლილნაწარმების სინთეზი
ივანე ჯავახიშვილის სახელობის თბილისის სახელმწიფო უნივერსიტეტი
Abstract.
ჩატარებულია ინდოლო[7,6-g]ინდოლის მონო- და დიალდეჰიდების კონდენსაციის რეაქციები ორთოფენილენდიამინთან, წარმოქმნილი შუალედური პროდუქტების გამოყოფის გარეშე, მათი ციკლიზაცია შესაბამისი ბენზიმიდაზოლური ნაწარმების მიღებით. შესწავლილია რეაქციის ოპტიმალური პირობები სხვადასხვა კატალიზატორებისა და რეაქციის ტემპერატურული რეჟიმის გამოყენებით. ანალოგიურად შესწავლილია კონდენსაციისა და ერთდროული ციკლიზაციის რეაქცია დიკარბოქსიბენზოპიროლოინდოლისა ორთოფენილენდიამინთან. გამოყოფილი და დახასიათებულია 3(ბენზიმიდაზოლ-2-ილ)-და 3,8-ბის((ბენზიმიდაზოლ-2-ილ)-1H,6H-ინდოლო[7,6-g]ინდოლი, 2,9-ბის(ბენზიმიდაზოლ-2-ილ)-ბენზო[e]პიროლო[3,2-g]ინდოლი. სინთეზირებული ახალი მრავალბირთვიანი ჰეტეროციკლური სისტემები საინტერესოა იმით, რომ მათ სტრუქტურებში შენაჩუნებულია პიროლის ბირთვების რეაქციისუნარიანი α- ან β-მდგომარეობები-სარეაქციო ცენტრები, რომელთა საფუძველზე შესაძლებელია მრავალი საინტერესო გარდაქმნის ჩატარება მოსალოდნელი ბიოლოგიურად აქტიური ნაერთების მისაღებად. სინთეზირებული ახალი ნივთიერებებისათვის სტრუქტურა დადასტურებულია ი.წ., უ.ი., 1H-მბრ სპექტრების მონაცემებით.
Keywords: ბენზიმიდაზოლი, ბენზოპიროლოინდოლი, ინდოლოინდოლი, კონდენსაცია, ციკლიზაცია.
შესავალი
ჩვენს მიერ უკანასკნელი სამი ათეული წლის მანძილზე შექმნილია ინდოლის უახლოესი სტრუქტურული ანალოგები - ახალი ჰეტეროციკლური სისტემები - იზომერული კონდენსირებული ინდოლოინდოლები და ბენზოპიროლოინდოლი. შესწავლილია მათი ფიზიკურ-ქიმიური თვისებები, გამოვლენილია ანტიმიკრობული, ანტივირუსული, სიმსივნის საწინააღმდეგო, კურარეს მსგავსი და სხვა ბიოლოგიური აქტიურობის მქონე ნაერთები[1-12 ].
ინდოლისა და ბენზიმიდაზოლის ბირთვის შემცველი მრავალი პრეპარატი მიღებულია სინთეზური გზით. ამიტომ, საინტერესოა, ამ ორი ჰეტეროციკლური ბირთვის გაერთიანება ახალი სისტემების - ბენზიმიდაზოლილინდოლოინდოლისა და ბენზიმიდაზოლილ ბენზოპიროლოინდოლის მისაღებად, მათი ურთიერთგავლენის შესწავლა ქიმიურ-ბიოლოგიურ თვისებებზე. მიღებული სისტემები პერსპექტიულად მიგვაჩნია, რადგან მოლეკულებში შენარჩუნებულია ჩაუნაცვლებელი პიროლის ბირთვის სარეაქციო ცენტრები, რის საფუძველზეც შესაძლებელია მრავალი საინტერესო თვისების მქონე ახალი ნაერთის მიღება.
შედეგების განსჯა
წარმოდგენილი ნაშრომი ეძღვნება ახალი მრავალბირთვიანი ჰეტეროციკლური ნაერთების - ბენზიმიდაზოლილინდოლოინდოლისა და ბენზიმიდაზოლილბენზოპიროლოინდოლის სინთეზს. სამუშაოს მიზანს შეადგენდა ბენზიმიდაზოლის ბირთვის დაკავშირება ერთ შემთხვევაში ინდოლოინდოლისა და მეორე შემთხვევაში ბენზოპიროლოინდოლის ბირთვთან.
ამისათვის ჩვენ ავირჩიეთ ბენზიმიდაზოლის ბირთვის სინთეზისათვის ერთსაფეხურიანი მეთოდი - ინდოლოინდოლისა და ბენზოპიროლოინდოლის კარბონილური ნაწარმების (ალდეჰიდი, კარბონმჟავა) ურთიერთქმედება ორთო-ფენილენდიამინთან სხვადასხვა კატალიზატორების გამოყენებით, სხვადასხვა ტემპერატურის პირობებში.
ძირითად საკვლევ სქემად შერჩეულ იქნა ინდოლო[7,6-g]ინდოლის ალდეჰიდების 1 და 2 ურთიერთქმედების რეაქციების შესწავლა ორთო-ფენილენდიამინთან 3 სხვადასხვა პირობებში. ხოლო ბენზოპიროლოინდოლის შემთხვევაში საწყის პროდუქტად აღებულ იყო დიკარბოქსი ნაწარმი 4 და მისი ურთიერთქმედება ორთო-ფენილენდიამინთან (სქემა 1).
წარმოდგენილი სქემის მიხედვით რეაქცია კარბონილურ ნაერთებსა და ორთო-ფენილენდიამინს შორის ამ პირობებში უნდა მოხდეს კონდენსაციის შუალედური პროდუქტის - „შიფის ფუძის“ (1-a) წარმოქმნით და მისი გამოყოფის გარეშე ციკლიზაციით ბენზიმიდაზოლური ციკლური ნაერთის 5 მიღებით (სქემა 2).
რეაქციების ოპტიმალური პირობების დასადგენად კონდენსაციისა და ერთდროული ციკლიზაციის პროცესები ჩატარებულ იქნა სხვადასხვა კატალიზატორების გამოყენებით. მოსინჯული იქნა მაციკლიზებელი აგენტები - ყინულოვანი ძმარმჟავა, პოლიფოსფორმჟავა და ფოსფორის ქლორჟანგი.
3-ფორმილ-ინდოლო[7,6-g]ინდოლის (1) [4] ურთიერთქმედება ორთო-ფენილენდიამინთან ყინულოვან ძმარმჟავაში მიმდინარეიბდა 80 -85 °C-ზე 3 სთ -ის განმავლობაში. რეაქციის პროდუქტი გასუფთავებული იქნა ქრომატოგრაფიულ სვეტზე, ჩატარებულია გამოყოფილი ნივთიერების სპექტრული ანალიზი.
ჩატარებული იქნა 3-ფორმილინდოლო[7,6-g]ინდოლის ურთიერთქმედების რეაქცია ორთოფენილენდიამინთან ასევე პოლიფოსფორმჟავაში 80 -85 °C-ზე 30 წთ-ის განმავლობაში. სარეაქციო არის წყლითა და ტუტით დამუშავების შემდეგ, არის pH-ის მნიშვნელობის კონტროლით (უნივერსალური ინდიკატორის ქაღალდი) გამოყოფილი იქნა რეაქციის პროდუქტი მუქი აგურისფერი -მოყავისფრო ფხვნილის სახით. ის ძნელად იხსნება გამხსნელებში (ეთერი, სპირტი, ეთილაცეტატი), შედარებით უკეთ იხსნება ტეტრაჰიდროფურანში. ეს აძნელებს გასუფთავების პროცესს. ნედლი პროდუქტის გამოსავლიანობა შეადგენს 94%-ს.
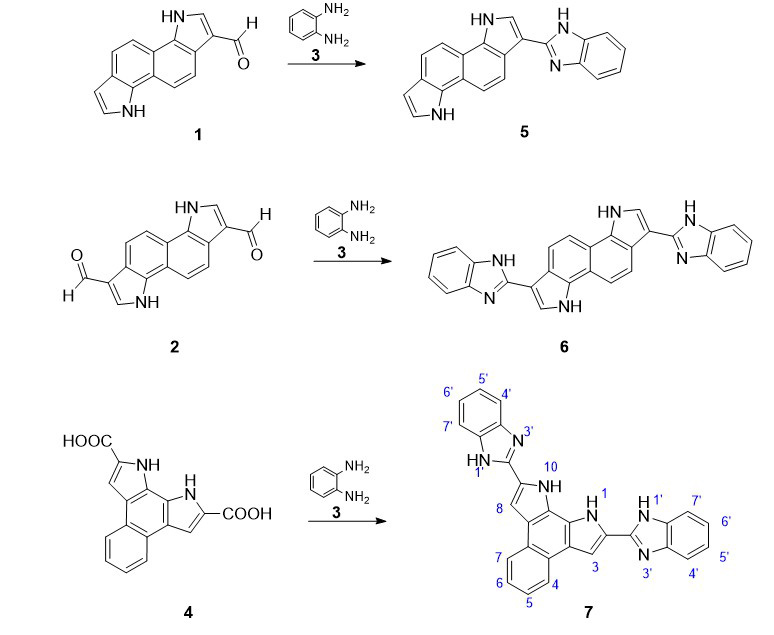
სქემა 1. ინდოლო[7,6-g]ინდოლის ალდეჰიდების 1 და 2 ურთიერთქმედების რეაქციები ორთო-ფენილენდიამინთან 3 სხვადასხვა პირობებში
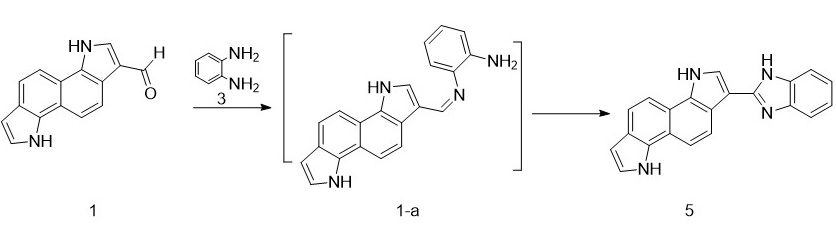
სქემა 2. ბენზიმიდაზოლური ციკლური ნაერთის 5 სინთეზი
ნაერთი 5 -ის ინფრა -წითელ სპექტრში ჩნდება NH ბმების შთანთქმის მახასიათებელი რამდენიმე გაფართოებული ზოლი 3409, 3159, 3062 სმ -1 უბანში, სპექტრში ქრება ალდეჰიდის C=O ჯგუფის მახასიათებელი ზოლი 1630 სმ -1 და ვლინდება C=N ბმის შთანთქმის ზოლი 1609 სმ -1 უბანში.
ნაერთის 5 ულტრაიისფერ სპექტრში ფიქსირდება შთანთქმის 3 მაქსიმუმი 210, 230, 330 ნმ -ს უბნებში,რომელიც დამახასიათებელია არომატული სისტემისთვის.
ნაერთის 5 პროტონულ მაგნიტური რეზონანსის სპექტრში ველის სუსტ უბანში შეინიშნება სამი სინგლეტური პიკი, რომელიც შეიძლება მივაკუთნოთ როგორც ინდოლური ასევე ბენზიმიდაზოლის ბირთვის NH ბმების პროტონებს. ყველაზე სუსტ უბანში გაფართოებული სინგლეტი (12.80 მნ) მივაკუთვნეთ იმიდაზოლის NH პროტონებს.ხოლო გაფართოებული სინგლეტები სიგნალები 11.72 მნ და 10.03 მნ მივაკუთვნეთ ინდოლოინდოლის ბირთვის NH პროტონებს შესაბამისად ჩანაცვლებულ და ჩაუნაცვლებელ პიროლის ბირთვებში.
არომატული პროტონების უბანში შეინიშნება ერთი სინგლეტური სიგნალი,რომელიც მივაკუთნეთ ბენზიმიდაზოლით ჩანაცვლებული პიროლის ბირთვის ალფა პროტონს (7.36 მ.ნ.). ჩაუნაცვლებელი პიროლის ბირთვის პროტონული სიგნალები ვლინდება (7.49-7.51 მ.ნ. უბანში). სპექტრში ვლინდება ასევე ნაფთალინის ბირთვის არომატული სიგნალები სიმეტრიული დუბლეტების სახით სპინ -სპინური ურთიერთქმედების ორთო კონსტანტით (8.8 ჰც). იმიდაზოლის ციკლში შემავალი ბენზოლის ბირთვის პროტონებიც მჟღავნდება დუბლეტ - დუბლეტების სახით (7.11-7.14 მ.ნ. უბანში).
შესწავლილი იქნა, ასევე, ინდოლოინდოლის დიალდეჰიდის - 3,8-დიფორმილინდოლო[7,6-g]ინდოლის 2 [2] ურთიერთქმედების რეაქცია ორთოფენილენდიამინთან სხვადასხვა პირობებში. ო -ფენილენდიამინი ყველა შემთხვევაში აღებული იყო სამჯერადი სიჭარბით.
ძმარმჟავაში რეაქცია ჩატარებულ იქნა მისი დუღილის ტემპერატურაზე, 2 საათის განმავლობაში. სარეაქციო არედან გამხსნელის აორთქლების შემდეგ გამოკრისტალდა რეაქციის პროდუქტი 6 აგურისფერ -ყავისფერი ფხვნილის სახით.
ბენზიმიდაზოლის სინთეზის ეფექტურ მეთოდს წარმოადგენს კონდენსაციის რეაქციის ჩატარება ფოსფორის ქლორჟანგის არეში, რომელიც გამოდის როგორც კატალიზატორის, ისე გამხსნელი როლში. რეაქციის ჩატარების დროს მოცემული დიალდეჰიდის უხსნადობის გამო ფოსფორის ქლორჟანგში გახსნის მიზნით დავუმატეთ დიმეთილფორმამიდი და ვაცხელეთ 105 -110°C ტემპერატურაზე, სარეაქციო არის ტუტით დამუშავების შემდეგ გამოიყო ნალექი მუქი ყავისფერი ფხვნილის სახით, ის უხსნადია, ძირითად ორგანულ გამხსნელებში.
დიალდეჰიდის 2 და ო -ფენილენდიამინის კონდენსაცია პოლიფოსფორმჟავაში ჩატარებულ იქნა 70°C ტემპერატურაზე 1 საათის განმავლობაში. სარეაქციო არის წყლით დამუშავების შემდეგ გამოყოფილ იქნა რეაქციის პროდუქტი, მოწითალო -მოყავისფერი ფხვნილის სახით. იგი, განსხვავებით ფოსფორის ქლორჟანგში ჩატარებული რეაქციის პროდუქტისაგან, კარგად იხსნება აცეტონში და დიმეთილსულფოქსიდში გაცხელებით.
სხვადასხვა პირობებში მიღებული კონდენსაციის პროდუქტებისათვის 6 გადაღებულ იქნა ი.წ. და უ.ი. სპექტრები და დადასტურებული იქნა მათი იდენტურობა.
კონდენსაციის პროდუქტის 3,8-ბის((ბენზიმიდაზოლ-2-ილ)-1H,6H-ინდოლო[7,6-g] ინდოლი (6), 1H-ბმრ სპექტრი, სიგნალების რაოდენობით შეესაბამება სიმეტრიულ სტრუქტურას. სპექტრის ყველაზე უფრო სუსტ უბანში ვლინდება ბენიმიდაზოლისა და ინდოლის NH ჯგუფების პროტონების პიკები სინგლეტების სახით შესაბამისად, 12.98 და 10.07 მნ -ზე. სპექტრში შეინიშნება სინგლეტი 8.4 მნ -ზე, რომელიც მივაკუთნეთ პიროლის ბირთვების ალფა -პროტონებს. ხოლო ნაფთალინისა და ბენზოლის ბირთვების არომატული პროტონები მჟღავნდება 8.30 -8.21მნ უბანში. ამრიგად მიღებული მონაცემები არ ეწინააღმდეგება მოწოდე ბულ ბის(ბენზიმიდაზოლილ)ინდოლოინდოლის 6 სტრუქტურას.
ბენზიმიდაზოლილბენზოპიროლოინდოლის მიღების მიზნით ჩატარებულია ბენზოპიროლოინდოლის დიკარბონმჟავას 4 [5] კონდენსაციის რეაქცია ორთოფენილენდიამინთან POCI3 -ის თანაობისას, რომელიც ერთდროულად ასრულებს კატალიზატორისა და გამხსნელის როლს. რეაქცია ჩატარებულია POCI3 -ის დუღილის ტემპერატურაზე. სარეაქციო არის ტუტით დამუშავების შედეგად გამოყოფილ იქნა რეაქციის პროდუქტი 7 ყავისფერი ფხვნილის სახით, რეაქციის პროდუქტი გასუფთავებულ იქნა ქრომატოგრაფიულ სვეტზე. ბენზოპიროლო ინდოლის დიკარბონმჟავას 4 კონდენსაციის რეაქცია ორთოფენილენდიამინთან ასევე ჩატარებულია პოლიფოსფორის მჟავაში 130 °C-ზე მჟავას ძნელად ხსნადობის გამო. მაგრამ ამ დროს ადგილი ჰქონდა ნაწილობრივ შეფისვას და პროდუქტის გამოსავლიანობის შემცირებას. პროდუქტი გამოლექილი იქნა ცივი წყლით.
გადაღებულ იქნა მიღებული პროდუქტის 7 ი.წ. -სპექტრი. მიღებული ნაერთის სპექტრში ქრება კარბონილის ჯგუფის მახასიათებელი შთანთქმის ზოლი (1683.9) და ვლინდება გაფართოებული ზოლი NH-ების უბანში 3438 სმ -1. ასევე, იკვეთება მცირე ინტენსივობის ზოლი 1797 სმ -1 და დიდი ინტენსივობის გაფართოებული ზოლი 1538 -1357 სმ -1 უბანში.
ნაერთის 7 უ.ი. სპექტრის შედარებისას საწყისი დიკარბონმჟავას სპექტრთან შეინიშნება შთანთქმის მაქსიმუმების ბატოქრომული გადანაცვლება და გრძელტალღიან უბანში. მჟღავნდება ახალი მაქსიმუმები, რაც მოსალოდნელი სტრუქტურიდან შეუღლების ჯაჭვის დაგრძელების დამადასტურებელია.
ნაერთის 7 პროტონულ - მაგნიტური რეზონანსის სპექტრში სიგნალების რაოდენობა შეესაბამება სიმეტრიულ სტრუქტურას. სპექტრის ყველაზე სუსტ ველში ფიქსირდება იმიდაზოლისა (1’-H) და პიროლის ბირთვების (1-H, 10-H)-NH პროტონების სიგნალები შესაბამისად 11.75 და 10.21 მნ უბანში. სინგლეტური სიგნალის სახით ვლინდება პიროლის ბირთვის β პროტონები (3-H, 8-H) 6.87 მნ -ზე. აგრეთვე, სპექტრში გვხვდება ბენზიმიდაზოლის ბენზოლის ბირთვისა (4’-H, 5’-H, 6’-H, 7’-H) და ბენზოპიროლოინდოლის ბენზოლის ბირთვის (4-H, 5-H, 6-H, 7-H) დუბლეტური და დუბლეტ -დუბლეტური სიგნალები 7.54 -7.83 და 6.21 -6.54მნ ინტერვალებში, რომელთა ცალსახა მიკუთვნება გაძნელებულია. როგორც სპექტრიდან ჩანს, მოლეკულის სიმეტრიული აღნაგობის გამო მოლეკულის წარმოსახვითი ნახევრის პროტონების სიგნალები ემთხვევა მეორე ნახევრის სიგნალებს.
ექსპერიმენტული ნაწილი
რეაქციის მსვლელობისა და ნაერთის სისუფთავის კონტროლს ახდენენ სილიკაგელის ფირფიტებზე silufol-254. ნაერთთა ქრომატოგრაფირების დროს ადსორბენტად გამოყენებულია სილიკაგელი ნაწილაკების ზომით 100/250მკმ. ინფრაწითელი სპექტრები გადაღებულია ინფრაწითელი სპექტრომეტრით Varian 660 FT-IR spectrometer, დიაპაზონი: 400-4000 სმ -1 , KBr -ის ტაბლეტებში.
ულტრაიისფერი სპექტრები გადაღებულია ხელსაწყოზე Agilent 8453-UV-VIS (ტალღის სიგრძე: 190-1100 ნმ). 1H-ბმრ სპექტრები გადაღებულია სპექტრომეტრზე Bruker AM 400 (400 მგჰც) DMSO-d6, შინაგანი სტანდარტი TMS.
3(ბენზიმიდაზოლ-2-ილ) -1H,6H-ინდოლო[7,6-g]ინდოლი(5)
მეთოდი ა: 3 -ფორმილ -1H,6H-ინდოლო[7,6-g]ინდოლის კონდენსაცია ო -ფენილენდიამინთან ძმარმჟავას არეში. 0.108 გ (1 მმოლი) ო -ფენილენდიამინს ხსნიან 5 მლ ყინულოვან ძმარმჟავაში, თანდათან უმატებენ 0.234 გ (1 მმოლი) მონოალდეჰიდის სუსპენზიას 15 მლ ძმარმჟავაში და აცხელებენ. 70 °C-ზე ალდეჰიდი მთლიანად იხსნება. სარეაქციო არეს აცხელებენ 80 -85 °C-ზე 3სთ -ის განმავლობაში. სარეაქციო არეს აყოვნებენ ერთი ღამე. მიღებულ ხსნარს გაცივების პირობებში ამუშავებენ 10% -იანი ტუტის ხსნარით. pH 14 -ზე ილექება მუქი ფერის ნალექი. ფილტრავენ, რეცხავენ წყლით ნეიტრალურ რეაქციამდე და აშრობენ. მიიღება მუქი ნაცრისფერი ფხვნილი. ნედლი პროდუქტის გამოსავლიანობა რაოდენობრივია. იგი კარგად იხსნება დიმეთილფორმამიდში და ძნელად ხსნადია დანარჩენ ორგანულ გამხსნელებში. პროდუქტს ასუფთავებენ ქრომატოგრაფიულ სვეტზე. ადსორბენტი -სილიკაგელი, ელუენტები - დასაწყისში სისტემა ბენზოლი -ეთილაცეტატი, 1:1, შემდეგ კი სუფთა ეთილაცეტატი. ქრომატოგრაფირების შემდეგ სუფთა პროდუქტის გამოსავლიანობა შეადგენს 0.114 გ (32%).Tდაშ>277. ი.წ. სპექტრი, ν სმ -1: 3409, 3159, 3062, 1609. უ. ი. სპექტრი, λmax ნმ (D): 210.0 (2.83), 266.0 (1.97), 330.0 (3.22). 1H-ბმრ სპექტრი, (DMSO-D6), δ(მ.ნ.), Ј(ჰც): 12.80 (1H, გს, 1’-H), 11.72 (1H, გს, 1-H), 10.03 (1H, გს, 6-H), 8.22 (2H, დ, J4’,5’=J7’,6’=8.4, 4’-H, 7’-H), 7.99 (2H, დ, J4,5=J9,10= 8.8, 4-H, 9-H), 7.49-7.51(2H, მ, 7-H, 8-H), 7.36 (2H, ს, 2-H), 7.13, 7.12 (2H, დ, Jო=6.0, 5’-H, 6’-H), 6.93 (2H, დ, J5,4=J10,9=8.8, 5-H, 10-H).
მეთოდი ბ: 3 -ფორმილ -1H,6H-ინდოლო[7,6-g]ინდოლის კონდენსაცია ო -ფენილენდიამინთან პოლიფოსფორმჟავას არეში. 0.234 გ (1 მმოლი) 3 -ფორმილ -1H,6H-ინდოლო[7,6-g]ინდოლს ურევენ 0.108გ (1მმოლი) ო -ფენილენდიამინს და უმატებენ მას 2.5გ პოლიფოსფორმჟავას. ურევენ თერმომეტრით და თან აცხელებენ. 75 -80 °C -ზე ალდეჰიდი მთლიანად იხსნება. სარეაქციო არე არის მუქი მოწითალო -ყავისფერი. აცხელებენ სარეაქციო არეს 80 -85 °C -ზე 15 -50 წთ -ის განმავლობაში. აყოვნებენ ოთახის ტემპერატურაზე 3 საათს. სარეაქციო მასა გადმოაქვთ წყლიან ჭიქაში და ანეიტრალებენ KOH-ის 10% -იანი ხსნარით ძლიერ ტუტე რეაქციამდე. იგი თანდათან უფერულდება და ილექება წითელი ფერის ნალექი. აყოვნებენ ღამით. მეორე დღეს ფილტრავენ, რეცხავენ წყლით ნეიტრალურ რეაქციამდე და აშრობენ. მიიღება აგურისფერი -მოყავისფრო ფხვნილი გამოსავლიანობით 0.303 გ (94%). გადაღებულ იქნა ი.წ. სპექტრი.
3,8 -ბის(ბენზიმიდაზოლ-2-ილ) -1H,6H-ინდოლო[7,6-g]ინდოლი (6)
0.131 გ (0.5 მმოლი) 3,8 -დიფორმილინდოლოინდოლის სუსპენზიას სპირტში უმატებენ 0.162 გ (1.5 მმოლი) ო -ფენილენდიამინის ხსნარს სპირტში და 8 მლ ძმარმჟავას. ადუღებენ ერთი საათის განმავლობაში. დიალდეჰიდი მთლიანად იხსნება. ტოვებენ ღამით. მეორე დღეს სპირტის აორთქლების შემდეგ გამოყოფილ ნალექს ფილტრავენ, რეცხავენ მცირე ულუფა სპირტით და აშრობენ. მიიღება აგურისფერ -ყავისფერი ფხვილი გამოსავლიანობით 0.03გ (13.7%). ი.წ. სპექტრი, ν სმ -1: 3420-3360 (გაფ.ზოლი), 2963.1, 1634.5, 1558.7, 1469.7, 1398.3, 1374.8, 1326.4, 1260.4. უ. ი. სპექტრი, λmax ნმ (D): 206 (0.19766), 275.0 (0.55116), 332.0 (0.17038), 350.0 (0.12). 1H-ბმრ სპექტრი, (DMSO-D6), δ(მ.ნ.), Ј(ჰც): 12.98 (გს, NH იმიდაზოლის), 10.07 (გს, NH პიროლის) 8.4 (ს, α-პიროლური), 8.30 - 8.21( Ar პროტონები ნაფთალინისა და ბენზოლის ბირთვში).
3,8 -დიფორმილინდოლოინდოლის ურთიერთქმედება ო -ფენილენდიამინთან POCl3 -ის არეში. 0.131 გ (0.5მმოლი) 3,8 -დიფორმილინდოლოინდოლისა და 0.162გ (1.5მმოლი) ო -ფენილენდიამინის ნარევს უმატებენ 5 მლ POCl3 და აცხელებენ 105 -110 °C-მდე. 3 -წთ -ის შემდეგ უმატებენ 7 მლ დიმეთილფორამიდს ალდეჰიდის გახსნის მიზნით, ისევ აცხელებენ. 1.5 სთ -ის ცხელების (105 -110 °C ) შემდეგ სარეაქციო არე გახდა ერთგვაროვანი ბლანტი მუქი მოწითალო -ყავისფერი ელფერით. რეაქციის დამთავრების შემდეგ ნარევს ასხამენ ცივ წყალში, წარმოქმნიდა გამჭვირვალე წითელი ფერის ხსნარი. ამუშავებენ 10% -იანი ტუტის ხსნარით. გამოყოფილ ნალექს ფილტრავენ, რეცხავენ წყლით ნეიტრალურ რეაქციამდე და აშრობენ. გამოსავლიანობა 0.19 გ (86.8%)
3,8 -დიფორმილინდოლოინდოლის ურთიერთქმედება ო -ფენილენდიამინთან პოლიფოსფორმჟავას არეში. ქიმიური ჭიქაში ურევენ 0.09 გ (0.34 მმოლი) 3,8 -დიფორმილინდოლოინდოლსა და 0.1 გ (1 მმოლი) ო -ფენილენდიამინს, უმატებენ დაახლოებით 2 გ პოლიფოსფორმჟავას, მორევას აწარმოებენ თერმომეტრით და თანდათან აცხელებენ. 700C-ზე ნალექი სრულად გაიხსნა. აცხელებენ 70 °C-ზე ერთი საათის განმავლობაში. სარეაქციო მასა არის მოწითალო -ყავისფერი. გაცივების შემდეგ ამუშავებენ წყლით. გამოყოფილ ნალექს ფილტრავენ, რეცხავენ აშრობენ. მიიღება მოწითალო -ყავისფერი ფხვნილი 0.12 გ (80%) გამოსავლიანობით.
2,9 -ბის(იმიდაზოლ -2-ილ)ბენზო[e]პიროლო[3,2-g]ინდოლი (7)
0.49 გ (1.4 მმოლი) 2,9 -დიკარბოქსიბენზოპიროლოინდოლს უმატებენ 0.36 გ (3 მმოლი) ო -ფენილენდიამინს, 6 მლ დიმეთილფორმამიდს და 15 მლ POCl3. აცხელებენ 4 საათს 105 -110 °C-ზე. ლექავენ NaOH-ის 10 %-იანი ხსნარით (pH 10), ფილტრავენ, რეცხავენ წყლით და აშრობენ. მიიღება ყავისფერი ფხვნილი, გამოსავლიანობა 0.5 გ (68.5%). ი.წ. სპექტრი, ν სმ -1: 3697.9, 3438.8-3428.5 (გაფ.ზოლი), 2918.2, 2850.0, 2514.9, 2360.0, 1797.8, 1538.2(მხ), 1419.7, 1357.0, 1074.2, 872.3. უ. ი. სპექტრი, λmaxნმ (D): 201.0(0.25325), 256.0(9.9037E-2), 303.0(8.7822E-2), 355.0(9.2765E-2), 376.0(0.10100), 398.0(9.2755E-2), 465.0(2.2634E-2), 576.0(1.8130E-2), 581.0(1.8579E-2), 655.0(2.3095E-2). 1H-ბმრ სპექტრი, (DMSO-D6), δ(მ.ნ.), Ј(ჰც): 11.75(გ.ს, NH - იმიდაზ.), 10.21(გ.ს, NH -პიროლური), 6.87 (ს, β-პიროლის), 7.54-7.83 (Ar- 4’-H, 5’-H, 6’-H, 7’-H), 6.21-6.54(Ar 4-H, 5-H, 6-H, 7-H).
ლიტერატურა
- A. Samsoniya, M.V. Trapaidze, I.M. Gverdtsiteli and N.N. Suvorov. “Synthesis of the 1H, 6H-indolo [6,7-g]indole system”. Chemistry of Heterocyclic Compounds, vol. 13, no. 9, 1035, 1977.
- A. Samsoniya, M.V. Trapaidze, L.N. Kurkovskaya, L.G. Tret'yakova, T.K. Efimova, N.N. Suvorov. “Bisindoles. 4. Electrophilic substitution in the 1H,6H-indolo[7,6-g]indole series”. Chemistry of Heterocyclic Compounds, vol. 15, no. 9, 989-994, 1979.
- A. Samsoniya, M.V. Trapaidze, S.V. Dolidze, N.A. Esakiya, N.N. Suvorov, A.M. Kolesnikov and F. A. Mikhailenko. “Bisindoles. 20. Synthesis of 3H,8H-indolo[4,5-e]- and -[5,4-e]indole systems”, Chemistry of Heterocyclic Compounds, vol. 20, no. 3, 283-288, 1984.
- A. Samsoniya, M.V. Trapaidze, L.N. Kurkovskaya, Dzh.A. Kereselidze and N.N. Suvorov. “Bisindoles. 6. Synthesis and investigation of some properties of 2-formyl-, 3-formyl-, and 3,8-diformyl-1H,6H-indolo[7,6-g]indoles”. Chemistry of Heterocyclic Compounds, vol. 16, no. 11, 1139-1146, 1980.
- A. Samsonia, M.V. Trapaidze, N.A. Kuprashvili, A.M. Kolesnikov and N.N. Suvorov. “Pyrroloindoles. 12. Synthesis of 1H, 10H-benzo[e]pyrrolo[3,2-g]indole”, Chemistry of Heterocyclic Compounds. vol. 21, no. 9, 1016-1018, 1985.
- V. Trapaidze, Sh.A. Samsoniya, N.A. Kuprashvili, L.M. Mamaladze and N.N. Suvorov. “Pyrroloindoles. 13. Properties of 1H,10H-benzo[e]-pyrrolo[3,2-g]indole”, Chemistry of Heterocyclic Compounds. vol. 24, no. 5, 489-493, 1988.
- Ш.А.Самсония, Н.А.Эсакия, С.В.Долидзе, М.В.Трапаидзе, З.Ш. Ломтатидзе, Н.Н. Суворов. “Синтез и биологическая активность производных индолоиндолов.” Хим. фарм. журн., no. 9, 40-43, 1991.
- A. Samsoniya, M.V. Trapaidze, N.N. Machaidze, and G. Dürr. Bisindoles. “38. Synthesis of some Derivatives of 1H,6H-indolo[7,6-g]indole”. Chemistry of Heterocyclic Compounds, vol. 38, no. 4, 2002.
- A. Samsoniya, M.V. Trapaidze. “The chemistry of indoloindoles”. Russian Chemical Reviews., vol. 76, no. 4, 313-326
- Sh.A. Samsoniya, M.B. Trapaidze, N.N. Nikoleishvili, A.O. Wesquet, Uli Kazmaier. “Pyrroloindoles. Synthesis of a new spirocyclic systems based on benzo[e]pyrrolo[3,2-g]indole”. International Journal Chemistry of Heterocyclic Compounds, vol. 44, no. 8, 1016-1018 ,2008.
- Sh.A. Samsoniya, M.V. Trapaidze, N.A. Kuprashvili. “Synthesis and antimycrobialactivity1H,10H-benzo[e]pyrrolo[3,2-g]indolederivatives”. Pharmaceutical Chemistry Journal, vol. 43, no. 2, 92-94, 2009
- შ. ა. სამსონია, მ. ვ. ტრაპაიძე, ნ. ლ. თარგამაძე. “ინდოლოინდოლებისა დაპიროლოინდოლების ქიმია”, ივანე ჯავახიშვილის სახელობის თბილისის სახელმწიფო უნივერსიტეტის გამომცემლობა, 2018, გვ.94.
Recieved: 07-04-2021 | Web published: 30-04-2021 | Views 825


