J. Geo. Chem. Soc., 2021, Vol. 1, Issue: 1, pp. 36 - 41
აზოტშემცველი ალიციკლური ნუკლეოფილების α-ჰიდროქსი(ალკილ)ფეროცენებით ალკილირების შესწავლა
1თბილისის სახელმწიფო სამედიცინო უნივერსიტეტი;
2ივ. ჯავახიშვილის სახელობის თბილისის სახელმწიფო უნივერსიტეტი
Abstract.
შესწავლილია აზოტშემცველი ალიციკლური ნუკლეოფილების α-ჰიდროქსი(ალკილ)ფეროცენებით N-ალკილირების რეაქცია ორფაზიან სისტემაში: ორგანული გამხსნელი − დიქლორეთანი, ქლოროფორმი/ქლორმჟავას 70%-იანი წყალხსნარი. α-ფეროცენილალკილირება მიმდინარეობს სტაბილური შუალედური α-ფეროცენილკარბოკატიონის წარმოქმნის სტადიის გავლით. კვლევის შედეგად დასინთეზებული შესაბამისი N-(α-ფეროცენილალკილ)პერქლორატებისა და ამინების შედგენილობა და აღნაგობა დადგენილია იწ, უი, ბირთვულ-მაგნიტური რეზონანსისა (1H, 13C) და მას-სპექტროსკოპული ანალიზის მეთოდებით. მიზნობრივი სინთეზის შედეგად მიღებული, ერთდროულად ფეროცენის და ალიციკლური ფრაგმენტის შემცველი ახალი ბიოლოგიურად აქტიური ნაერთები შემდგომი კვლევებისათვის საინტერესო ობიექტებს წარმოადგენს როგორც თეორიული, მაგალითად, ქიმიურ სტრუქტურასა და ბიოლოგიურ აქტიურობას შორის ურთიერთგავლენის შესწავლის მხრივ, ისე პრაქტიკული თვალსაზრისით, მათ შორის, ფარმაკოლოგიური აქტიურობის ფართო სპექტრის მქონე ახალი სამკურნალო საშუალებების ძიების მიმართულებით.
Keywords: ფეროცენი, ალკილირება, ნუკლეოფილი, ალიციკლური ფრაგმენტი, ბიოლოგიური აქტიურობა
შესავალი
ნუკლეოფილური ნაერთების α-ფეროცენილალკილირების რეაქციის შესწავლისადმი დიდი ინტერესი დაკავშირებულია როგორც α-ფეროცენილკარბოკატიონის აღნაგობისა და რეაქციისუნარიანობის თეორიული ასპექტების დამუშავებასთან, ისე მიღებული ნაერთების გამოყენების ფართო სპექტრით მეცნიერების სხვადასხვა დარგში, მედიცინაში, მრეწველობასა და ტექნიკაში [1-3].Aაღნიშნული რეაქციის სინთეზური შესაძლებლობები, უპირველეს ყოვლისა, განისაზღვრება შესაბამისი მეტალორგანული კომპონენტის ხელმისაწვდომობით და α-ფეროცენილკარბოკატიონების მაღალი მდგრადობით, რაც განპირობებულია კატიონური ცენტრის α-მდგომარეობაში ელექტრონოდონორული ფეროცენილის ფრაგმენტის არსებობით. მნიშვნელოვანია ასევე გამხსნელის როლი. ალკილირებis რეაქცია გაცილებით ეფექტურად და რბილად მიმდინარეობს ორფაზიან სისტემაში: ორგანული გამხსნელი (CH2Cl2, C2H4Cl2, CHCl3, CCl4, C6H6) / მჟავას HX (X = BF4-, ClO4-, I-) წყალხსნარი (45-70%). მსგავსი ორგანული გამხსნელების წყალში მცირე ხსნადობის შედეგად, სარეაქციო არეში იქმნება ორფაზიანი სისტემა, რომლის წყლიან არეში იმყოფება მჟავა, წყალში ხსნადი რეაქციის პროდუქტები (NaX, KX, MgBrX2 და ა.შ.) და მეტალორგანული სუბსტრატის პოლარული ჰიდროქსილის ჯგუფი, სადაც ხელსაყრელი ხდება მისი პროტონირება. მეორე მხრივ, ფაზათა გამყოფ ზედაპირზე არსებული მაღალი მჟავა გარემო (pH -7 ¸ -9) ხელს უწყობს თერმოდინამიკურად მდგრადი ფეროცენილკარბოკატიონის წარმოქმნას in situ აქტიურ ფორმაში. წარმოქმნილი ინტერმედიატის არაპოლარული ნაწილი (ფეროცენის ბირთვი) ორგანულ ფაზაში რჩება, რაც კარბენიუმის ცენტრის შესაბამის ნუკლეოფილურ რეაგენტთან ეფექტურ ურთიერთქმედებას განაპირობებს. აღნიშნული სისტემების გამოყენებისას ალკილირების რეაქციები ოთახის ტემპერატურაზე, რბილ პირობებში მიმდინარეობს, არ მოითხოვს მშრალი გამხსნელებისა და ინერტული ატმოსფეროს გამოყენებას. ამასთან, არსებულ გარემოში პრაქტიკულად გამორიცხულია ფეროცენილკარბოკატიონებისათვის დამახასიათებელი თანამდე გარდაქმნები (გადაჯგუფება, დიმერიზაცია, პოლიმერიზაცია და სხვ.) და ფეროცენილალკილირებული პროდუქტების ჟანგვა.
ჩამოთვლილი უპირატესობები ფეროცენებისა და ნუკლეოფილური რეაგენტების ფართოდ გამოყენების, ასევე გამოსავლიანობის გაზრდისა და მაღალი სისუფთავის მქონე პროდუქტების მიღების საშუალებას იძლევა. ამასთან, α-ფეროცენილალკილირება ისეთი ნაერთების სინთეზის შესაძლებლობას იძლევა, რომელთა მიღებაც სხვა მეთოდებით შეუძლებელია.
შედეგების განხილვა
წარმოდგენილი კვლევის მიზანია ფეროცენისა და ადამანტანის ალიციკლური ბირთვების ერთდროულად შემცველი ახალი ბიოლოგიურად¬აქტიური ნაერთების მიზნობრივი სინთეზი, რომელთა ერთ მოლეკულაში გაერთიანება საინტერესოა ქიმიურ სტრუქტურასა და ფარმაკოლოგიურ აქტიურობას შორის ურთიერთგავლენის შესწავლის მხრივ. ნაჩვენებია, რომ ორგანული ნაერთების მოლეკულებში ალიციკლური სტრუქტურების შეყვანა ახდენს მათი ბიოლოგიური აქტიურობის მოდიფიკაციას და გაძლიერებას, რაც განპირობებულია სივრცითი ალიციკლური ფრაგმენტის ლიპოფილობით და იმუნოტროპულობით. ასევე დადგენილია, რომ ადამანტანშემცველი ნაერთები მოქმედებს ცენტრალური ნერვული სისტემის ნეირომედიატორულ პროცესებზე [4-6].
მრავალრიცხოვანი გამოკვლევების მიუხედავად, აღნიშნული სისტემები ნაკლებად არის შესწავლილი, ამიტომ ამ მიმართულებით კვლევა პერსპექტიული და საინტერესოა როგორც თეორიული, ისე პრაქტიკული თვალსაზრისით, ვინაიდან ძალზე ფართოა α-ფეროცენილალკილირებული ნაერთების პრაქტიკული გამოყენების სპექტრი, მათ შორისაა მაპლასტიფიცირებელი საშუალებები, ძრავების საწვავის წვის პროცესების რეგულატორები, რეზინის სტაბილიზატორები, მაღალენერგეტიკული ნაერთები, რადიოაქტიური გამოსხივების ინდიკატორები, ხელოვნური სისხლის კომპონენტები, ფარმაკოლოგიური აქტიურობის ფართო სპექტრის მქონე სამკურნალო საშუალებები, მათ შორის ანტიბაქტერიული, ანტიმიკრობული, ანთების, სიმსივნის საწინააღმდეგო და სხვა დანიშნულების სამკურნალო პრეპარატები [7-12].
α-ჰიდროქსი(ალკილ)ფეროცენები ხელსაყრელ და პერსპექტიულ მაალკილირებელ რეაგენტებს წარმოადგენს, გამოირჩევა მაღალი სტაბილურობით ოთახის ტემპერატურაზე, ხოლო ჰიდროქსილის ჯგუფი გარკვეულ პირობებში ადვილად განიცდის ნუკლეოფილურ ჩანაცვლებას. ამგვარად, α-ფეროცენილალკილირების რეაქციისათვის საწყის ფეროცენშემცველ კომპონენტებად შერჩეული იქნა ფეროცენის რიგის სპირტები – ფეროცენილმეთანოლი 1 და α-ფეროცენილეთანოლი 2, რომლებიც მიღებული იქნა ფეროცენკარბონმჟავასა და აცეტილფეროცენის ლითიუმის ალუმოჰიდრიდით აღდგენით მშრალი დიეთილეთერის არეში, 2-4 საათის განმავლობაში ინტენსიური მორევისა და გაცივების (15°C) პირობებში და გამოყოფილი იქნა შეტუტიანებული სარეაქციო ნარევის დიეთილეთერით ექსტრაქციის გზით; რეაქცია მიმდინარეობს საკმაოდ მაღალი (90%) გამოსავლიანობით:
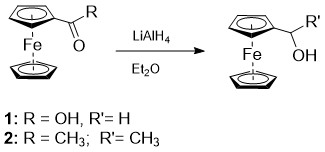
სქემა 1. ფეროცენილმეთანოლისა და α-ფეროცენილეთანოლის სინთეზი
ნუკლეოფილებად შერჩეული ნაერთები − 4-(1-ადამანტილ)ანილინი 3, 4-(1-ადამანტილ)-2-ნიტროანილინი 4, 4-მეთოქსი-2-ნიტროანილინი 5 და 4-(1-ადამანტილოქსი)-2-ნიტროანილინი 6 მიღებული იქნა შესაბამისი აცეტილანილიდების ტუტე ჰიდროლიზით მეთანოლის არეში 0.5-1 საათის განმავლობაში გაცხელების პირობებში:
სადაც, Ad = ადამანტილის რადიკალი / C10H15.
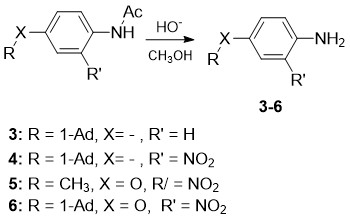
სქემა 2. აზოტშემცველი ნუკლეოფილების სინთეზი
N-(1-ადამანტილ)ბენზილიდენიმინი 7 (სქემა 3) მიღებული იქნა ბენზალდეჰიდისა და ამინოადამანტანის ტოლუოლში დუღილით, ხოლო ადამანტან-1-კარბონმჟავას ჰიდრაზიდი 8 (სქემა 3) − ადამანტან-1-კარბონმჟავა ეთილეთერის და 80%-იანი ჰიდრაზინჰიდრატის დუღილით დიეთილენგლიკოლში 36 საათის განმავლობაში.
კვლევის შემდგომ ეტაპზე განხორციელდა α-ჰიდროქსი(ალკილ)ფეროცენებისა და ნუკლეოფილური სუბსტრატების α-ფეროცენილალკილირების რეაქციის შესწავლა (სქემა 3, 4) ოთახის ტემპერატურაზე ორფაზიან სისტემაში: ორგანული გამხსნელი – დიქლორეთანი, ქლოროფორმი / ქლორმჟავას 70%-იანი წყალხსნარი, ინტენსიური მორევის პირობებში:
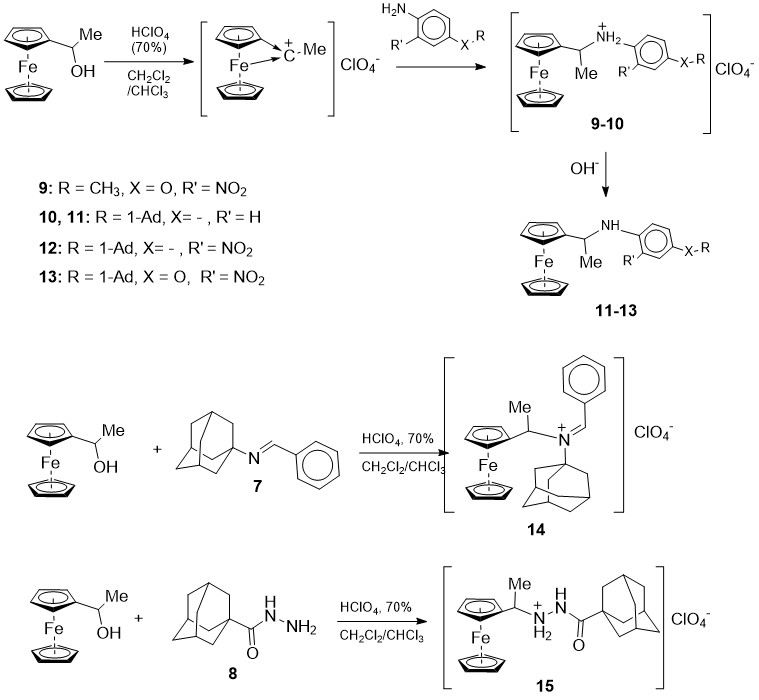
სქემა 3.N-ნუკლეოფილების α-ფეროცენილეთანოლით α-ფეროცენილალკილირება
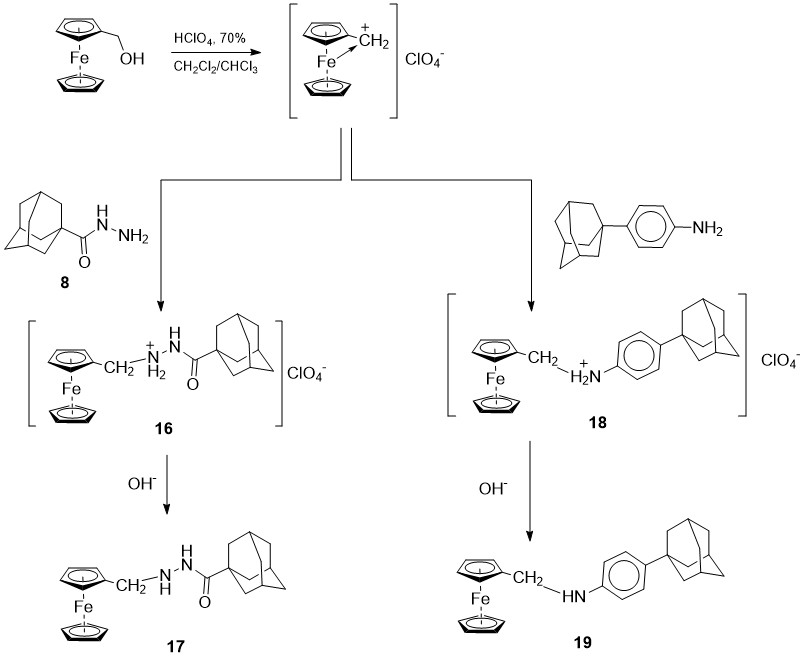
სქემა 4. N-ნუკლეოფილების α-ფეროცენილმეთანოლით α-ფეროცენილალკილირება
α-ფეროცენილალკილირების რეაქცია 4-მეთოქსი-2-ნიტროანილინთან, N-(1-ადამანტილ)ბენზილიდენიმინთან და ადამანტან-1-კარბონმჟავას ჰიდრაზიდთან მიმდინარეობს შესაბამისი მარილების 9, 14-15 წარმოქმნით, ხოლო 4-(1-ადამანტილ)ანილინის, 4-(1-ადამანტილ)-2-ნიტროანილინის და 4-(1-ადამანტილოქსი)-2-ნიტროანილინის შემთხვევაში, სარეაქციო ნარევის ნატრიუმის ჰიდროკარბონატის ნაჯერი წყალხსნარით დამუშავებით მიიღება ასევე შესაბამისი ამინები 11-13. ადამანტან-1-კარბონმჟავას ჰიდრაზიდისა და α-ფეროცენილეთანოლის ექვიმოლური თანაფარდობისას რეაქცია მიმდინარეობს მონო- და ბის-ფეროცენილალკილირების პროდუქტების ნარევის წარმოქმნით. N-α-ფეროცენილეთილ-N/-1-ადამანტოილჰიდრაზინის პერქლორატი 15 მიიღება ადამანტან-1-კარბონმჟავას ჰიდრაზიდისა და α-ფეროცენილეთანოლის ურთიერთქმედებისას 2:1 მოლური თანაფარდობით.
იწ, უი, 1H და 13C ბმრ სპექტრების მონაცემები ადასტურებს დასინთეზებული ნაერთების აგებულებას. მიღებული ნაერთების 9-19 ინფრაწითელ სპექტრებში შეინიშნება შთანთქმის შემდეგი სავალენტო და დეფორმაციული ზოლები: 2923-2908 სმ-1, 2854-2846 სმ-1 (C-H ადამანტანის), ნაერთების 9-13 სპექტრში ფიქსირდება მცირე ინტენსივობის შთანთქმის ზოლები 2970 სმ-1 (CH3), 3098-3030 სმ-1 (C-H არომატული); 1270-1230სმ-1 (C–O–C); ნაერთების 9, 12, 13 სპექტრში ჩანს ნიტრო-ჯგუფისათვის დამახასიათებელი შთანთქმის ზოლი 1558-1566 სმ-1, 1350 სმ-1; ასევე 3600-3200 სმ-1, 2723-2661 (NH2+), ნაერთების 9, 10, 14-16, 18 სპექტრში ჩანს ClO4- ჯგუფისათვის დამახასიათებელი შთანთქმის ზოლი 1100-1110 სმ-1-ზე. ნაერთების 9-19 ულტრაიისფერი სპექტრები ხასიათდება შთანთქმის მაქსიმუმით უბანში, λmax: 246-256 ნმ, 262-283 ნმ, 320 ნმ, ასევე შთანთქმის ფართო ზოლით სპექტრის ხილულ უბანში – 438-450 ნმ.
α-ფეროცენილალკილირების პროდუქტების 9-19 1H ბმრ სპექტრებში NH-ჯგუფის პროტონი იძლევა რეზონანსულ სიგნალს ქიმიური წანაცვლებით 8.15-8.55 ვ.მ.ნ.-ზე დუბლეტის სახით; კვარტეტი ველის 6.63-7.50 მ.ნ.-ზე შეესაბამება არომატულ პროტონებს, დუბლეტი ველის 1.50-1.58 მ.ნ.-ზე შეესაბამება მეთილის ჯგუფის პროტონებს, ხოლო მულტიპლეტური სიგნალი ქიმიური წანაცვლებით 1.75-2.11 ვ.მ.ნ. უბანში – ადამანტილის რადიკალის 15 პროტონს; სპექტრში შეინიშნება მულტიპლეტი ველის 4.31-4.53 მ.ნ.-ზე, რომელიც შეესაბამება CH პროტონებს; ფეროცენის ჩაუნაცვლებელი ბირთვის პროტონები იძლევა სიგნალს ველის 4.14-4.22 მ.ნ.-ზე სინგლეტის სახით, ხოლო ჩანაცვლებული ბირთვის პროტონები 4.20-4.30 ვ.მ.ნ.-ზე მულტიპლეტის სახით.
13C ბმრ სპექტრში შეინიშნება ადამანტილის რადიკალისათვის დამახასიათებელი შთანთქმის სიგნალები ველის 28.8-42.9 მ.ნ. უბანში, CH3-ჯგუფის შესაბამისი სიგნალი ველის 20.74 მ.ნ-ზე და CH-ჯგუფის შესაბამისი სიგნალი ველის 91.80 მ.ნ-ზე, აგრეთვე ფენილის ჯგუფის ნახშირბადის ატომებისათვის დამახასიათებელი შთანთქმის სიგნალები 112.86-145.08 ვ.მ.ნ. უბნებში; ფეროცენის ჩაუნაცვლებელი და ჩანაცვლებული ბირთვის დამახასიათებელი შთანთქმის სიგნალები, შესაბამისად, 68.46 ვ.მ.ნ. და 66.29-67.76 ვ.მ.ნ.-ზე.
დასინთეზებული ნაერთების მას-სპექტრების მონაცემები, კერძოდ, მოლეკულური (M+) და ფრაგმენტული იონების მასები, ასევე შეესაბამება წარმოდგენილ სტრუქტურებს.
კვლევის შედეგად დასინთეზებულია ერთდროულად ფეროცენის და ალიციკლური ფრაგმენტების შემცველი ახალი ნაწარმები: α-ფეროცენილეთილ-4-მეთოქსი-2-ნიტროფენილამინის პერქლორატი, α-ფეროცენილეთილ-4-(1-ადამანტილ)ფენილამინის პერქლორატი, α-ფეროცენილეთილ-4-(1-ადამანტილ)ფენილამინი, α-ფეროცენილეთილ-4-(1-ადამანტილ)-2-ნიტროფენილამინი, α-ფეროცენილეთილ-4-(1-ადამანტილოქსი)-2-ნიტროფენილამინი, N-α-ფეროცენილეთილ-N/-(1-ადამანტილ)ბენზილიდენიმინის პერქლორატი, N-α-ფეროცენილეთილ-N/-(1-ადამანტოილ)ჰიდრაზინის პერქლორატი, N-(1-ადამანტოილ)-N/-ფეროცენილმეთილჰიდრაზინის პერქლორატი, N-(1-ადამანტოილ)-N/-ფეროცენილმეთილჰიდრაზინი, 4-(1-ადამანტილ)-N-ფეროცენილმეთილანილინის პერქლორატი, 4-(1-ადამანტილ)-N-ფეროცენილმეთილანილინი. მიღებული ნაერთები წარმოადგენენ საინტერესო ობიექტებს: მეტალორგანულ სინთეზში − მათი მაღალი რეაქციისუნარიანობის გამო, და ბიოლოგიურ აქტიურობაზე შესწავლისათვის – ფარმაკოლოგიური მოქმედების ფართო სპექტრის მქონე საშუალებების გამოვლენის მიზნით. ამ გზით მიღებული პრეპარატების გამოყენებისას ფეროცენის შემცველობა გარკვეულად შეავსებს რკინის დეფიციტს, ხელს შეუწყობს ორგანიზმის რეზისტენტობის გაძლიერებას და ფარმაკოლოგიური მოქმედების ეფექტურობის ამაღლებას.
ექსპერიმენტული ნაწილი
რეაქციის მსვლელობის, ნაერთთა სისუფთავის კონტროლი და Rf-ის მნიშვნელობების განსაზღვრა განხორციელდა ქრომატოგრაფიული ფირფიტების (Silufol UV-254, Silufol, Alufol) გამოყენებით. ლღობის ტემპერატურა განსაზღვრულია ხელსაწყოზე Meeting Point Meter MPM-HV2, Germany. ინფრაწითელი სპექტრები გადაღებულია სპექტროფოტომეტრზე FT-IR“THERMO NICOLET”, KBr-ის მონოკრისტალში. ულტრაიისფერი სპექტრები გადაღებულია სპექტროფოტომეტრზე UV/VIS, “Varian” CARRY-100 CHCl3-ში. ბირთვულ-მაგნიტური რეზონანსის სპექტრები გადაღებულია სპექტრომეტრებზე BRUKER AM-360 (300 მჰც), UNITY-400 uppkemws 2 (400 მჰც), დეიტერირებულ დიმეთილსულფოქსიდში [(CD3)2SO] და დეიტერირებული ქლოროფორმის ხსნარში [CDCl3], ქიმიური წანაცვლებები გაზომილია შინაგანი სტანდარტის ტეტრამეთილსილანის მიმართ 0.01 ვ.მ.ნ სიზუსტით, ხოლო სპინ-სპინური ურთიერთქმედების კონსტანტა 0.1 ჰც სიზუსტით. მას-სპექტრები გადაღებულია ხელსაწყოზე Ribermag 10-10B და MMX-1321A, ნიმუშის პირდაპირი შეტანით მაიონიზირებელ არეში, მაიონიზირებელი ელექტრონების ენერგია 70 ევ.
α-ფეროცენალკილირების სტანდარტული პროცედურა: 1 მმოლ α-ჰიდროქსი(ალკილ)ფეროცენს უმატებენ 1 მმოლ შესაბამის ნუკლეოფილურ სუბსტრატს ორფაზიან სისტემაში: 1-2 მლ დიქლორმეთანი, 0.3-0.5 მლ ქლოროფორმი, ქლორმჟავას (70 %) წყალხსნარი. რეაქცია მიმდინარეობს ოთახის ტემპერატურაზე ინტენსიური მორევის პირობებში. რეაქციის დასრულების შემდეგ, პერქლორატების შემთხვევაში, სარეაქციო ნარევს უმატებენ 35 მლ მშრალ დიეთილეთერს და აყოვნებენ 10-15 საათი 5-10°C ტემპერატურაზე. წარმოქმნილ ნალექს ფილტრავენ, რეცხავენ მშრალი დიეთილეთერით; ხოლო ამინების მიღების მიზნით, სარეაქციო ნარევს უმატებენ 15 მლ მშრალ დიეთილეთერს, ამუშავებენ ნატრიუმის ჰიდროკარბონატის ნაჯერი წყალხსნარით, ორგანულ ფაზას რეცხავენ ნეიტრალურ რეაქციამდე, აშრობენ და აცილებენ გამხსნელს.
N-(α-ფეროცენილალკილ)პერქლორატები და ამინები:
α-ფეროცენილეთილ-4-მეთოქსი-2-ნიტროფენილამინის პერქლორატი 9: 76%, Tლღ. 123-125°C (დიეთილეთერი), Rf 0.84 (ჰექსანი/დიეთილეთერი 1:2), იწ, ν, სმ-1, KBr: 3355.7 (NH); 3093.4, 3050 (CH, არომ.); 2970 (C-CH3); 2908.3, 2846.6 (CH, Ad); 1635.4, 1519.7 (N-H, C-N); 1566,1350 (C-NO2); 1211, 1134 (C-O-C); 1107 (ClO4-), 1003, 817.7 [CH, Fc; Fc − Fe(η5-C5H4)2];
α-ფეროცენილეთილ-4-(1-ადამანტილ)ფენილამინის პერქლორატი 10: 78.1%, Tლღ. 112-113°C (ეთანოლი), Rf 0.92 (ჰექსანი/დიეთილეთერი 1:2), UV/VISlmax, ნმ, (e): 256 (4.71), 262 (4.76), 440 (0.14); იწ, ν, სმ-1, KBr: 3386.6 (NH); 3093.4, 3054.8 (CH, არომ.); 2970 (C-CH3); 2908.3, 2846.6 (CH, Ad); 1612, 1512, 1188 (N-H, C-N); 1103 (ClO4-), 1002.85, 810 (CH, Fc);
α-ფეროცენილეთილ-4-(1-ადამანტილ)ფენილამინი 11: 68.2%, Tლღ. 135°C (იშლება), Rf 0.81 (ჰექსანი/ დიეთილეთერი 1:2), UV/VISlmax, ნმ, (e): 254 (4.91), 263 (4.95), 438 (0.21); იწ, ν, სმ-1, KBr: 3355.7 (NH); 3093.4, 3054.8 (CH, არომ.); 2970 (C-CH3); 2908.3, 2846.6 (CH, Ad); 1612.3, 1512, 1188 (N-H, C-N); 1103, 1002.85, 810 (CH, Fc);
α-ფეროცენილეთილ-4-(1-ადამანტილ)-2-ნიტროფენილამინი 12: 95.2%, Tლღ. 172-173°C (დიეთილეთერი), Rf 0.88 (ჰექსანი/დიეთილეთერი 1:2), იწ, ν, სმ-1, KBr: 3355 (NH); 3085.7, 3050 (CH, არომ.); 2970 (C-CH3); 2908, 2846 (CH, Ad); 1626, 1519, 1188 (N-H, C-N); 1558, 1350 (C-NO2); 1003, 810 (CH, Fc);
α-ფეროცენილეთილ-4-(1-ადამანტილოქსი)-2-ნიტროფენილამინი 13: 80%, Tლღ. 71-72°C (ეთანოლი), Rf 0.94 (ჰექსანი/დიეთილეთერი 1:2), იწ, ν, სმ-1, KBr: 3355.7 (NH); 3093.41, 3050 (CH, არომ.); 2970 (C-CH3); 2923.7, 2854.3 (CH, Ad); 1735.7, 1542.8 (N-H, C-N); 1573.7,1373 (C-NO2); 1280, 1164 (C-O-C); 1003, 817.7 (CH, Fc);
N-α-ფეროცენილეთილ-N/-(1-ადამანტილ)ბენზილიდენიმინის პერქლორატი 14: 24%, Tლღ. 71-72°C (ეთანოლი), Rf 0.64 (ჰექსანი/დიეთილეთერი 1:2), UV/VISlmax, ნმ, (e): 246 (1.032), 320 (0.15), 450 (0.2); იწ, ν, სმ-1, KBr: 3309 (NH); 3093, 3054 (CH, არომ.); 2970 (C-CH3); 2908, 2854 (CH, Ad); 1640 (C=N); 1110 (ClO4-), 1003, 870, 840 (CH, Fc);
N-α-ფეროცენილეთილ-N/-(1-ადამანტოილ)ჰიდრაზინის პერქლორატი 15: 50.2%, Tლღ. 160-162°C, Rf 0.34 (ჰექსანი/დიეთილეთერი 1:2), UV/VISlmax, ნმ, (e): 252 (3.84), 439 (0.14); იწ, ν, სმ-1, KBr: 3309 (NH); 3093 (CH, არომ.); 2970 (C-CH3); 2908, 2854 (CH, Ad); 1627, 1504 (N-H, C-N); 1110 (ClO4-), 1018.2, 817 (CH, Fc);
N-(1-ადამანტოილ)-N/-ფეროცენილმეთილჰიდრაზინის პერქლორატი 16: 33.3%, Tლღ. 177°C, Rf 0.72 (მეთანოლი/ქლოროფორმი 1:1), იწ, ν, სმ-1, KBr: 3600-2700, 3263 (NH2+); 3101, 3017 (CH, არომ.); 1689 (C=O); 1110 (ClO4-); 1002.8 (CH, Fc);
N-(1-ადამანტოილ)-N/-ფეროცენილმეთილჰიდრაზინი 17: 3.7%, Tლღ. 170-172°C, Rf 0.45 (მეთანოლი/ ქლოროფორმი 1:1), UV/VISlmax, ნმ, (e): 267 (3.129), 440 (0.166); იწ, ν, სმ-1, KBr: 3300-3200, 3294 (NH); 3093 (CH, არომ.); 1650.8 (C=O); 1003, 810 (CH, Fc);
4-(1-ადამანტილ)-N-ფეროცენილმეთილანილინის პერქლორატი 18: 4.5%, Tლღ. 185-187°C, Rf 0.65 (მეთანოლი/ ქლოროფორმი 1:1), იწ, ν, სმ-1, KBr: 3200-2600, 2723, 2661 (NH2+); 3085.7, 3028 (C-H, არომ.); 2908.7, 2846.5 (C-H, Ad); 1612.3, 1519 (C-N); 1103 (ClO4-); 1002.8, 910, 802 (CH, Fc);
4-(1-ადამანტილ)-N-ფეროცენილმეთილანილინი 19: მოწითალო ზეთისებრი მასა, Rf 0.39 (მეთანოლი/ქლოროფორმი 1:1), UV/VISlmax, ნმ, (e): 283 (4.253), 443 (0.27); იწ, ν, სმ-1, KBr: 3409.7 (NH); 3085.7, 3030 (CH, არომ.); 1612.3, 1512, 1180 (C-N); 1003, 910, 804 (CH, Fc).
ლიტერატურა
[1] V. Boev, L. Snegur, V. Babin, Yu. Nekrasov, „α-Metallocenylalkylation,“ Russ. Chem. Rev., vol. 66 (7), pp. 613-636, 1997.
[2] L. Snegur, M. Lyapunova e.a., “Nitro-imidazoles in ferrocenyl alkylation reaction. Synthesis, enantiomeric resolution and in vitro and in vivo bioeffects,” J. Organomet. Chem., vol. 871, pp. 10-20, 2018.
[3] D. Michael P. Mingos and Robert H. Crabtree, Ed., Comprehensive Organometallic Chemistry III from Fundamentals to Applications. Elsevier Science, 2007.
[4] N. Artsimovich, T. Galushina, T. Fadeeva, “Adamantanes – Medicines of XXI Century,” Intern. J. Immunorehabilitation, 2 (54), 2000.ines alushina T. ,1997.zantiis imperiis dedaqalaqimwifeo"omavlebi arian: "elis Sewyoba monastrebisadmi, romle
[5] I. Morozov, V. Petrov, S. Sergeeva, Ed., Pharmacology of Adamantanes, Volg. Med. Academy Press, 2001.
[6] A.A. El-Emam, K.A. Alrashood, M.A. Al-Omar, A.S. Al-Tamimi, “Synthesis and antimicrobial activity of N′-heteroarylidene-1-adamantylcarbohydrazides and (±)-2-(1-adamantyl)-4-acetyl-5-5-(4-substituted pheyl-3-isoxazolyl)-1,3,4-oxadiazolines,” Molecules, vol. 17, pp. 3475–3483, 2012.
[7] M.A. Shvekhgeimer, “Heterylferrocenes. Synthesis and use,” Russ. Chem. Rev., vol. 65, pp. 43-83, 1996.
[8] L. Peiyi, I.J. Scowen, J.E. Davies. A.M. Halcrow, “Coordination chemistry of bis(ferrocenylcarbaldimine) Schiff Bases,” J. Chem. Soc., vol. 22, Dalton Trans., pp. 3791-3800,1998.
[9] N. Motohashi, R. Meyer, S.R. Golapudi, K.R. Bhattiprolu, ”Synthesis and Activity of Potential antitumor ferrocenes,” J. Organomet. Chem., vol. 398, pp. 205-217, 1990.
[10] D. Scutaru, I. Mazilu, M. Vâtâ, L. Tâtaru, A.Vlase, T.l ixandru, Cr. Simionescu, ”Heterodisubstituted derivatives of ferrocene. Ferrocene-containing penicillins and cephalosporins,” J. Organomet. Chem., vol. 401, pp. 87-90, 1991.
[11] E. Rogatkina, A. Ivanova, A. Rodionov, A. Simenel, “Ferrocenylalkylation of 2-mercaptobenzoxazoles,” Russ. Chem. Bull., vol. 65 (12), pp. 2868-2872, 2016.
[12] E.V. Shevaldina, A.D. Shagina, A.B. Ponomaryov, S.K. Moiseev, „One-pot α-ferrocenylalkylation of amines and alcohols with α-ferrocenyl substituted alcohols under acid-free conditions,“ J. Organomet. Chem., vol. 880, pp. 29-38, 2019.
Recieved: 08-05-2021 | Web published: 08-05-2021 | Views 563


