J. Geo. Chem. Soc., 2021, Vol. 1, Issue: 1, pp. 9 - 16
2-ფენილინდოლების სინთეზის უახლესი ასპექტები (მიმოხილვითი სტატია)
ივ. ჯავახიშვილის სახელობის თბილისის სახელმწიფო უნივერსიტეტი
armaz.tsutskiridze9062@ens.tsu.edu.ge
Abstract. 2-ფენილინდოლის ბუნებრივი და სინთეზური წარმოებულები ხასიათდებიან საინტერესო ბიოლოგიური აქტიურობით. ბევრი მათგანი წარმატებით გამოიყენება სამედიცინო პრაქტიკაში სხვადასხვა დანიშნულების პრეპარატების სახით. აქედან გამომდინარე, დიდი მნიშვნელობა ენიჭება მისი ახალი წარმოებულების სინთეზს, რისთვისაც შემუშავებულ იქნა კლასიკურ რეაქციებზე დაფუძნებული მრავალი მეთოდი, რომლებიც განხილულია რამდენიმე მიმოხილვაში, უკანასკნელი გამოქვეყნდა 2004 წელს. მომდევნო პერიოდში 2-ფენილინდოლების სფეროს მიეძღვნა ბევრი მაღალციტირებადი პუბლიკაცია, რომლებშიც აღწერილია ბოლო დროს ძალზედ პოპულარული და ეფექტური გარდამავალ მეტალთა კომპლექსებით კატალიზირებად რეაქციებზე დაფუძნებული სინთეზები. ამ სინთეზების საფუძველზე შემუშავდა ინდოლის ბირთვის სინთეზის მრავალმხრივ მოხერხებული თანამედროვე მეთოდები. წინამდებარე პუბლიკაციის ძირითადი ინტერესი სწორედ ამ მეთოდების მიმოხილვაა. სტატიაში კრიტიკულად არის განხილული აღწერილი მეთოდების თავისებურებანი. ნაჩვენებია, რომ მეტალორგანულმა კატალიზმა, სტექიომეტრულმა მეტალორგანულმა სინთეზმა და ფოტოკატალიზმა მნიშვნელოვნად გაამარტივა ორგანულ ნაერთთა სინთეზი და ფუნქციონალიზაცია. აღსანიშნავია, რომ გარდაქმნები ხშირად არ საჭიროებენ მრავალი ტიპის ფუნქციური ჯგუფების დაცვას, ამასთან, რიგ შემთხვევებში გაზრდილია ატომთა ეკონომია. დასაბუთებულია ამ მეთოდების პერსპექტიულობა, მრავალი მნიშვნელოვანი ნაერთთა კლასის, მათ შორის 2-ფენილინდოლების მისაღებად
Keywords: ინდოლი, ციკლიზაცია, 2-არილინდოლები, კატალიზი
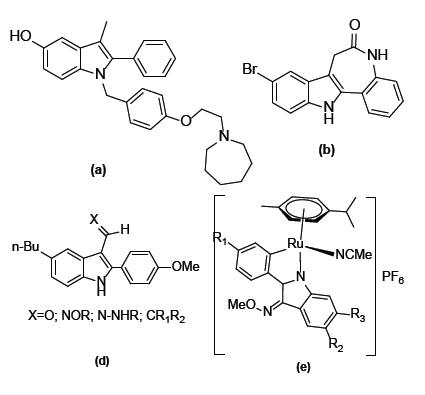
2-ფენილინდოლის მრავალი ბუნებრივი და სინთეზური წარმოებული ხასიათდება საინტერესო ბიოლოგიური აქტიურობით და წარმატებით გამოიყენება სამედიცინო პრაქტიკაში სხვადასხვა დანიშნულების პრეპარატების სახით. ბოლო წლებში დანერგილი ნაერთებიდან აღსანიშნავია: ბაზედოქსიფენი (a) - პოსტკლიმაქსური ოსტეოპოროზის მკურნალობა [1], კენპაულონი (b) კისტოზური ფიბროზის საწინააღმდეგო პრეპარატი [2], (c) ტიპის ნაერთები ხელს უწყობენ სუბგენომური C-ჰეპატიტის ვირუსის რნმ-ის რეპლიკაციის ინჰიბირებას [3], (d) ტიპის ნაერთები ძლიერი ანტისიმსივნური აგენტებია [4,5], მაღალ ანტისიმსივნურ აქტიურობას ავლენენ აგრეთვე ნახევრადსენდვიჩური, მეტალოცენის ტიპის 2-ფენილინდოლები (e) [6].
სურათი 1-ზე ასახულია ბიოლოგიურ სისტემაში 2-ფენილინდოლის ტიპის ანტისიმსივნური აგენტის (f) მოქმედების მოლეკულური მექანიზმი [7]. (f) ნაერთი არომატაზას ინჰიბირებით წარმატებით ებრძვის ჰორმონდამოკიდებულ სიმსივნეს, მას აქვს დაბალი ციტოტოქსიკურობა[7].
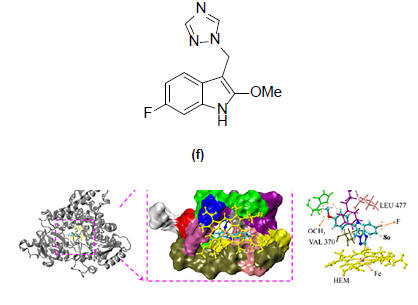
სურათი 1. ბიოლოგიურ სისტემაში 2-ფენილინდოლის ტიპის ანტისიმსივნური აგენტის (f) მოქმედების მოლეკულური მექანიზმი [7].
აღსანიშნავია, რომ 2-ფენილინდოლების ზოგიერთ წარმომადგენელს (g) გააჩნია წამალრეზისტენტულ სიმსივნის უჯრედებთან ბრძოლის უნარი [8].
მიკროორგანიზმებს გააჩნიათ მრავალი წამლის მიმართ რეზისტენტობის (MDR) უნარის გამომუშავების უნივერსალური მექანიზმი, რომლის დახმარებითაც წინააღმდეგობას უწევენ ანტიმიკრობული პრეპარატების ფართო სპექტრს. ჰიდროფობული კატიონები საუკეთესო სუბსტრატებია, რომლებსაც შეუძლიათ თავი აარიდონ ამ თავდაცვით მექანიზმს. ტრანსმემბრანული პოტენციალის ზემოქმედების გამო დადებითად დამუხტული ნაწილაკები გროვდებიან უჯრედში, რაც საფრთხეს უქმნის მიკრობების სიცოცხლეს. ამ ტიპის ჰიდროფობული კატიონის კარგი მაგალითია ძლიერი ანტისეპტიკი ბენზილტრიალკილამონიუმის ქლორიდი.
ალკალოიდი ბერბერინიც მსგავს ნივთიერებებს მიეკუთვნება. ბერბერინის ნაწარმებსაც აღმოაჩნდათ მსგავსი თვისება. ამ ნაერთების მოლეკულებში გაერთიანებულია ანტიმიკრობული პრეპარატის და MDR მექანიზმის ინჰიბიტორის ფრაგმენტები. მაგალითად პრეპარატი SS14 (h) ბერბერინზე 100-ჯერ უფრო აქტიური აღმოჩნდა [9]:
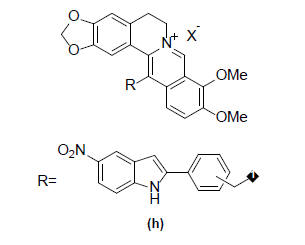
გასული საუკუნის 70-იანი წლებიდან განსაკუთრებული ინტერესი დაიმსახურა ფლუორესცენტულმა ბიომარკერმა - 4’,6-დიამიდინო-2-ფენილინდოლმა (DAPI) [10,11]:
DAPI-სდა მისი წარმოებულებისშესწავლას და გამოყენებას მიეძღვნა მრავალი ორიგინალური გამოკვლევა და განზოგადება, რომელთა განხილვა შეუძლებელია ერთი მიმოხილვის ფარგლებში. ამის გამოჩვენი ინტერესის და წინამდებარე მიმოხილვის ძირითადი მიმართულებაა ინდოლის ბირთვის სინთეზის თანამედროვე მეთოდები. 2004 წელს გამოქვეყნდა მიმოხილვა [12], რომელმაც მოიცვა იმ დროისათვის არსებული თითქმის ყველა მონაცემი. შემდგომ წლებში 2-ფენილინდოლების ახალი წარმოებულების სინთეზების და თვისებების აღწერას მიეძღვნა რამდენიმე ათასი პუბლიკაცია.
2-ფენილინდოლების სინთეზის თანამედროვე მეთოდები
ახალი ათასწლეულის დასაწყისიდან განსაკუთრებით პოპულარული გახდა 2-ფენილინდოლების სინთეზი გარდამავალ მეტალ-კატალიზური რეაქციების დახმარებით. ამ მიმართულებით 2004-2018 წლებში გამოქვეყნდა მრავალი მაღალციტირებადი პუბლიკაცია. სქემა 1-ზეწარმოდგენილი რეაქცია ტანდემური გარდაქმნაა, რომელიც ხორციელდება ერთ სარეაქციო სისტემაში: პირველ საფეხურზე ხდება ო-იოდ-ანილინების კროს-შეუღლება არილაცეტილენებთან (1) და შემდგომ, მიღებული პროდუქტების (2) ინდოლიზაცია [13]:
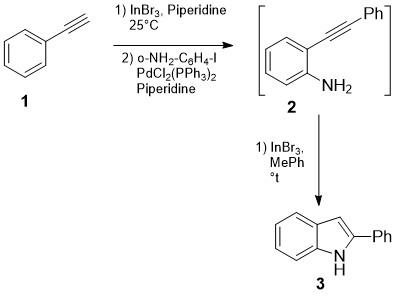
სქემა 1 . ო-იოდ-ანილინებიდან ინდოელების სინთეზი
სქემა 2-ზე წარმოდგენილი მეთოდით მაღალი გამოსავლიანობით მიიღეს 3-ჩანაცვლებული 2-ფენილინდოლები (6) [14]. გარდაქმნის მეორე საფეხური მიმდინარეობსპიროლის ბირთვის შკვრით ტუტე გარემოში რასაც თან ახლავს დესულფონირება და ალკილირება:
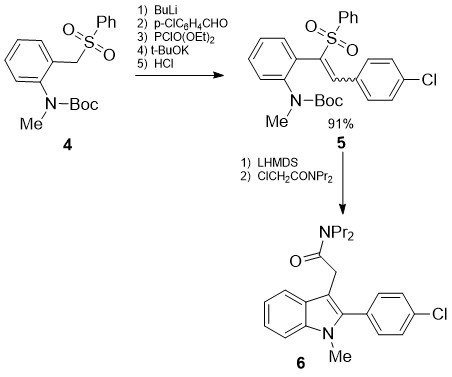
სქემა 2. 3-ჩანაცვლებული 2-ფენილინდოლების სინთეზი
სანდრო კაჩის მიერ შემოთავაზებული მეთოდით (სქემა 3), ო-ალკინილ-ტრიფტორაცეტანილიდების (7) პალადიუმ-კატალიზირებადი კროს-შეუღლებით 1-ბრომალკინებთან წარმოიქმნება 3-ალკილ-2-ფენილინდოლები (8), რომლებიც კარგ ინტერმედიატებს წარმოადგენდნენ 3-აცილწარმოებულების (9) რეგიოსელექციური სინთეზისათვის [15]:
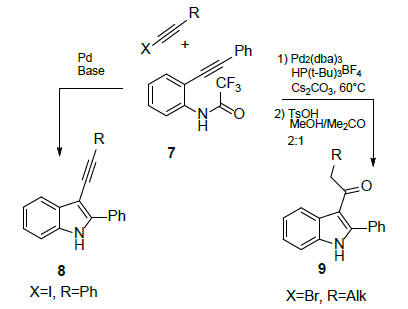
სქემა 3. 3-ალკილ-2-ფენილინდოლების სინთეზი კროს-შეუღლებით
ლაროკის და სხვ. მიერ შემოთავაზებულ იქნა 3-იოდ-2-ფენილინდოლების (12) ძალიან მაღალი გამოსავლიანობით მიღების მეთოდი [16] (სქემა 4). გარდაქმნის საკვანძო ეტაპს წარმოადგენს N,N-დიალკილ-ო-ალკინილანილინების (11) ციკლიზაცია მოლეკულური იოდის თანდასწრებით.
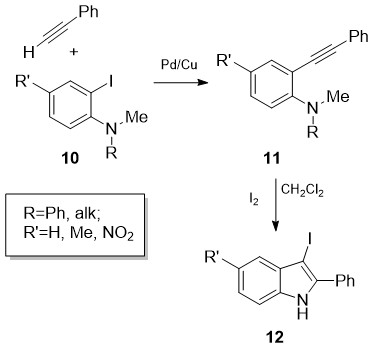
სქემა 4. 3-იოდ-2-ფენილინდოლების სინთეზი
შემუშავებულ იქნა 2-ფენილინდოლების სინთეზის კიდევ ერთი ახალი სტრატეგია [17], რომელიც დაფუძნებულია ვინილური ფოსფატების 13 ურთიერთქმედებაზე არილბორანებთან სუძუკის რეაქციის [18] მიხედვით და მიღებული პროდუქტების ინდოლიზაციაზე შიდამოლეკულური კროს-შეუღლებით (ჰეკის რეაქცია [19]) (სქემა 5).
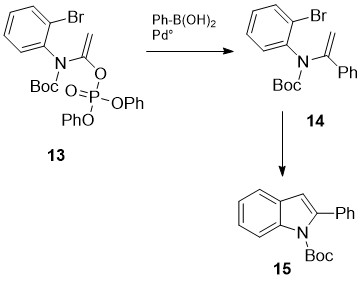
სქემა 5. 2-ფენილინდოლების სინთეზი სუძუკის და ჰეკის რეაქციებით
დ.რ. სტიუარტმა და სხვ. განახორციელეს რუთენიუმ-კატალიზური ჟანგვითი შეუღლების რეაქცია [20]. ამ გზით 3-ჩანაცვლებული-2-ფენილინდოლები 17 მიიღეს N-აცეტილანილინების 16 არილ-ალკილ-აცეტილენებთან ურთიერთქმედების შედეგად. ამ მეთოდში მნიშვნელოვანია, რომ სუბსტრატი არ საჭიროებს ო-ჰალოგენ ჩამნაცვლებელს (სქემა 6).
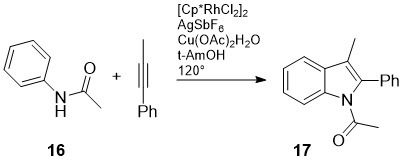
სქემა 6. 3-ჩანაცვლებული-2-ფენილინდოლების სინთეზი რუთენიუმ-კატალიზური ჟანგვითი შეუღლებით
სქემა 7-ზე ნაჩვენებია მარტივი მოხერხებული მეთოდი - დიარილაცეტილენების 17’ ინდოლიზაცია ნიტრო ჯგუფის სელექციური აღდგენით და შემდგომი ციკლიზაციით ოქროს ნანონაწილაკებისა და რკინის (III) ოქსიდის კატალიზური მოქმედებით [21]:
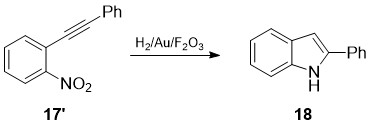
სქემა 7. დიარილაცეტილენების 17’ ინდოლიზაცია ნიტრო ჯგუფის სელექციური აღდგენით
N,N-დიალკილ-ო-იოდ-ანილინები 19 წარმოადგენდნენ ეფექტურ სუბსტრატებს 3-სულფენილ- და 3-სელენილ-2-არილინდოლების 21 მისაღებად (სქემა 8). მე-20 არილალკინილ-ო-ანილინების ინდოლიზაცია მიმდინარეობს ელექტროფილური მიერთების მექანიზმით [22]:
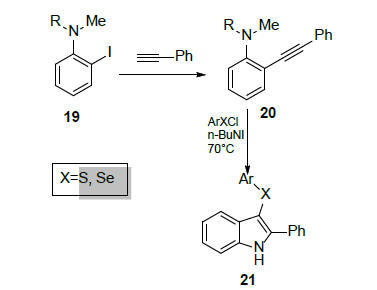
სქემა 8. 3-სულფენილ- და 3-სელენილ-2-არილინდოლების სინთეზი
ლანდმა და სხ. [23] განახორციელეს ჩაუნაცვლებელი (N-დაცული) ინდოლების 22 პირდაპირი არილირება (სქემა 9). ეს არის კროს-შეუღლების ტიპის გარდაქმნა და მიმდინარებს რბილ პირობებში: სუბსტრატზე 22 არილსილოქსანების 23 მოქმედებით მჟავა გარემოში Pd(OAc)2-ის კატალიზური მოქმედებით:
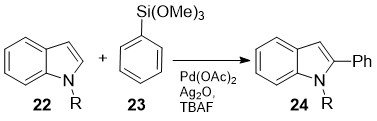
სქემა 9. ჩანაცვლებული ინდოლების პირდაპირი არილირება
იაპონელმა მკვლევარებმა აღწერეს 2-ფენილიდოლ-3-კარბონმჟავების 26 პირდაპირი სინთეზი [24] (სქემა 10). აქ ხდება პირველ საფეხურზე წარმოქმნილი 2-ფენილინდოლის კარბოქსილირება, რასაც ხელს უწყობს ფუძე არე და მაღალი წნევა:
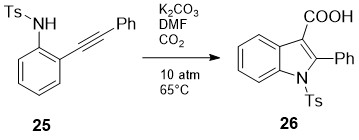
სქემა 10. 2-ფენილიდოლ-3-კარბონმჟავების პირდაპირი სინთეზი
ჩინელმა მკვლევარებმა განახორციელეს ახალი ტიპის მაღალი თერმომდგრადობის პოლიმერის - პოლიტრიაზოლიმიდის 27 სინთეზი [25] (სქემა 11). აღსანიშნავია, რომ 350 °C-ზე გაცხელებისას იგი განიცდის პოლიმერანალოგიურ გარდაქმნას ტრიაზოლების ბირთვების ხარჯზე. მიღებული 2(3)-ფენილინდოლების შემცველი ახალი პოლიმერის 28 თერმომდგრადობა გაცილებით მაღალია საწყის მაკრომოლეკულასთან შედარებით [25].
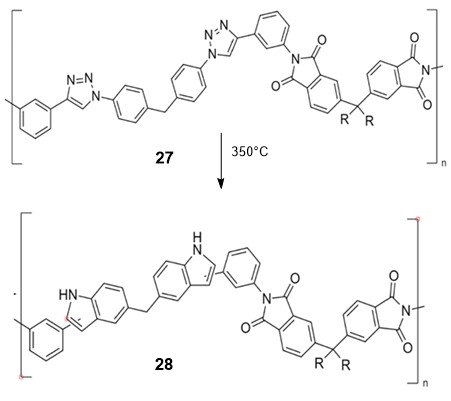
სქემა 11. მაღალი თერმომდგრადობის პოლიმერის სინთეზი
რ. ჟანას და სხვ. [26] მიერ შემოთავაზებულია 2-ფენილინდოლების 31 სინთეზი არილკარბამიდებისა 29 და სტიროლების 30 ურთიერთქმედებით ბენზქინონის (BQ) და Pd(OAc)2-ის თანდასწრებით. პროცესი იწყება პალადიუმ (II)-ის რეგიოსელექციური ჩანერგვით ო-C-H ბმაში, რასაც ხელს უწყობს მეზობელი კარბამიდული ჯგუფი, შემდეგ ხდება სტიროლური ორმაგი ბმის რეგიოსელექციური შეღწევა მეტალორგანულ ბმაში და ბეტა ჰიდრიდული ელიმინირებით მიმდინარე ორმაგი ბმის კვლავ წარმოქმნა, ბოლო საფეხურს წარმოადგენს აზა-ვაკერისეული ციკლიზაციის და ბეტა ჰიდრიდული ელიმინირების ტანდემური ინდოლიზაციის პროცესი.
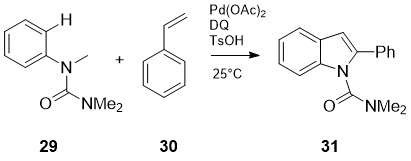
სქემა 12. 2-ფენილინდოლების სინთეზი არილკარბამიდებისა და სტიროლებიდან
შემუშავებულია ო-არილალკინილანილინებიდან 32 ასიმეტრიული 2-ფენილინდოლ-3-დიარილმეთანების 34 მიღების ორიგინალური მეთოდი -პალადიუმ კატალიზური დომინო-პროცესი [27]. პირველი საფეხური მოიცავს ო-ალკინილანილინების 32 ციკლიზაციას და შემდგომ, მიღებული ინტერმედიატების – 2-არილინდოლების – ურთიერთქმედებას ელექტროფილურ ქინოიდურ სისტემებთან 33. პროდუქტები წარმოიქმნება მაღალი გამოსავლიანობებით, რიგ შემთხვევაში მიღწეულია ატომთა 100%-იანი ეკონომია, რაც რეაქციას მიმზიდველს ხდის მწვანე ქიმიის თვალსაზრისით (სქემა 13):
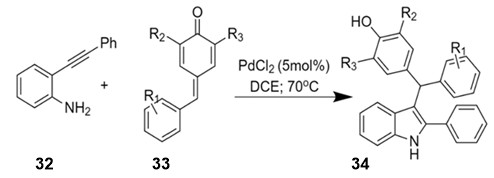
სქემა 13. ასიმეტრიული 2-ფენილინდოლ-3-დიარილმეთანების სინთეზი
სქემაზე 14 ნაჩვენებია 2-ფენილინდოლების 36 სწრაფი და ეფექტური სინთეზის მეთოდი [28], შესაბამის N-Ts-2-ალკენილანილინურ სუბსტრატებზე 35 N-იოდსუქცინიმიდის მოქმედებით. გარდაქმნა მოიცავს რბილ პირობებში ახალი C-N ბმის ფორმირების და არომატიზაციის თანმიმდევრულ პროცესებს:
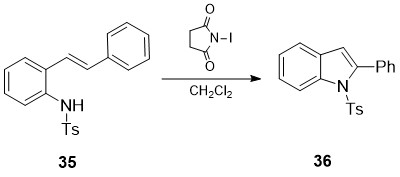
სქემა 14. 2-ფენილინდოლების 36 სწრაფი და ეფექტური სინთეზის მეთოდი
აღწერილია 3-ჩანაცვლებული-2-ფენილინდოლების 39 ეფექტური სინთეზი ო-ალკინილ-N-ბენზილანილინების 37 ურთიერთქმედებით ციკლოპროპანის ნაწარმებთან 38 AgSbF6-ის თანდასწრებით [29]. ვერცხლის კატიონი იწვევს როგორც ციკლოპროპანის ციკლის გახსნისინიცირებას, ასევე უშუალოდ ურთიერთქმედებს სამმაგ ბმასთან (სქემა 15):
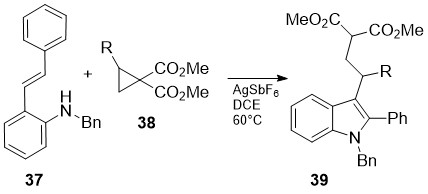
სქემა 15. 3-ჩანაცვლებული-2-ფენილინდოლების ეფექტური სინთეზის მეთოდი
მ. ტედერსმა და სხვ. [30] შეიმუშავეს ჩანაცვლებული-2-ფენილინდოლების 41 სინთეზის მეთოდი რბილ პირობებში (სქემა 16). მეთოდი დაფუძნებულია N-ბენზოილბენზოტრიაზოლების 40 ფოტოინიცირებულ გარდაქმნაზე. ეს ნაერთები ლურჯი სინათლით დასხივებისას ირიდიუმის კომპლექსური ნაერთების თანაკატალიზის პირობებში ადვილად განიცდიან დეაზოტირებას. ამ დროს წარმოქმნილი ინტერმედიატები ტერმინალურ ფენილაცეტილენებთან ურთიერთქმედებით და შემდგომი ინდოლიზაციით მაღალი გამოსავლიანობით იძლევიან N-ბენზოილ-2-ფენილინდოლებს 41:
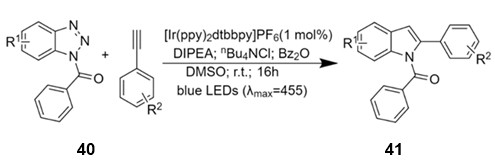
სქემა 16. ჩანაცვლებული-2-ფენილინდოლების 41 სინთეზის მეთოდი მ. ტედერსის მიხედვით [30].
ამავე შრომაში [30] შემოთავაზებულია ამ გარდაქმნების მექანიზმი (სქემა 17):
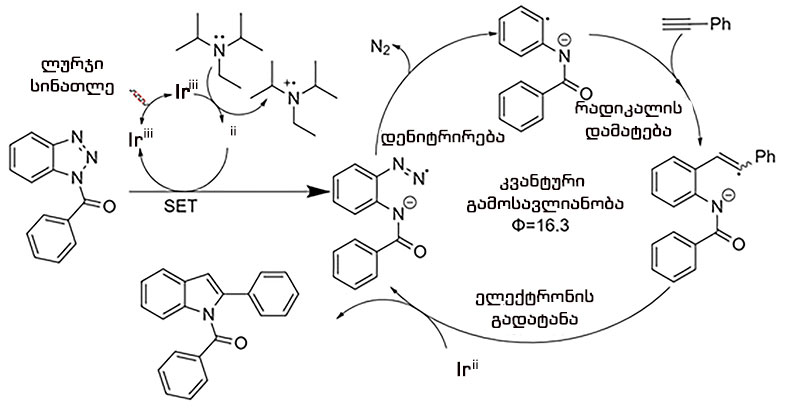
სქემა 17. ანაცვლებული-2-ფენილინდოლების 41 სინთეზის მექანიზმი
აღწერილია 2- ფენილინდოლის მიღების ორიგინალური მეთოდი [31] არილბორმჟავების PhB(OH)2 მონაწილეობით, რომლებიც ბიდენტანტური ლიგანდის და პალადიუმ(II)-ის მარილის კატალიზური რაოდენობის თანდასწრებით უერთდებიან 2-(2-ამინოარილ)აცეტონიტრილების 42 ციან-ჯგუფს, მიღებული ინტერმედიატების ციკლიზაციით მიიღება ინდოლის ბირთვი. ეს მეთოდი ჩანაცვლებული 2-ფენილინდოლების სინთეზის შესაძლებლობასაც იძლევა (სქემა 18):
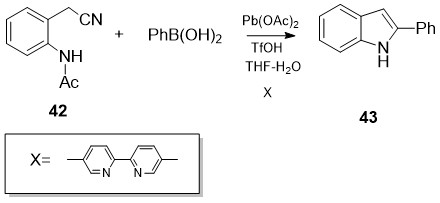
სქემა 18. 2- ფენილინდოლის მიღების მეთოდი
სინთეზირებულია ახალი ბისინდოლური სისტემები - π-შეუღლებული 1,2-ბის(2-არილ-1H-ინდოლ-3-ილ)ეთინები 44 [32]. აღსანიშნავია რომ ბისინდოლური 44 წარმოებულების სინთეზი (სქემა 19) მიმდინარეობს ორმაგი იზოციანიდ-აცეტილენურიციკლიზაციით. პროცესი იწყება იზოციანიდურ ნახშირბადატომებთან გრინიარის რეაქტივის მიერთებით, რასაც მოსდევს ბისინდოლიზაცია.
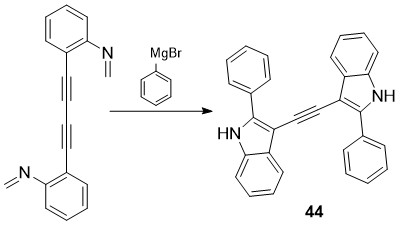
სქემა 19. ბისინდოლური 44 წარმოებულების სინთეზი
სქემა 20-ზე ნაჩვენებია 2-არილინდოლების 47 სინთეზი N-ჰეტარილანილინებიზე 45 არომატული ვინილაზიდების 46 პალადიუმ-კატალიზური მოქმედებით [33]. აღსანიშნავია ამ გარდაქმნების მაღალი რეგიოსელექციურობა:
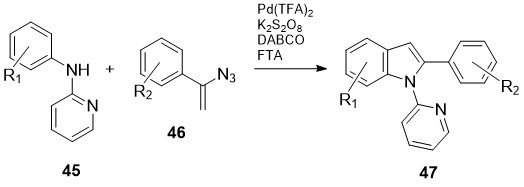
სქემა 20. 2-არილინდოლების 47 სინთეზი
სქემა 21-ზე ნაჩვენებია ტიმოთი ფ. ჯემისონის სამეცნიერო ჯგუფის მიერ შემუშავებული რბილ პირობებში იაფი სპილენძ-კატალიზური რეაქციით ჩანაცვლებული 2-ფენილინდოლების 50 მიღება 2-ალკენილ-არილიზოციანიდების 48 ურთიერთქმედებით არილ-ბორმჟავებთან 49 [34]:
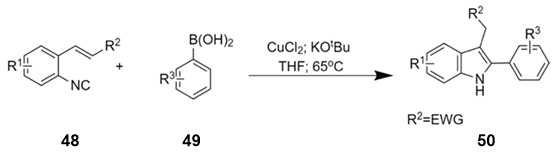
სქემა 21. სპილენძით კატალიზებული 2-ფენილინდოლების სინთეზი
დასკვნა
განხილული მასალის ანალიზი საშუალებას იძლევა ითქვას, რომ უკანასკნელი ორიათწლეულის მანძილზე გარდამავალ-მეტალ-კატალიზურმა გარდაქმნებმა მნიშვნელოვანი წვლილი შეიტანეს (ხშირ შემთხვევაში მრავალფუნქციური) 2-ფენილინდოლების წარმოებულების სინთეზების გამარტივების მიმართულებით. ახალი მეთოდებით შესაძლებელი გახდა 2-არილინდოლების პირდაპირი სინთეზი ადვილად ხელმისაწვდომ სუბსტრატებზე დაყრდნობით, რაც უმრავლეს შემთხვევაში შეუძლებელი იყო კლასიკური მეთოდების გამოყენებით. განხილული გარდაქმნები მიზნობრივი პროდუქტების მაღალი გამოსავლიანობით მიღების შესაძლებლობას იძლევა. აღსანიშნავია ისიც, რომ თანმხლები პროდუქტები წარმოიქმნება უმნიშვნელო რაოდენობით. სამართლიანი იქნება ვთქვათ, რომ ზემოთ აღწერილი მეთოდები პერსპექტიულია და დიდად შეუწყობს ხელს 2-ფენილინდოლის, 2-არილინდოლების და ზოგადად ინდოლის ქიმიის განვითარებას.
ლიტერატურა
- Lal S, Snape TJ. “2-Arylindoles: a privileged molecular scaffold with potent, broad-rangingpharmacologicalactivity“. Curr Med Chem,Vol. 28, No. 19, pp. 4828-37, 2012.
- Tolle N, Kunick C. “Paullones as inhibitors of protein kinases”. Curr Top Med Chem, 11, No. 11, pp. 1320-32, 2011.
- Steven Harper, Salvatore Avolio, Barbara Pacini, et al. “Potent Inhibitors of Subgenomic Hepatitis C Virus RNA Replication through Optimization of Indole-N-Acetamide Allosteric Inhibitors of the Viral NS5B Polymerase”. Journal of Medicinal Chemistry, Vol.48,No.14, pp.4547-4557, 2005.
- Kaufmann D, Pojarová M, Vogel S, Liebl R, Gastpar R, Gross D, Nishino T, Pfaller T, von Angerer E. “Antimitotic activities of 2-phenylindole-3-carbaldehydes in human breast cancer cells”. Bioorg Med Chem,Vol. 15, No. 15, pp. 5122-36, 2007.
- Si Yan Liao, Li Qian, Ti Fang Miao, Hai Liang Lu, Kang Cheng Zheng.“CoMFA and docking studies of 2-phenylindole derivatives with anticancer activity”. Volume 44, Issue 7, Pages 2822-2827, 2009.
- LluísBelsa, Concepción López, Asensio González, MercèFont-Bardı́a, Teresa Calvet, Carmen Calvis, and Ramon Messeguer. “Neutral and Ionic Cycloruthenated 2-Phenylindoles as Cytotoxic Agents”. Organometallics,Vol. 32,No. 24, pp. 7264-7267, 2013.
- Kang H, Xiao X, Huang C, Yuan Y, Tang D, Dai X, Zeng X. “Potent aromatase inhibitors and molecular mechanism of inhibitory action” Eur J Med Chem, Vol. 143, pp. 426-437, 2018.
- Aksenov AV, Smirnov AN, Magedov IV, et al. “Activity of 2-aryl-2-(3-indolyl)acetohydroxamates against drug-resistant cancer cells”. J Med Chem, Vol. 58, No. 5, pp. 2206-2220, 2015.
- Ball AR, Casadei G, Samosorn S, Bremner JB, Ausubel FM, Moy TI, Lewis K. Conjugating berberine to a multidrug efflux pump inhibitor creates an effective antimicrobial. ACS Chem Biol, Vol. 1, No. 9, pp. 594-600, 2006.
- Schweizer, D. “Reverse fluorescent chromosome banding with chromomycin and DAPI”. Chromosoma,Vol. 58, pp. 307–324, 1976.
- Kapuscinski J. "DAPI: a DNA-specific fluorescent probe". Biotech. Histochem,Vol.70,No. 5,pp. 220–233, 1995.
- A., ChikvaidzeI.Sh., Narindoshvili T.G. „Derivatives of 2-phenylindole“ Selected methods for synthesis and modification of heterocycles “The Chemistry of synthetic indole systems”, edited by Prof. Kartsev V.G., Moscow: IBS Press, Vol. 3, pp. 219-559, 2004.
- Norio Sakai, KimiyoshiAnnaka, and Takeo Konakahara.“Palladium-Catalyzed Coupling Reaction of Terminal Alkynes with Aryl Iodides in the Presence of Indium Tribromide and Its Application to a One-Pot Synthesis of 2-Phenylindole” Organic Letters, Vol. 6, No. 10, pp. 1527-1530, 2004.
- Govindarajulu Babu, Akihiro Orita, and Junzo Otera. “Novel Synthesis of 2-Aryl and 2,3-Disubstituted Indoles by Modified Double Elimination Protocol”. Org. Lett., Vol. 7, No. 21, pp. 4641-4643, 2005.
- Arcadi A, Cacchi S, Fabrizi G, Marinelli F, Parisi LM. “Palladium-catalyzed reaction of o-alkynyltrifluoroacetanilides with 1-bromoalkynes. An approach to 2-substituted 3-alkynylindoles and 2-substituted 3-acylindoles”. J Org Chem,Vol. 70, No. 16, pp. 6213-7, 2005.
- Dawei Yue, Tuanli Yao, and Richard C. Larock. “Synthesis of 3-Iodoindoles by the Pd/Cu-Catalyzed Coupling of N,N-Dialkyl-2-iodoanilines and Terminal Acetylenes, Followed by Electrophilic Cyclization”. J. Org. Chem, Vol. 71, No. 1, pp. 62-69, 2006.
- Haruhiko Fuwa, and Makoto Sasaki. “Strategies for the Synthesis of2-Substituted Indoles and IndolinesStarting from Acyclic r-PhosphoryloxyEnecarbamates”. Org. Lett., Vol. 9, No. 17, Pp.3347-3350,2007.
- Miyaura, Norio; Suzuki, Akira. "Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds". Chemical Reviews,Vol. 95, No. 7, pp. 2457–2483, 1995.
- Richard F. Heck. "Mechanism of Arylation and Carbomethoxylation of Olefins with Organopalladium Compounds". J. Am. Chem. Soc.,Vol. 91,No. 24,pp. 6707–6714, 1969.
- Stuart DR, Bertrand-Laperle M, Burgess KM, Fagnou K. “Indole synthesis via rhodium catalyzed oxidative coupling of acetanilides and internal alkynes”. J Am Chem Soc,Vol. 130, No. 49, pp. 16474-5, 2008.
- Yoshihiro Yamane, Xiaohao Liu, Akiyuki Hamasaki, et al. One-Pot Synthesis of Indoles and Aniline Derivatives from Nitroarenes under Hydrogenation Condition with Supported Gold Nanoparticles. Org. Lett., Vol. 11, No. 22, 2009. 5162-5165
- Yu Chen, Chul-Hee Cho, and Richard C. Larock. “A Novel Synthetic Route to 3-Sulfenyl- and 3-Selenylindoles by n-Bu4NI-Induced Electrophilic Cyclization”. Org. Lett., Vol. 11, No. 1, pp. 173-176, 2009.
- Zunjun Liang, Bangben Yao, and Yuhong Zhang.“Pd(OAc)2-Catalyzed Regioselective Arylation of Indoles with Arylsiloxane in Acidic Medium”. Org. Lett., Vol. 12, No. 14, pp. 3185-3187, 2010.
- Kiyofumi Inamoto, Narumi Asano, Yuka Nakamura, et al.“Synthesis of 3-Carboxylated Indoles through a Tandem Process Involving Cyclization of 2-Ethynylanilines Followed by CO2 Fixation in the Absence of Transition Metal Catalysts”. Org. Lett., Vol. 14, No. 10, pp. 2622–2625, 2012.
- Yan Peng E, Li Qiang Wan, Yu Jing Li, et al. “Thermally induced structural transformation of polytriazoleimide to polyindoleimide”. Chinese Chemical Letters, Volume 23, Issue 9, 1087–1090, 2012.
- Manash Kumar Manna, Asik Hossian, and Ranjan Jana.“Merging C–H Activation and Alkene Difunctionalization at Room Temperature: A Palladium-Catalyzed Divergent Synthesis of Indoles and Indolines”. Organic Letters,Vol. 17,No. 3, pp. 672-675,2015.
- Virsinha Reddy and Ramasamy Vijaya Anand.“Expedient Access to Unsymmetrical Diarylindolylmethanes through Palladium-Catalyzed Domino Electrophilic Cyclization–Extended Conjugate Addition Approach”. Organic Letters,Vol. 17,No. 14, pp. 3390-3393, 2015.
- Yin-Long Li, Jian Li, Ai-Lun Ma, Ya-Nan Huang, and Jun Deng. Metal-Free Synthesis of Indole via NIS-Mediated Cascade C–N Bond Formation/Aromatization. J. Org. Chem.,Vol. 80,No. 8, pp. 3841-3851, 2015.
- Karmakar R, Suneja A, Singh VK. “Ag(I)-Catalyzed Indolization/C3-Functionalization Cascade of 2-Ethynylanilines via Ring Opening of Donor-Acceptor Cyclopropanes”. Org Lett.,Vol. 18, No. 11, pp. 2636-9, 2016.
- Michael Teders, Lena Pitzer, Stefan Buss, and Frank Glorius.“Regioselective Synthesis of 2-Substituted Indoles from Benzotriazoles and Alkynes by Photoinitiated Denitrogenation”. ACS Catal.,Vol. 7, No. 6, pp. 4053–4056, 2017.
- Shuling Yu, Linjun Qi, Kun Hu, et al. “The Development of a Palladium-Catalyzed Tandem Addition/Cyclization for the Construction of Indole Skeletons”. J. Org. Chem.,Vol. 82, No 7, pp. 3631–3638, 2017.
- Rino Ishikawa, Ryosuke Iwasawa, Yuichiro Takiyama, et al. “Synthesis of 1,2-Bis(2-aryl-1H-indol-3-yl)ethynes via 5-exo-Digonal Double Cyclization Reactions of 1,4-Bis(2-isocyanophenyl)buta-1,3-diyne with Aryl Grignard Reagents”. J. Org. Chem., Vol. 82, No. 1, pp. 652–663, 2017.
- Lianghua Jie, Lianhui Wang, Dan Xiong, et al.“Synthesis of 2-Arylindoles through Pd(II)-Catalyzed Cyclization of Anilines with Vinyl Azides”. J. Org. Chem., Vol. 83, No. 18, pp. 10974–10984, 2018.
- Laurel M. Heckman, Zhi He, and Timothy F. Jamison. “Synthesis of Highly Substituted 2-Arylindoles via Copper-Catalyzed Coupling of Isocyanides and Arylboronic Acids”. Org. Lett., Vol. 20, No. 11, pp. 3263–3267, 2018.
Recieved: 08-04-2021 | Web published: 02-05-2021 | Views 2558


