| წინა ელემენტი |
|
შემდეგი ელემენტი |
სახე

მოვერცხლისფერო-თეთრი
ძირითადი თვისებები
| დასახელება, სიმბოლო, ნომერი |
ტერბიუმი,Tb, 65 |
| წარმოთქმა |
|
| ელემენტის კატეგორია |
ლანთანიდი |
| ჯგუფი, პერიოდი, ბლოკი |
n/a, 6, f |
| ატომური მასა |
158.92535 გ მოლი-1 |
| ელექტრონული კონფიგურაცია |
[Xe] 4f9 6s2 |
| ელექტრონები ორბიტალებზე |
2, 8, 18, 27, 8, 2 |
ფიზიკური თვისებები
| აგრეგატული მდგომარეობა |
მყარი |
| სიმკვრივე |
8.23 გ სმ-3 |
| სიმკვრივე თხევად მგდომარეობაში (ლღობის ტემპერატურაზე) |
7.65 გ სმ-3 |
| ლღობის ტემპერატურა |
1629 K, 1356˚C |
| დუღილის ტემპერატურა |
3503 K, 3230 ˚C, 5846 ˚F |
| კრიტიკული წერტილი |
|
| დნობის სითბო |
10.15 კჯ მოლი-1 |
| აორთქლების სითბო |
293 კჯ მოლი-1 |
| სპეციალური სითბოტევადობა |
(25 ˚C) |
| ორთლის წნევა | ||||||||||||||
|
ატომური თვისებები
| ჟანგვითი რიცხვები |
4, 3, 2, 1 |
| ელექტროუარყოფითობა |
1.2 (პოლინგის შკალა) |
| იონიზაციის ენერგიები |
565.8 |
| ატომური რადიუსი |
177 pm |
| კოვანელტური რადიუსი |
194 pm |
| ვან დერ ვაალსის რადიუსი |
-pm |
სხვადასხვა
| კრისტალური სტრუქტურა |
ჰექსაგონალური |
| მაგნიტური მოწესრიგებულობა |
პარამაგნიტური 300K-ზე |
| კუთრი ელექტრული წინაღობა |
(20˚C) 1.150ნΏ მ |
| სითბოგამტარობა |
(300 K) 11.1 ვტმ-1K-1 |
| სითბოგადაცემა |
(25˚C) 10.3 µm m-1K-1 |
| ბგერის სიჩქარე |
(20˚C) 2620მ/წმ |
| იუნგის მოდული |
55.7 გპა |
| შერის მოდული |
22.1 გპა |
| ბულკის მოდული |
38.7 გპა |
| სიმტკიცე მოსის მიხედვით |
- |
| CAS-ის რეფისტრაციის ნომერი |
7440-27-9 |
მდგრადი იზოტოპები
| იზოტოპი | NA | ნახევარ-სიცოცხლე | DM | DE(MeV) | DP |
| 157Tb | სინთ | 71 y | ε | 0.060 | 157Gd |
| 158Tb | სინთ | 180 y | ε | 1.220 | 158Gd |
| β− | 0.937 | 158Dy | |||
| 159Tb | 100% | 159Tbსტაბილურია 94 ნეიტრონოით | |||
ტერბიუმი
ტერბიუმი წარმოადგენს ქიმიურ ელემენტს, რომლის სიმბოლოა - Tb და ატომური ნომერი - 65. ტერბიუმი მოვერცხლისფრო-თეთრი იშვიათ მიწათა მეტალია. იგი ჭედადი და დრეკადია და იმდენად რბილია, რომ შესაძლებელია მისი დანით გაჭრა. ტერბიუმი ბუნებაში თავისუფალი სახით არ გვხვდება, მაგრამ იგი შედის მრავალი მინერალის შემადგენლობაში, როგორიცაა: ცერიტი, მონაციტი, ქსენოთაიმი და ეუქსენიტი.
ტერბიუმი გამოიყენება კალციუმის ფთორიდის, კალციუმის ვოლფრამატის და სტრონციუმის მოლიბდატის შემავსებლად, რომლებიც თავის მხრივ გამოიყენებიან მყარი მდგომარეობის მოწყობილობებში. აგრეთვე გამოიყენება კრისტალურ სტაბილიზატორებად ენერგეტიკულ ელემენტებში, რომლებიც მაღალ ტემპერატურაზე ოპერირებენ,როგორც ტერფენოლ-D-ს კომპონენტები.
ტერბიუმი გამოიყენება სამხედრო-საზღვაო ჰიდროლოკატორებში და სენსორებში.
ტერბიუმის მარაგის მსოფლიო დანახარჯი მოდის ”მწვანე”ფოსფორზე (რომელიც ჩვეულებრივ ყვითელია). ტერბიუმის ოქსიდი არის ფლუორესცენტულ ნაერთებსა და TV ტუბებში tubes (მილებში). ტერბიუმ ”მწვანე” ფოსფორები (რომელიც ფლუორესცენცირებს ბრილიან ყვითელ-ლიმონისფერში), უკავშირდება ორვალენტიან ევროპიუმის ლურჯ ფოსფორებს და სამვალენტიან ევროპიუმ წითელ ფოსფორებს, რომლებიც გამოიყენება ”ტრიქრომატული” ნათების ტექნოლოგიებში და მაღალი წარმადობის სტანდარტული გამოსხივების თეთრი ნათებისათვის, რომლებიც გამოიყენება შიდა განათებისათვის.
დახასიათება
ფიზიკური თვისებები

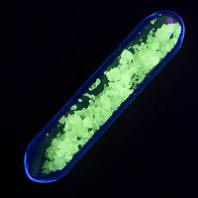
ტერბიუმის სულფატი , Tb2(SO4)3 (ზევით), მწვანე ფლუორესცენცია უმლტაიისფერი დანათების ქვეშ
ტერბიუმი მოვერცხლისფრო-თეთრი იშვიათ მიწათა მეტალია, რომელიც ელასტიკური, ჭედადი და რბილია (ადვილად იჭრება დანით). სხვა ლანთანოიდებთან შედარებით ჰაერზე მდგრადია. ტერბიუმი გვხვდება ორი კრისტალური ალოტროპიული სახით, რომლებიც ერთმანეთში გადადის 1289°C.
ტერბიუმ(III) კათიონს აქვს ბრილიანტისებრი ფლუორესცენცია, კაშკაშა ლიმონისფერ-ყვითელ ფერით, რაც გამოწვეულია მკვეთრი მწვანე ნათების კომბინაციით, სხვა ფორთოხლისფერ და წითელ ნათებასთან ერთად.
ტერბიუმი ადვილად იჟანგება და იგი თავისი ელემენტური ფორმით გამოიყენება მხოლოდ კვლევითი მიზნებისათვის. ტერბიუმის ატომები შეიძლება გამოიყოს მათი ფულე-რენის მოლეკულებში ჩანერგვით.
ტერბიუმს გააჩნია მარტივი ფერომაგნიტური რიგი 219K დაბალ ტემპერატურაზე. 219K ტემპერატურაზე ზემოთ იგი გადადის სპირალურ, ანტიფერომაგნიტურ მდგომარეობაში, რომელშიც ყველა ატომური მომენტი პარალელურია ბაზისის სიბრტყის ფენისა. ეს არაჩვეულებრივი ანტიფერომაგნიტიზმი 230K ტემპერატურაზე გარდაიქმნება უწესრიგო პარამაგნიტურ მდგომარეობად.
ქიმიური თვისებები
ტერბიუმის ყველაზე ჩვეულებრივი სავალენტო მდგომარეობაა +3 დაჟანგულობის რიცხვით, მაგალითად Tb2O2. +4 მდგომარეობა ცნობილია TbO2-სა და TbF4-ში. ტერბიუმი ადვილად იწვის და წარმოქმნის ტერბიუმის (III,IV) ოქსიდების ნარევს.
8 Tb + 7 O2 → 2 Tb4O7
ხსნარებში ტერბიუმი მხოლოდ სამვალენტიან იონს წარმოქმნის. ტერბიუმი საკმაოდ ელექტროდადებითია, ნელა ურთიერთქმედებს ცივ წყალთან და საკმაოდ სწრაფად შედის რეაქციაში ცხელ წყალტან, ტერბიუმის ჰიდროქსიდის წარმოქმნით.
2 Tb (მყ) + 6 H2O (სითხე) → 2 Tb(OH)2 (ხსნ.) + 3H2 (აირი)
ტერბიუმი ურთიერთქმედებს ყველა ჰალოგენთან:
2 Tb (მყ) + 3 F2 (აირი) → 2 TbF2 (მყ) [თეთრი]
2 Tb (მყ) + 3 Cl2 (აირი) → 2 TbCl2 (მყ) [თეთრი]
2 Tb (მყ) + 3 Br2 (აირი) → 2 TbBr2 (მყ) [თეთრი]
2 Tb (მყ) + 3 I2 (აირი) → 2 TbI2 (მყ)
ტერბიუმი სქრაფად იხსნება განზავებულ გოგირდმჟავაში და წარმოქმნის მკრთალ ვარდისფერ Tb(III) იონების შემცველ ხსნარს, რომელიც არსებობს [Tb(OH2)9]3+ კომპლექსებში.
2 Tb (მყ) + 3 H2SO4 (სითხე) → 2 Tb3+ (სითხე) + 3 SO2−4 (სითხე) + 3 H2 (აირი)
ნაერთები
ტერბიუმი აზოტთან, ნახშირბადთან, გოგირდთან, ფოსფორთან, ბორთან, სელენტან, სილიციუმთან და დარიშხანთან, მაღალ ტემპერატურაზე წარმოქმნის ბინარულ ნაერთებს, მაგალითად, TbH2, TbH2, TbB2, Tb2S2, TbSe, TbTe და TbN. ამ ნაერთების უმეტესობაში ტერბიუმი ამჟღავნებს +3 დაჟანგულობის რიცხვს, ზოგან კი +2. ტერბიუმ (II) ჰალოგენიდები მიიღება Tb(III) ჰალოგენიდების ტანტალის კონტეინერში გამოწვით, მეტალური Tb თანაობისას. ტერბიუმი აგრეთვე წარმოქმნის სესქვიქლორიდს Tb2Cl2, რომელიც შემდგომ 800°C-ზე გამოწვით შეიძლება აღდგეს TbCl -მდე. ტერბიუმ (I) ქლორიდი წარმოქმნის გრაფიტის მსგავს სტრუქტურას.
ტერბიუმ(IV) ფთორიდი ძლიერი მაფთორირებელი აგენტია, უფრო მეტად ვიდრე CoF2-დან ან CeF4-დან მიღებული ფთორიდების ნარევის ორთქლი.
იზოტოპები
ბუნებაში გავრცელებული ტერბიუმი შედგება ერთი სტაბილური იზოტოპისაგან - 159Tb. დახასიათებულია მისი 33 რადიოიზოტოპი, რომელთაგან ყველაზე მდგრადია 158Tb (ნახევარდაშლის პერიოდია 180 წელი), 157Tb (ნახევარდაშლის პერიოდია 71 წელი) და 169Tb (ნახევარდაშლის პერიოდია 71 დღე). ყველა დანარჩენი რადიოიზოტოპის ნახევარდაშლის პერიოდი 6.907 დღეზე ნაკლებია. ამ ელემენტს აგრეთვე გააჩნია 18 მეტა მდგომარეობა, რომელტაგან ყველაზე სტაბილურია 156მ1Tb (t½ 24.4 სთ), 154მ2Tb (t½ 22.7 სთ) და 154მ1Tb (t½ 9.4 სთ).
ისტორია
ტერბიუმი აღმოჩენილ იქნა 1843 წელს, შვედი ქიმიკოსის კ.გ. მოსანდერის (Carl Gustaf Mosander) მიერ, რომელმაც იგი აღმოაცინა იტრიუმის ოქსიდში Y2O2, რომელსაც შვედეთის სოფელ იტერბის გამო, მას უწოდა იტერბი. სუფთა სახით იგი არ იყო გამოყოფილი იონ-გაცვლითი ტექნოლოგიების შემუშავებამდე.
როდესაც მონსანდერმა პირველად დაყო ”იტრია”სამ ფრაქციად. "terbia"-ს ფრაქცია იყო ვარდისფერი (ამჟამად, რომელიც ცნობილია როგორც ერბიუმი) და "erbia" იყო ფრაქცია, რომელიც ჩვეულებრივ ხსნარში იყო უფერო, მაგრამ იძლეოდა მოყავისფრო ოქსიდს. მოგვიანებით მკვლევარებს შეექმნათ სიძნელეები მის არმოჩენასთან დაკავშირებით, მაგრამ ვარდისფერი ფრაქციის წარმოქმნას ყოველთვის ჰქონდა ადგილი.
ყველა შემთხვევაში, როგორც ამჟამად ცნობილია ტერბიუმი მხოლოდ საწყისი იტრიას 1% შეადგენდა, მაგრამ ეს არ იყო საკმარისი დაედგინათ, რომ მოყვითალო ფერი ეკუთვნოდა ოქსიდს.ამგვარად, ტერბიუმი იყო საწყისი, ტერბიუმის ფრაქციის მცირე კომპონენტი, ხოლო დომინანტებს წარმოადგენდა მისი უშუალო მეზობლები: გადოლინიუმი და დისპროზიუმი.
გავრცელება

ქსენოტიმი
ელემენტი ტერბიუმი ბუნებაში თავისუფალი სახით არ გვხვდება, მაგრამ მას შეიცავს მრავალი მინერალი, მათ შორის ცერიტი, გადოლინიტი, მონაციტი ((Ce,La,Th,Nd,Y)PO4, რომელიც ტერბიუმს შეიცავს 0.03% ზემოთ), ქსენოთაიმი (YPO4) და ეუქსენიტი ((Y,Ca,Er,La,Ce,U,Th)(Nb,Ta,Ti)2O6, რომელიც შეიცავს 1%-ზე მეტ ტერბიუმს). დედამიწის ქერქში ტერბიუმის გავრცელება შეადგენს 1.2მგ/კგ.
ტერბიუმის უმდიდრეს კომერციულ წყაროს წარმოადგენს იონ-ადსორბციული თიხები სამხრეთ ჩინეთიდან. მათში ორი მესამედი (წონით) არის იტრიუმის ოქსიდი და დაახლოებით 1%-ია ტერბიუმი. თუმცა იგი მცირე რაოდენობით გვხვდება ბასთნეზიტში და მონაციტში. ეს მინერალები დაამუშავეს გამხსნელით - ექსტრაქციით, რათა გამოეყოთ მძიმე ლანთანოიდები ”სამარიუმ-ევროპიუმ-გადოლინიუმ კონცენტრატის”(SEG concentrate), ფორმით.
მიღება
ტერბიუმ-შემცველი მინერალის მცირე ზომის ნატეხები მუშავდება ცხელი კონცენტრირებული გოგირდმჟავათი და წარმოიქმნება იშვიათ მიწათა ელემენტების წყალში ხსნადი სულფატები. მჟავა ფილტრატი ნაწილობრივ ნეიტრალიზდება კაუსტიკური სოდით, pH 3-4-მდე. თორიუმი ჰიდროქსიდის სახით გამოილექება ხსნარიდან და მოცილდება მას. ამის შემდეგ ხსნარი მუშავდება ამონიუმის ოქსალატით, რომელსაც იშვიათ მიწათა ელემენტები გადაჰყავს თავის შესაბამის უხსნად ოქსალატებში. ოქსალატები გახურებით გადადის ოქსიდებში, რომლებიც იხსნებიან აზოტმჟავაში, გარდა ძირითადი კომპონენტისა, ეს არის ცერიუმი, რომლის ოქსიდიც არ იხსნება HNO2. ტერბიუმი გამოიყოფა ამონიუმის ნიტრატით კრისტალიზაციით, ორმაგი მარილის სახით.
ტერბიუმის მარილების გამოყოფა იშვიათ მიწათა მარილების ხსნარებიდან ყველაზე ეფექტურია იონ-გაცვლითი ტექნოლოგიებით. ამ პროცესში, იშვიათ მიწათა ელემენტების იონები იხსნებიან შესაბამის იონ-გაცვლით ფისში, ამ უკანასკნელში არსებული იონებით მიმოიცვლებიან წყალბადის, ამონიუმის ან სპილენძის იონებით. იშვიათ მიწათა იონები შემდგომ სელექტიურად გამოირეცხება შესაბამისი კომპლექსური აგენტით. სხვა იშვიათ მიწათა ელემენტების მსგავსად, მეტალური ტერბიუმი მიიღება მეტალური კალციუმით უწყლო ქლორიდის ან ფთორიდის აღდგენით. კალციუმის ან ტანტალის მინარევები შეიძლება მოვილდეს ვაკუუმში ხელახალი გალღობით, გამოხდით, ამალგამის წარმოქმნით ან ზონური ლღობით.
გამოყენება
ტერბიუმი გამოიყენება კალციუმის ფთორიდის, კალციუმის ვოლფრამატის და სტრონციუმ მოლიბდენატის შემავსებლად, რომლებიც შემდგომ გამოიყენება მყარი მდგომარეობის მოწყობილობებში და აგრეთვე, როგორც ენერგეტიკული ელემენტის კრისტალური სტაბილიზატორი, რომელიც ოპერირებს მაღალ ტემპერატურაზე ZrO2-თან ერთად.
ტერბიუმი ასევე გამოიყენება შენადნობებში და ელექტრონული ხელსაწყოების წარმოებაში, როგორც ტერფენოლ-D-ს კომპონენტი. იგი გამოიყენება ამძრავ მექანიზმებში და ხმის დეფექტების სენსორებში.
ტერბიუმის ოქსიდი გამოიყენება ფლუორესცენტულ ნათურებში და ფერადი TV მირების მწვანე ფოსფორებში. ნატრიუმ-ტერბიუმ ბორატი გამოიყენება მყერი მდგომარეობის მოწყობილობებში. ტერბიუმის ბრილიანტ ფლუორესცენტული შენადნობები ბიოტექნოლოგიაში გამოიყენება, როგორც საცეცები, სადაც იგი ქცევით საკმაოდ ემსგავსება კალციუმს. ტერბიუმ ”მწვანე” ფოსფორები (რომლებიც ფლუორესცირებენ ბრილიანტ ლიმონისფერ-ყვითლად), ორვალენტიანი ევროპიუმის ლურჯ ფოსფორებთან და სამვალენტიანი ევროპიუმის წითელ ფოსფორებთან ერთად უზრუნველყოფენ ”ტრიქრომატულ” გამანათებელ ტექნოლოგიას. ტრიქრომატული ნათება გვაძლევს გაცილებით მეტ სინათლეს, ვიდრე იმავე სიმძლავრის ვარვარების ნათურები.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით


