| წინა ელემენტი |
|
შემდეგი ელემენტი |
სახე
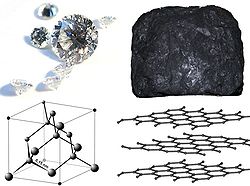
გამჭვირვალე (ალმასი), შავი (გრაფიტი)
ძირითადი თვისებები
| დასახელება, სიმბოლო, ნომერი |
ნახშირბადი, C, 6 |
| წარმოთქმა |
|
| ელემენტის კატეგორია |
არამეტალი |
| ჯგუფი, პერიოდი, ბლოკი |
14, 2, p |
| ატომური მასა |
12.0107(8) გ მოლი-1 |
| ელექტრონული კონფიგურაცია |
1s2 2s2 2p2 ან |
| ელექტრონები ორბიტალებზე |
2,4 |
ფიზიკური თვისებები
| აგრეგატული მდგომარეობა |
მყარი |
| სიმკვრივე |
ამორფული 1.8–2.1 გ/სმ3 |
| სიმკვრივე თხევად მგდომარეობაში (ლღობის ტემპერატურაზე) |
- გ სმ-3 |
| ლღობის ტემპერატურა |
სუბლიმაცია 3915 K, სუბლიმაცია 3642 ˚C |
| დუღილის ტემპერატურა |
4600 K, 4327 ˚C, 10800 ˚F |
| კრიტიკული წერტილი |
|
| დნობის სითბო |
117 (გრაფიტი) კჯ მოლი-1 |
| აორთქლების სითბო |
- კჯ მოლი-1 |
| სპეციალური სითბოტევადობა |
(25 ˚C) |
| ორთლის წნევა | ||||||||||||||
|
ატომური თვისებები
| ჟანგვითი რიცხვები |
4, 3, 2, 1, 0, -1, -2, -3, -4 |
| ელექტროუარყოფითობა |
2.55 (პოლინგის შკალა) |
| იონიზაციის ენერგიები |
I: 1086.5 kJ·mol−1; |
| ატომური რადიუსი |
- pm |
| კოვანელტური რადიუსი |
77-69 pm |
| ვან დერ ვაალსის რადიუსი |
170pm |
სხვადასხვა
| კრისტალური სტრუქტურა |
- |
| მაგნიტური მოწესრიგებულობა |
დიამაგნიტური |
| კუთრი ელექტრული წინაღობა |
(20˚C) -ნΏ მ |
| სითბოგამტარობა |
(300 K) 119-165 (გრაფიტი) |
| სითბოგადაცემა |
(25˚C) 0.8 (ალმასი) µm m-1K-1 |
| ბგერის სიჩქარე |
(20˚C) -მ/წმ |
| იუნგის მოდული |
1050 გპა |
| შერის მოდული |
478 გპა |
| ბულკის მოდული |
442 გპა |
| სიმტკიცე მოსის მიხედვით |
1-2 |
| CAS-ის რეფისტრაციის ნომერი |
7440-44-0 |
მდგრადი იზოტოპები
| იზოტოპი | NA | ნახევარ-სიცოცხლე | DM | DE(MeV) | DP |
| 12C | 98.9% | 12C მდგრადია 6 ნეოტრონით | |||
| 13C | 1.1% | 12C მდგრადია 7 ნეოტრონით | |||
| 14C | 100% | 5730 y | β- | 0.156 | 14N |
ნახშირბადი
ნახშირბადის (ლათ.Carbonium) სახელწოდება "carbon" მოდის ლათინური სიტყვისაგან carbo, რაც ნიშნავს ნახშირს. ნახშირბადი მენდელეევის პერიოდული სისტემის ქიმიური ელემენტია სიმბოლოთი C და ატომური ნომრით 6. იგი მეორე პერიოდის, მეოთხე ჯგუფის მთავარი ქვეჯგუფის ელემენტია და მიეკუთვნება არამეტალებს. იგი ორგანულ ნაერთებში ყოველთვის ოთხვალენტიანია - ოთხი ელექტრონით, რომლითაც შეუძლია წარმოქმნას ოთხი კოვალენტური ბმა. ნახშირბადი გვხვდება სამი ბუნებრივი იზოტოპის სახით, რომელთა შორის 12C და 13C სტაბილურია, მაშინ როცა 14C არის რადიოაქტიური, რომლის ნახევარდაშლის პერიოდი ~ 5730 წელია. ნახშირბადი იმ ელემენტთაგანია, რომელიც ანტიკური ხანიდანაა ცნობილი.
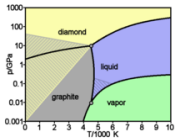
ნახშირბადის თეორიულად გათვლილი ფაზური დიაგრამა
ნახშირბადისაგან ყველაზე მეტად ცნობილია მისი რამოდენიმე ალოტროპიული სახეცვლილება, როგორიცაა- გრაფიტი, ალმასი და ამორფული ნახშირი. ნახშირბადის ფიზიკური თვისებები დაკავშირებულია ალოტროპიასთან. მაგალითად, ალმასი არის გამჭვირვალე და უფერო, მაშინ როცა გრაფიტი არაგამჭვირვალე და შავია. ალმასი ცნობილია როგორც ძალიან მაგარი ნივთიერება, როცა გრაფიტი არის რბილი იქამდე, რომ ფურცელზე ტოვებს კვალს (აქედანაა მისი სახელი წარმომდგარი - ბერძნული სიტყვიდან ”to write”-წერა). ალმასს აქვს ძალიან დაბალი ელექტროგამტარობა, მაშინ როცა გრაფიტი კარგი გამტარია. ნორმალურ პირობებში ალმასს აქვს უდიდესი თბოგამტარობა ამ მხრივ ცნობილ ნაერთებს შორის. ყველა ალოტროპიული ფორმა არის მყარი ნორმალურ პირობებში, მაგრამ გრაფიტი თერმოდინამიკურად უფრო მდგრადია.
ნახშირბადის ყველა ფორმა ძალიან სტაბილურია, მაშინ როცა განსაზღვრულ ტემპერატურაზე ჟანგბადთანაც კი რეაგირებს. არაორგანულ ნაერთებში ნახშირბადის ყველაზე გავრცელებული დაჟანგულობის ხარისხი არის +4, თუმცა +2 არის ნახშირბადის მონოქსიდში და სხვა გარდამავალ მეტალკარბონილკომპლექსებში. არაორგანული ნახშირბადის უდიდესი წყაროა კირქვა, დოლომიტი და ნახშირბადის დიოქსიდი, მაგრამ მისი მნიშვნელოვანი რაოდენობა გვხვდება ქვანახშირის ორგანულ ფენებში, ნავთობში, ტორფში.
ნახშირბადი დედამიწის ქერქში ყველაზე გავრცელებულ ელემენტებს შორის მეთხუთმეტეა და მეოთხე ელემენტია მთელ სამყაროში გავრცელების მიხედვით -წყალბადის, ჰელიუმის და ჟანგბადის შემდეგ (მასის მიხედვით). იგი არსებობს საყოველთაოდ ცნობილ ცოცხალ ორგანიზმებში და იგი ადამიანის ორგანიზმში მეორე გავრცელებული ელემენტია ჟანგბადის შემდეგ მასის მიხედვით (~ 18.5%).
ორგანული ნაერთების სიმდიდრე, მათი უნიკალური სახესხვაობები და მათი უნარი დედამიწაზე არსებულ ჩვეულებრივ ტემპერატურაზე წარმოქმნას პოლიმერული ფორმები, ამ ელემენტს ხდის სიცოცხლის ქიმიურ საწყისად ყველა სხვა ცნობილ ელემენტებს შორის.
დახასიათება
ნახშირბადის ალოტროპიის სხვადასხვა ფორმა მოიცავს უმაგრეს ბუნებრივ ნივთიერებას ალმასს და აგრეთვე ურბილეს ცნობილ ნაერთს გრაფიტს. ამასთან, მას უნარი აქვს დაუკავშირდეს სხვა პატარა ატომებს, მათ შორის სხვა ნახშირბად ატომებს. აგრეთვე მას შუძლია წარმოქმნას მრავალი მდგრადი კოვალენტური ბმა სხვა ატომებთან. შედეგად ცნობილია, რომ ნახშირბადი წარმოქმნის ათ მილიონ სხვადასხვა ნაერთს. ნახშირბადს სხვა ელემენტებს შორის აქვს მაღალი ლღობის და სუბლიმაციის ტემპერატურა. ატმოსფერულ წნევაზე იგი არ ლღვება და ამასთან, იგი სუბლიმირდება ~ 3900K.
ნახშირბადი სუბლიმირდება ნახშირბადის რკალის სახით, რომლის ტემპერატურაც ~ 5800K-ია. ამრიგად, მის ალოტროპიულ ფორმებზე დამოუკიდებლად ნახშირბადი მაღალ ტემპერატურაზე რჩება მყარ მდგომარეობაში, ვოლფრამსა და რენიუმთან შედარებით, რომელთაც მაღალი ლღობის ტემპერატურა აქვთ. მიუხედავად იმისა, რომ მას აქვს თერმოდინამიკური მიდრეკილება დაჟანგვისადმი, ნახშირბადი მდგრადია მჟანგველებისადმი უფრო მეტად, ვიდრე რკინა და სპილენძი, რომლებიც არიან უფრო სუსტი აღმდგენები ოთახის ტემპერატურაზე.
ნახშირბადშემცველი ნაერთები წარმოადგენენ დედამიწაზე სიცოცხლის საფუძველს. ნახშირბად-აზოტის ციკლი უზრუნველყოფს მზისა და სხვა ვარსკვლავების მიერ ენერგიის წარმოქმნას. იგი წარმოქმნის ნაერთთა ექსტრაორდინალურ ვარიაციებს, უმეტესად ისეთებსაც სადაც ნახშირბადი შედარებით არარეაქციისუნარიანია. ნორმალურ პირობებში, სტანდარტულ ტემპერატურაზე და წნევაზე იგი მკაცრი დამჟანგველების მიმართ მდგრადია. იგი არ ურთიერთქმედებს გოგირდმჟავასთან, ქლორწყალბადმჟავასთან და აგრეთვე ტუტეებთან. მაღალ ტემპერატურაზე ნახშირბადი ურთიერთქმედებს ჟანგბადთან და მას შეუძლია აღადგინოს რკინა ოქსიდიდან მეტალამდე. ეს ეგზოთერმული რეაქცია გამოიყენება რკინისა და ფოლადის ინდუსტრიაში.
Fe3O4 + 4 C(მყ) → 3 Fe(მყ) + 4 CO(აირი)
ნახშირბადი წყლის ორთქლთან ურთიერთქმედებით იძლევა სინთეზ-აირის რეაქციას
C(მყ) + H2O(აირი) → CO(აირი) + H2(აირი).
მაღალ ტემპერატურაზე ზოგიერთ მეტალთან ნახშირბადი წარმოქმნის მეტალთა კარბიდებს, მაგალითად. რკინის კარბიდი - ცემენტიტი ფოლადში, ვოლფრამის კარბიდი, რომელიც ფართოდ გამოიყენება მძიმე იარაღის წარმოებაში.
ალოტროპიები
ატომური ნახშირბადი მცირე ხნის განმავლობაში ცოცხლობს, თუმცა იგი ასტაბილიზებს მულტიატომურ სტრუქტურებს სხვადასხვა მოლეკულურ კონფიგურაციაში, რომელთაც ალოტროპიები ჰქვია. კარგად ცნობილი სამი ალოტროპიაა ამორფული ნახშირი, გრაფიტი და ალმასი. ერთ სავარაუდო ეგზოტიკურ იზოტოპს - ფულერენებს ამ დროისათვის იღებენ სინთეზით და იყენებენ კვლევებში.
ნახშირბადის ამორფული, არაკრისტალური ფორმა არის გრაფიტი -ნახშირბადის ატომების არაკრისტალურად, უწესრიგოდ განლაგების შედეგი. იგი არსებობს ფხვნილის სახით და ნიშვნელოვანია ისეთ ნივთიერებებს შორის, როგორიცაა მერქნის ნახშირი, ლამფის ნამწვი (ჭვარტლი) და გააქტიურებული ნახშირი. ნორმალურ წნევაზე ნახშირბადი იღებს გრაფიტის ფორმას, რომელშიც ნახშირბადის თითოეული ატომი დაკავშირებულია სამ სხვა ატომთან და ისინი წარმოქმნიან ბრტყელ ჰექსაგონალურ ბირთვს, მსგავსად ზოგიერთი არომატული ნახშირწყალბადისა. გრაფიტში მესერი ორგანზომილებიანია, მასში განლაგებული ფართო ფენები მჭიდროდ უკავშირდება ვანდერ-ვაალსის ძალებით ერთმანეთს, რაც გრაფიტს ანიჭებს სირბილეს და განბნევის თვისებას (ფენები ადვილად სხლტებიან ერთმანეთის მიყოლებით). გარე ელექტრონების დელოკალოზაციის გამო ყოველი ატომი წარმოქმნის p-ღრუბელს და გრაფიტი ატარებს ელექტროობას, მხოლოდ სიბრტყეში, რომელშიც ყოველი ფენა დაკავშირებულია კოვალენტურად. ამის გამო ნახშირბადი ნაკლებად ელექტროგამტარია ვიდრე მეტალთა უმეტესობა. დელოკალიზაცია აგრეთვე ხსნის გრაფიტის ენერგეტიკულ მდგრადობას ოთახის ტემპერატურაზე ალმასთან შედარებით. ნახშირბადი მაღალ ტემპერატურაზე წარმოქმნის უფრო კომპაქტურ ალმასის ალოტროპიას, რომელსაც გრაფიტზე ოჯერ მეტი სიმკვრივე აქვს. აქ ყოველი ატომი დაკავშირებულია ტეტრაედრულად ოთხ სხვა დანარჩენთან და ატომებისაგან წარმოქმნის სამ განზომილებიან მესერს, რომლებიც შედგებიან ექვსწევრიანი რგოლებისაგან. ალმასს ისეთივე კუბური სტრუქტურა აქვს, როგორც სილიციუმსა და გერმანიუმს, ამიტომაც მასში C-C ბმის ძალა მეტია. იგი ყველაზე მაგარი ნივთიერებაა, რომელიც კი გვხვდება ბუნებაში. იგი გამძლეა გაკაწვრის მიმართ.
ალმასი თერმოდინამიკურად არამდგრადია, ნორმალურ პირობებში გადადის გრაფიტში, მაგრამ ეს გადასვლა გრაფიტში ოთახის ტემპერატურაზე ხდება ძალიან ნელა,შეუჩნევლად, რადგანაც ამ დროს აქტივაციის ენერგიის ბარიერი მაღალია. იგივე პირობებში ნახშირბადი კრისტალიზდება ლონსდალეთში. ამ ფორმას აქვს ჰექსაგონალური მესერი, სადაც ყველა ატომი კოვალენტურადაა ბმული, ამიტომაც ლონსდალეთის ყველა თვისება ახლოსაა ალმასთან.
ფულერენს აქვს გრაფიტის მსგავსი სტრუქტურა, მაგარამ ჰექსაგონალური ნაოჭების გარდა იგი აგრეთვე შეიცავს ნახშირბადის ატომებისგან შემდგარ პენტაგონს (ან ზოგჯერ ჰეპტაგონსაც), რომლებიც განლაგებულნი არიან, ელიფსებად ან ცილინდრებად. ფლუორენების თვისებები არ არის აქამდე სრულად გაანალიზებული და მიეკუთვნება ნანომასალების კვლევის არეალს. სახელი ფულერენი (fullerene) და ბაქიბოლი (buckyball) მათ მიეცა რიჩარდ ბუქმინსტერ ფულლერის პოპულარული გეოდეზიური გუმბათის შემდეგ, რომელიც მან შეადარა ფულერენესის სტრუქტურას.
ბაქიბოლები "buckyball" არის საკმაოდ დიდი მოლეკულები, რომლებშიც ნახშირბადის ატომები დაკავშირებულია ტრიგონალურად. ისინი წარმოქმნიან სფეროებს (კარგად ცნობილ სოსერბოლის ფორმის C60 სტრუქტურას). ნახშირბადის ნანომილაკები სტრუქტურულად ბაქიბოლების მსგავსი არიან, გარდა იმ ფორმებისა, სადაც ყველა ატომი დაკავშირებულია ტრიგონალურად მოღუნულ ფენაში, რომელიც წარმოიქმნება ცილინდრის ღრუში. ნანოკვირტები პირველად 2007 წელს იქნა გამოქვეყნებული და იგი წარმოადგენს ბაქი მილაკებისა (bucky tube)/ბაქიბოლების(buckyball) მასალების ჰიბრიდს, (buckyball-ები არიან კოვალენტურად დაკავშირებული ნანომილაკების გარე კედელთან), რომელსაც აქვს ორივეს თვისებები ერთ სტრუქტურაში.
1997 წელს აღმოჩენილ იქნა ფერომაგნიტური ალოტროპი ნახშირბად ნანოქაფი. მას აქვს დაბალი სიმკვრივე და ატომები შეერთებულია ექვს და შვიდწევრიან ბირთვებად.
გავრცელება
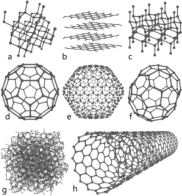
ნახშირბადის ზოგიერთი ალოტროპი: a) ალმასი; b) გრაფიტი; c) ლონსდალეიტი; d–f) ფულერენები (C60, C540, C70); g) ამორფული ნახშირბადი; h) ნახშირბადოვანი ნანომილაკი.
ნახშირბადი მეოთხე ელემენტია სამყაროში გავრცელებული ელემენტების -წყალბადის, ჰელიუმის და ჟანგბადის შემდეგ. იგი გვხვდება ატმოსფეროში, ვარსკვლავებში და მზეზე.
ნახშირბადის დიოქსიდში ჟანგბადთან კომბინაციით ნახშირბადი ნაპოვნია დედამიწის ატმოსფეროში (~ 810 გიგატონა ნახშირბადი) და იგი გახსნილია ყველა წყლიან ორგანიზმში (~ 36.000 გიგატონა ნახშირბადი), ბიოსფეროში არის ნახშირბადი ~ 36.000 გიგატონა. ნახშირწყალბადები (როგორიცაა ქვანახშირი, პეტროლეუმი და ბუნებრივი აირი) შეიცავენ ნახშირბადის მარაგს ~ 900 გიგატონამდე, ნავთობი შეიცავს ~ 150 გიგატონას, ბუნებრივი გაზი შეიცავს ~ 170 გიგატონას ნახშირბადს.
ნახშირბადი ძირითადი კომპონენტია კარბონატულ მადნებში (კირქვა, დოლომიტი, მარმარილო და სხვა). ქვანახშირი არის კომერციული წყარო მინერალური ნახშირბადისა: ანთრაცენი შეიცავს 92-98% ნახშირბადს და უფრო დიდი მარაგია (4.000 გიგატონა ანუ 80% ქვანახშირი, გაზი და ნავთობის მარაგი) ნახშირბადისა იმ ფორმებში, რომელიც საწვავად გამოიყენება. აშშ-ში ნაპოვნია გრაფიტის დიდი რაოდენობა (უმეტესად ნიუ-იორკი და ტეხასი), ასევე რუსეთში, მეხიკოში, გრენლანდიასა და ინდოეთში.
ალმასის უმნიშვნელოვანესი ნაწილი დეპოზირებულია აფრიკაში, უმეტესად სამხრეთ აფრიკაში, ნამიბიასა და კონგოში. იგი აგრეთვე არის კანადაში, რუსეთის არქტიკაში, ბრაზილიაში, ჩრდილოეთ და აღმოსავლეთ ავსტრიაში.
იზოტოპები

გრაფიტის მადანი

ნედლი ალმასის კრისტალი
ნახშირბადს აქვს ორი სტაბილური ბუნებრივი იზოტოპი. ეს არის იზოტოპი ნახშირბად-12 (12C), რომელიც დედამიწის ნახშირბადის 98.93% შეადგენს, ხოლო ნახშირბად-13 (13C) არის 1.07%. ნახშირბად-14(14C) არის ბუნებრივი რადიოიზოტოპი, რომელიც დედამიწაზე გვხვდება კვალის სახით. აგრეთვე ცნობილია 15 იზოტოპი, მათ შორის 8C. მისი ნახევარდაშლის პერიოდია 1.98739×10-21წმ.
ნახშიბადის ციკლი
დედამიწის პირობებში ერთი ელემენტის მეორეში გადასვლა იშვიათია, ნახშიბადის რაოდენობა დედამიწაზე ეფექტურად მუდმივია. იგი მონაწილეობს ნახშირბადის ციკლში. მაგალითად, მცენარე შთანთქავს ნახშირორჟანგს გარემოდან და იყენებს მას ბიომასალის ასაშენებლად. ამ ბიომასალების ნაწილს ჭამს ცხოველი და თვითონ ნახშიბადი გამოიყოფა ცხოველებიდან ნახშირორჟანგის სახით, რომლის ნაწილი იხსნება ოკეანეებში, მკვდარი მცენარე ან ცხოველი გარდაიქმნება ქვანახშირად ან ნავთობად, რომელიც შეიძლება დაიწვას და განთავისუფლდეს ნახშირბადისაგან.
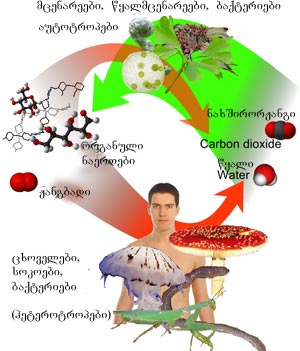
კოლერაცია ნახშირბადის ციკლსა და ორგანულ ნაერთების წარმოქმნას შორის. მცენარეებში ადგილი აქვს ნახშირბადის დიოქსიდის ფიქსაციას, რომელიც შემდეგ ურთიერთქმედებს წყალთან ფოტოსინთეზის პირობებში და წარმოიქმნება ორგანული ნაერთები. ეს უკანასკნელები განაგრძობენ გარდაქმნას ცხოველების საშუალებით
შენაერთები
ორგანული ნაერთები
ნახშიბადს აქვს უნარი წარმოქმნას გრძელი ჯაჭვი ურთიერთდაკავშირებული C-C ბმებით. ამ პროცესს ეწოდება ”catenation”. C-C ბმა ძლიერია და სტაბილური. ეს თვისება ნახშიბადს აძლევბს საშუალებას წარმოქმნას უამრავი ნაერთი და ფაქტია, რომ ნახშირბადშემცველი ნაერთები სხვა ქიმიურ ელემენტთა ნაერთებთან შედარებით მეტია (გამონაკლისია წყალბადი, რადგანაც თითქმის ყველა ორგანული ნაერთი შეიცავს აგრეთვე წყალბადსაც).
უმარტივესი წარმომადგენელია ნახშირწყალბადები - ორგანული მოლეკულების დიდი ოჯახი, რომლებიც შეიცავენ წყალბადატომებს დაკავშირებულს ჯაჭვის ნახშირბად ატომებთან.
ნახშირბადთან დაკავშირებული წყალბადი იძლევა სხვადასხვა ნახშირწყალბადს, რომლებიც მნიშვნელოვანია ინდუსტრიაში, როგორც გამაცივებელი აგენტები, ასევე გამხსნელები, საცხისი ნივთიერებები, ასევე წარმოადგენენ ქიმიურ წყაროს პლასტმასების წარმოებაში და საწვავი ნივთიერებების მისაღებად.
ჟანგბადთან და წყალბადთან შეერთებით ნახშიბადს შეუძლია მოგვცეს მნიშვნელოვანი ბიოლოგიური ნაერთები, მათ შორის შაქრები, ლიგნინები, ხიტინები, ალკოჰოლები, ცხიმები და არომატული ეთერები, კაროტინოიდები და ტერპენები. აზოტთან იგი წარმოქმნის ალკალოიდებს და გოგირდთან შეერთებით იგი იძლევა ანტიბიოტიკებს, ამინომჟავებს და რეზინის პროდუქტებს. ფოსფორთან და სხვა ელემენტებთან შეერთებით იგი წარმოქმნის DNA და RNA, სიცოცხლის ქიმიურ კოდს და ადენოზინ ტრიფოსფატს (ATP), რომელიც წარმოადგენს ყველა ცოცხალ უჯრედში უმნიშვნელოვანეს ენერგიის გადამტანს.
არაორგანული ნაერთები
ზოგადად ნახშირბადშემცველი ნაერთები, რომლებიც დაკავშირებულია მინერალებთან ან რომლებიც არ შეცავენ წყალბადს ან ფტორს მუშავდება კლასიკური ორგანული ნაერთებისგან გამოსაყოფად. მათ შორისაა ნახშირბადის მარტივი ოქსიდები, რომელთა შორის გამორჩეულია (CO2). იგი ერთ-ერთი შემადგენელია პალეოატმოსფეროსი, ხოლო დღეისათვის დედამიწის ატმოსფეროს ძირითადი კომპონენტია. იგი იხსნება წყალში და წარმოქმნის მჟავას (H2CO3), რომელიც არამდგრადია. თუმცა კარბონატ-იონის შემცველი ნაერთები მდგრადია, მაგალითად კალციტი.
ასევე ცნობილია ნახშირბადის მონოოქსიდი (CO), იგი წარმოიქმნება ნახშირბადის არასრული წვის დროს და არის უფერო, უსუნო აირი. მოლეკულაში არსებული ბმა საკმაოდ პოლარულია, რის გამოც მას შეუძლია დაუკავშირდეს ჰემოგლობინის მოლეკულას, შეავიწროვოს ჟანგბადი , რომელსაც აქვს დაბალი დაკავშირების უნარი. ციანიდს (CN–) აქვს მსგავსი სტრუქტურა, მაგრამ იქცევა ისე, როგორც ჰალოგენის იონი (ფსევდოჰალოგენი), მაგალითად, მას შუძლია წარმოქმნას ციანნიტრიდის მოლეკულა [(CN)2], რომელიც მსგავსია ორატომიანი ჰალოგენის. არაგავრცელებული სხვა ოქსიდებია- სუბოქსიდი ((C3O2), არასტაბილური დიკარბონმონოქსიდი (C2O), კარბონტრიოქსიდი (CO3), ციკლოპენტანპენტონი (C5O5), ციკლოჰექსანჰექსონი (C6O6) და მეთილიკანჰიდრიდი(C12O9).
აქტიურ მეტალებთან, როგორიცაა ვოლფრამი, ნახშირბადი წარმოქმნის როგორც კარბიდებს (C4–), ისე აცეტილენიდებს (C2−2), ასევე შენადნობებს მაღალი ლღობის ტემპერატურით. ეს ანიონები ასევე ასოცირდებიან მეთანთან და აცეტილენთან. ორივე ძალიან სუსტი მჟავაა. ნახშირბადის ელექტროუარყოფითობაა 2.5. იგი წარმოქმნის კოვალენტურ ბმებს. ბევრ კარბიდს აქვს კოვალენტური მესერი კარბორუნდის მსგავსად (SiC) მსგავსად, რომელიც ემსგავსება ალმასს.
მეტალორგანული ნაერთები
მეტალორგანული ნაერთები შეიცავენ სულ ცოტა ერთ ნახშირბად-მეტალ ბმას. ძირითადი კლასი მოიცავს მარტივ ალკილმეტალნაერთებს (მაგ. ტეტრაეთილტყვია). ინტერესს იწვევს ნაერთი, რომელიც შეიცავს ოქტაედრულ ჰექსაკოორდინირებულ ნახშირბადის ატომს. კათიონი ამ ნაერთში ასეთი სახისაა [(Ph3PAu)6C]2+.
ისტორია და ეტიმოლოგია
ინგლისური სიტყვა carbon მოდის ლათინური carbo-დან, ნახშირბადიდან, ქვანახშირიდან და აგრეთვე მოდის ფრანგული charbon-დან, რაც ნიშნავს ქვანახშირს.
ნახშირბადი აღმოჩენილ იქნა ძლიან დიდი ხნის წინ და ცნობილი იყო ადრეულ ცივილიზაციაში ჭვარტლის და ქვანახშირის სახით. ალმასი აღმოჩენილი იყო ჩინეთში ჩვენს წელთაღრიცხვამდე 2500 წლის წინათ. ნახშირბადი ქვანახშირის სახით რომის იმპერიის დროიდან მიიღებოდა იგივე ქიმიით, რაც დღეს - ხის მშრალი გამოხდით.
1722 წელს რენე რიმორმა აჩვენა, რომ რკინა შეიძლება გადაიქცეს ფოლადად ზოგიერთი ნივთიერების შთანთქმისას და ეს ნივთიერება ცნობილია, რომ არის ნახშირბადი. 1722 წელს ა. ლავუაზიემ უჩვენა, რომ ალმასი არის ნახშირბადის ფორმა, როდესაც იგი იწვის . კ. შეელემ უჩვენა, რომ გრაფიტი, რომელზეც ფიქრობდნენ რომ ის არის ტყვიის ერთ-ერთი ფორმა, სინამდვილეში არის ნახშირბადი. 1786 წელს ფრანგმა მეცნიერმა კ. ბერთოლემ, გ. მონგმა და ს. ვანდერმონდმა შემდგომში უჩვენეს, რომ ეს ნივთიერება ნახშირბადია.
ნახშირბადის ახალი ალოტროპი ფულერენი აღმოჩენილ იქნა 1985 წელს, რომელიც მოიცავს ნანოსტრუქტურულ ფორმებს, როგორიცაა buckyballs და nanotubes. მათმა აღმომჩენმა მიიღო ნობელის პრემია . ქიმიაში
წარმოება
გრაფიტი
გრაფიტის კომერციული ბუნებრივი მარაგი გვხვდება დედამიწის ბევრ ნაწილში, მაგრამ ყველაზე მნიშვნელოვანი წყაროა ჩინეთში, ინდოეთში, ბრაზილიაში და ჩრდილოეთ კორეაში. გრაფიტი გვხვდება კვარცთან, მთის ქანებში და მეტამორფოზულ ნივთიერებებთან, ასევე კირქვასთან ერთად. 1800 წლებამდე ფანქრებს აკეთებდნენ ნატურალური გრაფიტისაგან.
USGS-ის თანახმად 2006 წელს ბუნებრივი გრაფიტის წარმოება იყო 1.03 მილიონი ტონა, ხოლო 2005 წელს 1.04 მილიონი ტონა. მათ შორის წამყვანი ექსპორტიორები: ჩინეთი 2005 და 2006 წლებში აწარმოებდა 720 000 ტონას, ბრაზილია 2006 -ში 75. 600 ტონას და 2005 -ში 75. 515 ტონას, კანადა - 28 000 ტონას ორივე წელს და მექსიკა 12. 500 ტონას 2006 -ში და 12. 357 ტონას 2005 -ში.
ალმასი
ალმასის გავრცელება მსოფლიოში მოყვანილია რუკაზე. აქტიურ ალმასს (ბრილიანტს) შეიცავს მადნის მხოლოდ მცირე ნაწილი. წინათ მადანს აქუცმაცებდნენ და იქიდან იღებდნენ ალმასს.
დღეისათვის ალმასის მდიდარი ფრაქციის ლოკალიზება ხდება X-სხივების დახმარებით.
დღეისათვის ალმასი დიდი რაოდენობითაა რუსეთში, ავსტრალიასა და კონგოს დემოკრატიულ რესპუბლიკაში. რუსეთი აწარმოებს მთელი ალმასების წარმოების 1/5-ს.
გამოყენება
ნახშირბადი ყველა ცნობილი ცოცხალი სისტემის აუცილებელ საწყისს წარმოადგენს და მის გარეშე სიცოცხლე შეუძლებელია. ნახშირბადი გარდა საკვებისა და ხის მასალისა გამოიყენება ნახშირწყალბადების სახით, რომელთაგან მნიშვნელოვანი საწვავია მეთანი (აირი) და ნავთობი (ბენზინი). ნედლი ნავთობი გამოიყენება ბენზინის ქიმიურ ინდუსტრიაში გაზოილის და ნავთის მისაღებად. ცელულოზა არის ნატურალური, ნახშირბადშემცველი პოლიმერი, რომელიც მიიღება მცენარეებისაგან კოტონის, თეთრეულისა და ქაფის სახით. ცელულოზა გამოიყენება მცენარის სტრუქტურის დასადგენად. კომერციულად გამოსადეგი ნახშირბად-პოლიმერი მიიღება ცხოველთა ორგანიზმებიდან - შალი, აბრეშუმი ქიშმირი. პლასტიკატები კეთდება სინთეზური ნახშირბად-პოლიმერისაგან, ხშირად ჟანგბადისა და აზოტის ატომებთან ერთად. ბევრი სინთეზური ნივთიერების მიღება ხდება გადაუმუშავებელი ნავთობისაგან.
ნახშირბადისა და მისი ნაერთების გამოყენების სფერო ძალიან დიდია, მას შეუძლია წარმოქმნას შენალღობი რკინასთან, რომელიც აუცილებელია ფოლადის მისაღებად. გრაფიტი უკავშირდება თიხას და წარმოქმნის მასალას, რომელიც გამოიყენება ფანქარში საწერად და დასახატად. იგი აგრეთვე გამოიყენება როგორც საცხისი ნაერთები, რასაც იყენებენ მინის წარმოებაში. გამოიყენება აგრეთვე ელექტროდებად მშრალ ბატარიებში, ასევე გამოიყენება როგორც ნეიტრონ-მოდერნატორი ბირთვულ რეაქტორში.
ნახშირი გამოიყენება როგორც სახატავი მასალა მხატვრობაში. ხე, ნახშირი და ნავთობი გამოიყენება საწვავად. ალმასი (ბრილიანტი) გამოიყენება ოქროს სამკაულების დასამზადებლად. ასევე ალმასი გამოიყენება მეტალების და ქვების დასაჭრელად.
პლასტიკატები მზადდება ნახშირწყალბადებისაგან და ნახშირბადოვანი ბოჭკო, რომელიც მიიღება სინთეზური პოლიეთერების ბოჭკოების პიროლიზით, გამოიყენება მსუბუქი კომპოზიციური მასალების მისაღებად. მნიშვნელოვანი ნაერთია აგრეთვე პოლიაკრილონიტრილი (PAN). ნახშირბადის ბოჭკოს კრისტალოგრაფიული სტრუქტურა და მათი მექანიკური თვისებები დამოკიდებულია საწყისი მასალის ტიპზე და გამოყენების შემდგომ პროცესებზე.
შავი ნახშირი გამოიყენება, როგორც შავი პიგმენტი მელანში, სამხატვრო ზეთ-საღებავებში. შავი ნახშირი აგრეთვე გამოიყენება, როგორც შემავსებელი რეზინის პროდუქტებში. გააქტივირებულ ნახშირს იყენებენ აბსორბენტად აირწინაღებში, წყლის გასაწმენდად და მედიცინაში ტოქსინების და გაზების მშთანთქმელად.
ქიმიურ რეაქციებში მაღალ ტემპერატურაზე ნახშირბადი გამოიყენება როგორც აღმდგენი. კოქსი გამოიყენება მადნიდან რკინის აღსადგენად. სილიციუმის, ვოლფრამის, ბორის და ტიტანიუმის კარბიდები ცნობილი უმაგრესი ნაერთებია.
ნახშირბადშემცველ ნაერთებს იყენებენ ბუნებრივი და სინთეზური ქსოვილების მისაღებად, აგრეთვე თითქმის ყველგან შენობაში ინტერიერის ზედაპირის მოსაპირკეთებლად გარდა მინისა, ქვისა და მეტალისა.

ნახშირის ღეროები

ნახშირბადოვანი ქსოვილი

C60 ფულერენი კრისტალურ ფორმაში
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით


