| წინა ელემენტი |
|
შემდეგი ელემენტი |
სახე

ნაცრისფერი მეტალური
ძირითადი თვისებები
| დასახელება, სიმბოლო, ნომერი |
მოლიბდენი, 42, Mo |
| წარმოთქმა |
|
| ელემენტის კატეგორია |
გარდამავალი მეტალი |
| ჯგუფი, პერიოდი, ბლოკი |
6, 5, d |
| ატომური მასა |
95.94 გ მოლი-1 |
| ელექტრონული კონფიგურაცია |
[Kr] 5s1 4d5 |
| ელექტრონები ორბიტალებზე |
2, 8, 18, 13, 1 |
ფიზიკური თვისებები
| აგრეგატული მდგომარეობა |
მყარი |
| სიმკვრივე |
10.28 გ სმ-3 |
| სიმკვრივე თხევად მგდომარეობაში (ლღობის ტემპერატურაზე) |
9.33 გ სმ-3 |
| ლღობის ტემპერატურა |
2896 K, 2623˚C |
| დუღილის ტემპერატურა |
4912 K, 4639 ˚C, 8382 ˚F |
| კრიტიკული წერტილი |
|
| დნობის სითბო |
37.48 კჯ მოლი-1 |
| აორთქლების სითბო |
617 კჯ მოლი-1 |
| სპეციალური სითბოტევადობა |
(25 ˚C) |
| ორთლის წნევა | ||||||||||||||
|
ატომური თვისებები
| ჟანგვითი რიცხვები |
6, 5, 4, 3, 2, 1, -1, -2 |
| ელექტროუარყოფითობა |
2,16 (პოლინგის შკალა) |
| იონიზაციის ენერგიები |
I: 684.3 კჯმოლი-1; |
| ატომური რადიუსი |
139 pm |
| კოვანელტური რადიუსი |
154 pm |
| ვან დერ ვაალსის რადიუსი |
pm |
სხვადასხვა
| კრისტალური სტრუქტურა |
მოცულობითად ცენტრირებული კუბური |
| მაგნიტური მოწესრიგებულობა |
პარამაგნიტური |
| კუთრი ელექტრული წინაღობა |
(20˚C) 53.4 ნΏ მ |
| სითბოგამტარობა |
(300 K) 138 ვტმ-1K-1 |
| სითბოგადაცემა |
(25˚C) 4.8 µm m-1K-1 |
| ბგერის სიჩქარე |
(20˚C) მ/წმ |
| იუნგის მოდული |
329 გპა |
| შერის მოდული |
126 გპა |
| ბულკის მოდული |
230 გპა |
| სიმტკიცე მოსის მიხედვით |
5.5 |
| CAS-ის რეფისტრაციის ნომერი |
7439-98-7 |
მდგრადი იზოტოპები
| იზოტოპი | NA | ნახევარ-სიცოცხლე | DM | DE(MeV) | DP |
| 92Mo | 14.84% | 92Mo სტაბილურია 50 ნეიტრონით | |||
| 93Mo | სინთ | 4×103 y | ε | - | 93 Nb |
| 94Mo | 9.25% | 94Mo სტაბილურია 52 ნეირტონით | |||
| 95Mo | 15.92% | 95Mo სტაბილურია 53 ნეირტონით | |||
| 96Mo | 16.68% | 96Mo სტაბილურია 54 ნეირტონით | |||
| 97Mo | 9.55% | 97Moსტაბილურია 55 ნეირტონით | |||
| 98Mo | 24.13% | 98Mo სტაბილურია 56 ნეირტონით | |||
| 99Mo | სინთ | 65.94 h | β- | 0.436, 1.214 | 99m Tc{{{ps1}}} |
| γ | 0.74, 0.36, 0.14 |
- | |||
| 100Mo | 9.63% | 7.8×1018 y | β-β- | 3.04 | 100Ru |
მოლიბდენი
მოლიბდენი(me-lib-di-nem) წარმოადგენს VI ჯგუფის ქიმიურ ელემენტს, სიმბოლოთი Mo. მისი ატომური ნომერია 42. სახელი წარმოდგება ნეო–ლათინური Molybdaenum-ისგან, უძველესი ბერძნული Molybdos–ისგან, რომელიც ნიშნავს ტყვიას, მას შემდეგ რაც მისი საბადო, შეცდომით მიიჩნიეს ტყვიის საბადოდ.თავისუფალი სახით იგი წარმოადგენს ვერცხლისებრ მეტალს და აქვს ექვსჯერ უფრო მაღალი ლღობის ტემპერატურა, ვიდრე რომელიმე მეტალს. იგი ადვილად წარმოქმნის მაგარ, სტაბილურ კარბიდებს და ამის გამო ხშირად გამოიყენება გამძლე ფოლადის შენადნობებში. მოლიბდენი ბუნებაში არ გვხვდება თავისუფალი სახით, მაგრამ მინერალებში გვხვდება სხვადასხვა დაჟანგულობის რიცხვით. ინდუსტრიაში მოლიბდენის შენაერთები გამოიყენება მაღალი წნევისა და მაღალი ტემპერატურის პირობებში როგორიცაა პიგმენტები და კატალიზატორი.
მოლიბდენის მინერალები დიდი ხანია ცნობილია, მაგრამ როგორც ელემენტი აღმოჩენილი იქნა 1778წ კ.შეელეს მიერ. მეტალი პირველად 1781წელს გამოყოფილ იქნა პ.ჰელმის მიერ.
მოლიბდენის ნაერთების უმეტესობა წყალში მცირედ ხსნადია, მაგრამ მოლიბდენ–შემცველი მინერალების ჟანგბადტან და წყალბადთან ურთიერთქმედების დროს მას შეუძლია წარმოქმნას MnO42- წყალში ხსნადი იონით.
დახასიათება
ფიზიკური თვისებები
თავისუფალი სახით მოლიბდენი წარმოადგენს მოვერცხლისფრო მეტალს, რომლის სიმაგრე უდრის 5.5(მოხის შკალით), მისი ლღობის ტემპერატურაა 2.63°C (4.753°F). იმ ელემენტებიდან, რომლებიც გავრცელებულია ბუნებაში, მხოლოდ ტიტანს, ოსმიუმს, რენიუმს, ვოლფრამს და ნახშირბადს აქვს უფრო მაღალი ლღობის წერტილი. მოლიბდენი იწვის მხოლოდ 600°C (1.112°F). მას კომერციულად გამოყენებულ მეტალებს შორის გააჩნია ყველაზე დაბალი თერმული გაფართოების კოეფიციენტები
იზოტოპები
ცნობილია მოლიბდენის 32 იზოტოპი ატომური მასით 83–დან 117–მდე და ასევე ოთხი მეტასტაბილური იზოტოპი. შვიდი იზოტოპი გავრცელებულია შენადნობში, რომელთა ატომური მასაა 92,94,95,96,97,98 და 100. ამ ოზოტოპებიდან არასტაბილურია მხოლოდ მოლიბდენ-92 და მოლიბდენ-100. მოლიბდენის ყველა არამდგრადი იზოტოპი იშლება ნიობიუმის, ტექნეციუმის და რუთენიუმის იზოტოპებად.
მოლიბდენ -98 ყველაზე გავრცელებული იზოტოპია. იგი მოიცავს 24.14% მოლიბდენს. მოლიბდენ-100–ის ნახევარდაშლის პერიოდია დაახლოებით 1019 წეი და განიცდის დუბლ–ბეტა დაშლას რუთენიუმ–100–მდე. მოლიბდენის ყველა იზოტოპების მასით 111–დან 117–მდე ნახევრდალის პერიოდია დაახლოებით 150ნწმ.
ნაერთები და ქიმია
მოლიბდენის დაჟანგულობის რიცხვი
-2 Na2[Mo2(CO)10] 0 Mo(CO)6 +1 Na[C6H6Mo] +2 MoCl2 +3 Na3[Mo(CN)]6 +4 MoS2 +5 MoCl5 +6 MoF6
მოლიბდენი გარდამავალი მეტალია, რომლის ელექტროუარყოფითობა პოლინგის შკალის მიხედვით ტოლია 1.8. მისი ატომური მასაა 95.94მ/მოლ. იგი არ ურთიერთქმედებს ჟანგბადთან და წყალბადთან ოთახის ტემპერატურაზე. მაღალ ტემპერატურაზე წარმოიქმნება მოლიბდენის ტრიოქსიდი.
2Mo+3O2 →>2MoO3
მოლიბდენი ამჟღავნებს რამოდენიმე დაჯანგულობის რიცხვს, მდგრადი ნაერთებია: +4 და +6. მოლიბდენის და მისი ნაერთების თვისებები უფრო მეტ მსგავსებას ამჟღავნებენ ვოლფრმთან, ვიდრე ქრომთან. ამის მაგალითს წარმოადგენს მოლიბდენ(III) და ვოლფრამ (III) ნაერთების არასტაბილურობა, შედარებით სტაბილურ ქრომ(III) ნაერთებთან. უმაღლესი დაჟანგულობის რიცხვი, მოლიბდენ (VI) არის (MoO3) ოქსიდში, ხოლო ნორმალური გოგირდნაერთია–მოლიბდენის დოსულფიდი MoS2.
მოლიბდენ (VI) ოქსიდი იხსნება ძლიერ ტუტეებში და წარმოქმნის (MoO4). მოლიბდატები ქრომატებთან შედარებით სუსტი დამჟანგველებია, მაგრამ ისინი ამჟღავნებენ ტენდენციას წარმოქმნან ოქსიანიონის კომპლექსები [Mo7O24]6- და [Mo8O26]4- დაბალი PH–ის დროს კონდენსაციით. პოლიმოლიბდატები შეიძლება გაერთიანდეს სხვა იონებთან და წარმოქმნას პოლიქრომეტალები. მუქი ლურჯი, ფოსფორშემცველი ჰეტეროპოლიმოლიბდატი P[Mo12O40]3-, გამოიყენება ფოსფორის სპექტროსტოპული აღმოჩენისთვის. მოლიბდენი დაჟანგულობის რიცხვის ფართო სპექტრს აჟღავნებს სხვადასხვა მოლიბდენ–ქლორიდებში.
- მოლიბდენ (II) ქლორიდი, MoCl2 (მყარი, ყვითელი)
- მოლიბდენ (III) ქლორიდი MoCl3 (მყარი, მუქი წითელი)
- მოლიბდენ (IV) ქლორიდი MoCl4 (მყარი, შავი)
- მოლიბდენ (V) ქლორიდი MoCl5 (მყარი, მუქი მწვანე)
- მოლიბდენ(VI) ქლორიდი MoCl6 (მყარი, ყავისფერი)
MoCl2 –ის სტრუქტურა შეადგენს Mo6Cl84- ჯგუფისგან, სადაც ოთხი ქლორიდ იონი ახდენს მუხტის კომპოზიციას. ქრომის და სხვა გარდამავალი მეტალების მსგავსად მოლიბდენს შეუძლია წარმოქმნას ოთხმაგი ბმები ნაერთში როგორიცაა Mo2(Cu3COO)4. ეს ნაერთი შეიძლება გარდაიქმნას Mo2Cl84-, რომელსაც ასევე გააჩნია ოთხმაგი ბმები. დაჟანგულობის რიცხვი 0, შესაძლებელია ნახშირბადის მონოქსიდთან , როგორც ლიგანდი, მაგალითად მოლიბდენ ჰექსაკარბონილში Mo(CO)6.
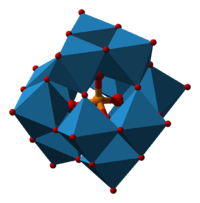
ფოსფომოლიბდატის ანიონის ჯეგინის სტრუქტურა (P[Mo12O40]3−)
ისტორია
მოლიბდენიტი – ძირითადი საბადო, რომლისგანაც ამჟამად ხდება მოლიბდენის ექსტაქცია, ადრე ცნობილი იყო „molybdena”-ს სახელით ხშირად ეშლებოდათ, რომ იგი იყო გრაფიტი. მაშინაც კი, როდესაც, „molybdena” გამოყოფილი იქნა გრაფიტისაგან ,მას მიიჩნევდნენ ტყვიის საბადოდ (ამჯამად ეწოდება გალენა), რომელმაც თავისი სახელი მიიღო ძველი ბერძნული სიტყვიდან „molybdos” – რაც ნიშნავს ტყვიას. 1754 წელს ბ.ოვისთმა გამოცადა მოლიბდენიტი და განსაზღვრა, რომ ის არ შეიცავდა ტყვიას და ამდენად არ იყო იგივე გალენიტი.
1778წ შვედმა ქიმიკოსმა კ.შეელემ დაადგინა, რომ „molybdena” არ იყო არც გრაფიტი და არც ტყვია. მან აუწყა სხვა ქიმიკოსებს, რომ ეს იყო ახალი ელემენტის საბადო – სახელად მოლიბდენი, რომლის მინერალშიც ის იყო აღმოჩენილოი. პ.ჯელმა წარმატებით გამოიყო მოლიბდენი თავისუფალი სახით 1781წელს.
გავრცელება
მოლიბდენის და მისი ნაერთების უდიდესი მსოფლიო მწარმოებლებია: აშშ, ჩილე, პერუ და კანადა. მოლიბდენი გვხვდება მინერალებში – ვულფენიტი (PbMoO4) და პოველიტი (CaMoO4). მოლიბდენის ძირითადი კომერციული წყაროა მოლიბდენიტი (MoS2). იგი ხშირად ბიპროდუქტის სახით გვხვდება სპილენძისა და ვოლფრამის საბადოებში. კალორადოს და „British Columbia” საბადოები იძლევა მოლიბდენს. 1885 წელს 1995წლამდე ნორვეგიის სამხრეთ ნაწილში ახდენენ მოლიბდენის საბადოს დამუშავებას.
მოლიბდენი გავრცელების მიხედვით წარმოადგენს 54-ე ელემენტს დედამიწის ქერქში და 25–ე ელემენტს. ოკეანეში, საშუალოდ მილიარდის მეათედი წილი. იგი 42-ე ელემენტია გავრცელების მიხედვით მთელ სამყაროში. რუსელმა მთვარეზე პიროქსენის ფრაგმენტებში აღმოაჩინა მოლიბდენის შემცველი მრავალი (1×0.6µm)26.

მოლიდბენიტი კვარცზე
მიღება
თავდაპირველად, მოლიბდენიტის გაცხელებით 700°C ტემპერატურაზე (1.292°F) და შემდგომ მიღებული სულფიდის დაჟანგვით ჰაერზე, მიიღება მოლიბდენ(VI) ოქსიდი.
2MoS2+7O2 → 2MoO3+4SO2
მოლიბდენ(VI) ოქსიდი, ამიაკთან ურთიერთქმედებით ოძლევა წყალში ხსნად მოლიბდატს:
MoO3+2MN4OH->(NH4)2(MoO4)+H2O
მოლიბდენიტი სპილენძის მონარევებით ამიაკში ნაკლებ ხსნადია. ხსნარიდან მისი გამოყოფა ხდება გოგირდწყალბადით გამოლექვით. სუფთა მოლიბდენი მიიღება ოქსიდის წყალბადით აღდგენის დროს, მაშინ როცა მოლიბდენი ფოლადისათვის მიიღება ალუმინოთერმიის რეაქციებით აღდგენის დროს. ამ დროს ამატებენ რკინას და მიირება ფერომოლიბდენი, რომელიც შეიცავს 60% მოლიბდენს.
2009 წლის (აგვისტო) მონაცემებით, მოლიბდენი აწარმოეს დაახლოებით 530.000ტონა. მისი ფასი 1997–დან 2003 წლამდე იყო 10.000$ 1ტონაზე და 2005წ მიაღწია 103.000$ 1ტონაზე.
გამოყენება

MoSi2-ის გამახურებელი ელემენტი
მოლიბდენისთვის დამახასიათებელი მდგრადობა ექსტრემულ ტემპერატურაზე მნიშვნელოვანი დანაკარგების გარეშე და დრეკადობა შესაძლებლობას იძლევა იგი გაცხელებით ინტენსიურად და გამოვიყენოთ თვითმფრინავების ნაწილების ელექტრული კონტაქტების ინდუსტრიული ძრავების და ბოჭკოების წარმოებაში.
მაღალი მდგრადობის ფოლადის შენადნობი (მაგალითად 41xx ფოლადი), შეიცავს 0.25%–დან 8%–მდე მოლიბდენს. მიუხედავად მოლიბდენის ასეთი მცირე ნაწილისა, 43 000 ტონაზე მეტი მოლიბდენი ყოველწლიურად გამოიყენება, როგორც შემადნობელი აგენტი ნაკლებად ჭიმვად ფოლადში, ინსტრუმენტებში თუჯის და მაღალტემპერატურულ ზეშენადნობებში.
მოლიბდენი ფილადის შენადნობებში გამოიყენება მაღალი კოროზიამედეგობის და შედუღების უნარის გამო.
დაბალი სიმკვრივისა და სტაბილური ფასების გამო მოლიბდენი ზოგჯერ გამოიყენება ვოლფრამის ნაცვლად ამის მაგალითია „M“ სერიის, ადვილად საჭრელი ფოლადი, როგორიცაა M2, M4 და M42 “T” სერიის ფოლადის ჩანაცვლება, რომელიც შეიცავს ვოლფრამს. მოლიბდენი აგენტი, ასევე სხვა მეტალებისთვის ცეცხლგამძლე შესაფუთ მასალად. მიუხედავად იმისა, რომ მოლიბდენის ლღობის ტემპერატურა 6.623°C (4.753°F), იგი 760° C ტემპერატურაზე ზემოთ გამოსაყენებელი ვაკუუმ გარემოში.
TZM (Mo-99%),Ti(~0.5%),Zr(~0.08%) და მცირეოდენი ნახშირბადი წარმოადგენს მოლიბდენის კოროზიულად მდგრად ზეშენადნობს, რომელიც მდგრადია გამლღვარი ფტორიდ მარილების მიმართ 1300°C ტემპერატურაზე. იგი ორჯერ უფრო მაგარია, ვიდრე სუფთა Mo და მეტად დრეკადია და ადვილად შესადუღებელია.
მოლიბდენის სხვა შენადნობების, რომლებიც არ შეიცავენ რკინას, აქვთ შეზღუდული გამოყენება. კოროზიამედეგი მოლიბდენი და მოლიბდენ/ვოლფრამის (70%/30%) გამოიყენება გამლღვარი ცინკის საწინააღმდეგოდ. ეს საშუალებას იძლევა გამოვიყენოთ იგი წყალსაქაჩ ტუმბოებში, ძრავებში, სხვადასხვა მოლგაყვანილობაში, რომელიც კი შედის კონტაქტში გამლღვარ ცინკთან. მეტალური მოლუბდენი მიშვნელოვანი კონსტრუქციული მასალაა ელექტროგანათებელი ნათურების წარმოებაში და ელექტროვაკუუმ დანადგარებში (რადიონათურები, გენერატორის ნათურები, რენტგენის მილები და სხვა.), სადაც მოლიბდენის მავთულისაგან, ამზადებენ სხვადასხვა დეტალებს: როგორიცაა ანოდი, კათოდები, ძაფების დამჭერი და სხვა.
ბოლო ხანებში მოლიბდენი გამოიყენება იმ შემთხვევაში როცა აუცილებელია მაღალ ტემპერატურაზე გამძლეობის შენარჩუნება. მაღალ ტემპერატურაზე დაჯანგვისაგამ დასაცავად იყენებენ მეტალს დაფარვას მოლიბდენის სილიციდია. ტექნიკაში MoS2 იყენებენ, როგორც საცხის მასალას. ნატრიუმის მოლიბდატი გამოიყენება საღებრების და ლაქების წარმოებაში. მოლიბდენ-99 გამოიყენება მრავალ სამედიცინო პროცედურებში.
მოლიბდენის ფხვნილი გამოიყენება სასუქად ზოგიერთი მცენარეებისთვის (მაგალითად ყვავილოვანი კომბოსტოსთვის). მოლიბდენ ტრიოქსიდი გამოიყენება ემალსა და მეტალს შორის, როგორც მისაწებებელ სადგეზიურის ნაერთი ტყვისს მოლიბდატი (ვულფენიტი) ილექება ტყვიის ქრომატთან და ტყვიის სულფატთან ერთად მოწითალო–ფორთოხლისფერი პიგმენტის სახით გამოიყენება კერამიკასა და პლასტმასთან ერთად.
ამონიუმის ჰეფტამოლიბდატი გამოიყენება ბიოლოგიურ პროცედურებში (ფერად რეაქციებში).
მოლიბდენი აგრეთვე გამოიყენება NO, NO2, NOx ანალიზატორებში, მცენარეების დაბინძურების კონტროლისათვის. 350°C (662°F) მოლიბდენი, როგორც კატალიზატორი ურთიერთქმედებს NO2/NO –თან და წარმოქმნის მხოლოდ NO–ს მოლეკულებს, რომელიც ვლინდება ინფრაწითელი სხივებით.
ბიოქიმია
ცოცხალ ორგანიზმებში მოლიბდენის მნიშვნელოვანი გამოყენება არის ის, რომ იგი, როგორც ჰეტეროატომი მდებარეობს ენზიმის ცენტრში. ზოგიერთ ბაქტერიაში აზოტის ფიქსაციის დროს, ენიზმი ნიტროგენაზა შეიცავს მოლიბდენს აქტიურ ცენტრში. (ზოგჯერ მოლიბდენი ჩანაცვლებულია რკინით ან ვანადიუმით).
ადამიანის ორგანიზმი შეიცავს 0.07მგ მოლიბდენს (წონითი წილი ყოველ კილოგრამზე). იგი დიდი რაოდენობით გვხვდება ღვიძლში და თირკმელში, მცირე რაოდენობითაა ხერხემალში. მოლიბდენი ასევე გვხვდება ადამიანის კბილის ემალში და ხელს უშლის კბილის დაშლას. ღორის, ბატკნის და ძროხის ღვიძლი, თითოეული შეიცავს დაახლოებით მოლიბდენის 1.5მნ. სხვა მნიშვნელოვანი დიეტური საკვები, როგორიცაა მწვანე პარკოსანი მცენარეები ოსპა, კიტრი, პურის მარცვალი და სხვა. მცირე რაოდენობით ასევე შეიცავენ მოლიბდენს. მოლიბდენის დღიური საშუალო რაოდენობა 0.12–დან 0.24მგ–მდე, მაგრამ ეს დამოკიდებულია საჭმელში მოლიბდენის რაოდენობაზე. ვირთხებზე ექსპერიმენტმა უჩვენა, რომ საშუალო ლეტარული დოზა (LD50), დაბალია 180მგ/კგ რომელსაც ექსპერიმენტულ ცხოველებზე აძლევდნენ მოლიბდენის ნაერთების სახით.
ნაჩვენები იყო აგრეთვე, რომ ადამიანებში მოლიბდენის რაოდენობა 10მგ/დღეში თუ აღემატება, მას შეუძლია გამოიწვიოს დიარეა, ზრდის შენელება, წონაში კლება და ასევე პადაგრა. იგი ასევე გავლენას ახდენს ფილტვებზე, თირკმელებზე და ღვიძლზე. ნიტრიუმის მოლიბდატი წარმოადგენს მოლიბდენის ინჰიბიტორს. დიეტური ვოლფრამი აღადგენს მოლიბდენის კონცენტრაციას ქსოვილებში. მოლიბდენის მტვერი და ორთქლი ტოქსიკურია განსაკუთრებით, თუ მისი შეწოვის დროს მოლიბდენის მცირე რაოდენობამ შეიძლება გამოიწვიოს თვალების და კანის გაღიზიანება და მისი ოქსიდების 60–დან 600მგ/გ3 რაოდენობასთან ხშირმა შეხებამ შეიძლება გამოიწვიოს დაღლილობა, თავის ტკივილი და სახსრების ტკივილი.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით


