| წინა ელემენტი |
|
შემდეგი ელემენტი |
სახე

მოვერცხლისფერო-თეთრი
ძირითადი თვისებები
| დასახელება, სიმბოლო, ნომერი |
ცირკონიუმი, Zr, 40 |
| წარმოთქმა |
|
| ელემენტის კატეგორია |
გარდამავალი მეტალი |
| ჯგუფი, პერიოდი, ბლოკი |
4, 5, d |
| ატომური მასა |
91.224 გ მოლი-1 |
| ელექტრონული კონფიგურაცია |
[Kr] 5s2 4d2 |
| ელექტრონები ორბიტალებზე |
2, 8, 18, 10, 2 |
ფიზიკური თვისებები
| აგრეგატული მდგომარეობა |
მყარი |
| სიმკვრივე |
6.52 გ სმ-3 |
| სიმკვრივე თხევად მგდომარეობაში (ლღობის ტემპერატურაზე) |
5.8 გ სმ-3 |
| ლღობის ტემპერატურა |
2128 K, 1855 ˚C |
| დუღილის ტემპერატურა |
4682 K, 4409 ˚C, 7968 ˚F |
| კრიტიკული წერტილი |
|
| დნობის სითბო |
14 კჯ მოლი-1 |
| აორთქლების სითბო |
573 კჯ მოლი-1 |
| სპეციალური სითბოტევადობა |
(25 ˚C) |
| ორთლის წნევა | ||||||||||||||
|
ატომური თვისებები
| ჟანგვითი რიცხვები |
4, 3, 2, 1 |
| ელექტროუარყოფითობა |
1.33 (პოლინგის შკალა) |
| იონიზაციის ენერგიები |
I: 640.1კჯ·მოლი−1 |
| ატომური რადიუსი |
160 pm |
| კოვანელტური რადიუსი |
175 pm |
| ვან დერ ვაალსის რადიუსი |
pm |
სხვადასხვა
| კრისტალური სტრუქტურა |
ჰექსაგონალური close-packed |
| მაგნიტური მოწესრიგებულობა |
პარამაგნიტური |
| კუთრი ელექტრული წინაღობა |
(20˚C) 421ნΏ მ |
| სითბოგამტარობა |
(300 K) 22.6 ვტმ-1K-1 |
| სითბოგადაცემა |
(25˚C) 5.7 µm m-1K-1 |
| ბგერის სიჩქარე |
(20˚C) 3800მ/წმ |
| იუნგის მოდული |
88 გპა |
| შერის მოდული |
33 გპა |
| ბულკის მოდული |
91.1 გპა |
| სიმტკიცე მოსის მიხედვით |
5.0 |
| CAS-ის რეფისტრაციის ნომერი |
7440-67-7 |
მდგრადი იზოტოპები
| იზოტოპი | NA | ნახევარ-სიცოცხლე | DM | DE(MeV) | DP |
| 88Zr | სინთ | 83.4 d | ε | - | 88 Y |
| γ | 0.392 D | - | |||
| 89Zr | სინთ | 78.4 h | ε | - | 89 Y |
| β+ | 0.902 | 89 Y | |||
| γ | 0.909 D | - | |||
| 90Zr | 51.45% | 90Zr სტაბილურია with 50 ნეიტრონით | |||
| 91Zr | 11.22% | 91Zr სტაბილურია 51 ნეიტრონით | |||
| 92Zr | 17.15% | 92Zr სტაბილურია 52 ნეიტრონით | |||
| 93Zr | კვალი | 1.53×106 y | β− | 0.060 | 93Nb |
| 94Zr | 17.38% | 1.1×1017 y | β−β− | - | 94Mo |
| 96Zr | 2.8% | 2.0×1019 y | β−β− | 3.348 | 96Mo |
ცირკონიუმი
ცირკონიუმი
ცირკონიუმი Zr ქიმიური ელემენტია ატომური ნომრით 40. მისი ატომური მასა 91.224. იგი მბზინავი, რუხი–თეთრი ფერის, გარდამავალი მეტალია და ჰგავს ტიტანს. ცირკონიუმი გამოიყენება როგორც შემლღობი აგენტი კოროზიამედეგობის გამო. ბუნებაში ცირკონიუმი თავისუფალი სახით არ მოიპოვება. იგი ძირითადად მიიღება მინერალ ცირკონისაგან, რომელიც შეიძლება გასუფთავდეს ქლორით. ცირკონიუმი სუფთა სახით პირველად მიღებულ იქნა 1824 წელს ჯ.ბერცელიუსის მიერ.
ცირკონიუმს ბიოლოგიური როლი არ არის ცნობილი. იგი წარმოქმნის როგორც არაორგანულ, ასევე ორგანულ ნაერთებს, როგორიცაა ცირკონიუმის დიოქსიდი. შესაბამისად არსებობს ხუთი ბუნებრივი იზოტოპი, რომელთაგან სამი სტაბილურია. ცირკონიუმის ფხვნილი იწვევს მცირეოდენ გაღიზიანებას, ხოლო მისი ნაერთების შესუნთქვას შეუძლია გამოიწვიოს კანის და ფილტვების დანაწევრება.
დახასიათება
ცირკონიუმი მბზინავი, მორუხო–თეთრი ფერის, რბილი, დრეკადი, ადვილად დასამუშავებელი მეტალია, რომელიც ოთახის ტემპერატურაზე მყარია. იგი დაბალი სისუფთავის დროს ხდება მძიმე და მყიფე. ცირკონიუმი ფხვნილის სახით აალებადია, მაგრამ მყარი ფორმით ძნელად იწვის. იგი ძლიერ მდგრადია ტუტეების, მჟავების, მარილთა ხსნარებისა და სხვა აგენტების მოქმედებით გამოწვეული კოროზიის მიმართ, მაგრამ ფტორის თანაობისას იხსნება ქლორწყალბადმჟავასა და გოგირდმჟავაში. შენადნობი თუთიასთან მაგნიტური ხდება 35k ტემპერატურაზე ქვემოთ.
ცირკონიუმის ლღობის ტემპერატურაა 1855 °C, ხოლო დუღილის ტემპერატურა - 4409°C. მისი ელექტროუარყოფითობა 1.33 ტოლია . d – ჯგუფის ელემენტებს შორის, ცირკონიუმს იტრიუმის ლუტეციუმის და ჰაფნიუმის შემდეგ აქვს უდაბლესი ელექტროუარყოფითობა.
გამოყენება
ცირკონიუმი თავისი შესანიშნავი კოროზომედეგობის გამო, ხშირად გამოიყენება შენადნობებში, როგორც კოროზიის საწინააღმდეგო აგენტი, ცირკონიუმის დიოქსიდი (ZrO2) გამოიყენება ლაბორატორიულ ტიგელებში, მეტალურგიულ ბრძმედებში, როგორც გამძლე მასალა. ცირკონით (ZrSiO4) იჭრება ნახევრად დამუშავებული ძვირფასი ქვები, რომელთაც იყენებენ საიუველირო საქმეში. ცირკონიუმის კარბონატი (3ZrO2•CO2•H2O) გამოყენებული იყო ლოსიონებში, მაგრამ შემდგომში შეწყვიტეს, რადგანაც კანს აღაგზნებდა.
ცირკონიუმის წარმოების 90% გამოიყენება ბირთვულ რეაქციებში (ცირკონიუმის შენადნობის მისაღებად), რადგანაც იგი ნეიტრონებს ნაკლებად აკავებს და კოროზიულად მდგრადია. იგი შედის ზოგიერთ სალეს მასალაში. ცირკონიუმი გამოიყენება შეიარაღებაში როგორც BLU-97/B, რომელსაც აქვს ცეცხლაალების ეფექტურობა. ცირკონიუმის ფხვნილი მაგნიუმთან ერთად (60% Zr და 40% Mg) იხმარება უკვალო აალებისთვის. ZrO2 გამოიყენება ცეცხლგამძლე ჭურჭლის წარმოებაში. ცირკონიუმის ორჟანგი და მისი ზოგიერთი სხვა ნაერთი (სილიკატი, კარბონატი, ფოსფატი) იხმარება როგორც თეთრი მინერალური საღებარი და აგრეთვე მინანქრის წარმოებაში ცირკონიუმის კარბიდი გამოყენებას პოულობს მინის საჭრელად და როგორც სახეხი მასალა, აგრეთვე გამოიყენება ელ.ნათურების ძაფებად.
ისტორია
ცირკონიუმის შემცველი მინერალი -ცირკონი და აგრეთვე მისი სხვადასხვა ვარიაციები (ჯარგენი, ბიასინთი, ჯისინთი, ლიგარი) მოიხსენიება ჯერ კიდევ ბიბლიურ წერილებში. 1789 წლამდე არ იყო ცნობილი, რომ მინერალი შეიცავდა ახალ ელემენტს. კლაპროტმა (რომელმაც ჩაატარა ჯარგუნის ანალიზი კუნძულ ცეილონიდან ახლანდელი შრილანკა) ახალ ელემენტს უწოდა ცირკონერდი (ცირკონი). ჰ.დევი შეეცადა ეს ახალი ელემენტი 1808 წელს გამოეყო ელექტროლიზით, მაგრამ ვერ შეძლო. ცირკონიუმი (სირიული – zargono, არაბული zurken, სპარსული zungun – ნიშნავს „ოქროს მსგავსს") პირველად 1824 წელს სუფთა სახით გამოყო ჯ.შერცელიუსმა კალიუმისა და კალიუმ–ცირკონიუმ ფტორიდის ნარევის გაცხელებით. შემდგომ სახელმა განიცადა ადაპტირება გერმანულად - zirkon , შემდგომში ინგლისურად zirkon და zirconium (ცირკონიუმი).
სუფთა მეტალური ცირკონიუმი კომერციული მიზნებისათვის პირველად მიიღო ა.არკელმა და ჯ.ბოიერმა 1925წ. პროცესი მოიცავდა ცირკონიუმტეტრაიოდიდის დაშლას. იგი შემდგომში 1945წ ჩაანაცვლა უფრო იაფი, კროლის პროცესმა, რომელშიც ცირკონიუმტეტრაქლორიდი იხლიჩებოდა მაგნიუმით.
ცირკონიუმი ეკუთვნის გაბნეული მეტალების რიცხვს. დედამიწის ქერქში მისი კონცენტრაცია შეადგენს დაახლოებით 130მმ/კგ და დაახლოებით 0.026 μმ/ლ – ზღვის წყალში.
იგი არასოდეს არ გვხვდება ბუნებაში სუფთა მეტალის სახით. ცირკონიუმის ძირითადი სამრეწველო წყაროა ცირკონიუმ–სილიკატ მინერალი – ცირკონი (ZrSiO4), რომელიც გვხვდება ავსტრალიაში, ბრაზილიაში, ინდოეთში, რუსეთში, სამხრეთ აფრიკასა და აშშ–ში. მისი დეპოზიტები მთელ მსოფლიოში მცირე რაოდენობით გვხვდება. ცირკონის 80% არის ავსტრალიასა და აფრიკაში. მისი რესურსი მსოფლიოში აღწევს 60 მილიონ მეტრ ტონას, ხოლო ყოველწლიური მსოფლიო წარმოება შეადგენს დაახლოებით 900 000 მტ–საგან.
ცირკონიუმი წარმოადგენს ტიტანის მინერალის ილუმინიტის და რუტილის საბადოების გადამუშავების ბიპროდუქტს.
2003–დან 2007წ–მდე ცირკონიუმის ფასი გაიზარდა $360–დან $840–მდე. ცირკონიუმი აგრეთვე გვხვდება 140–ზე მეტ მინერალში, მათ შორის ბადელიტსა და კოსნარიტში. მეტალი კომერციულად მიიღება ცირკონიუმ (IV) ქლორიდის აღდგენით მეტალური მაგნიუმის საშუალებით (კროლ–პროცესში).
ცირკონიუმი გვხვდება S–ტიპის ვარსკვლავებზე და იგი აგრეთვე აღმოჩენილია მზეზე და მეტეორიტებში.
ბიოლოგიური როლი
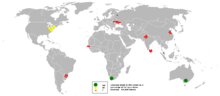
ცირკონიუმის მოპოვება 2005 წელს
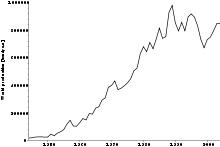
ცირკონიუმის მარილების მსოფლიო წარმოება

ცირკონიუმის ზოდი
ცირკონიუმის ბიოლოგიური როლი არ არის ცნობილი, თუმცა მის მარილებს აქვთ დაბალი ტოქსიკურობა. ადამიანის ორგანიზმი შეიცავს, საშუალოდ, მხოლოდ 1 მლგ ცირკონიუმს და დღიურად იგი ღებულობს დაახლოებით 50μგ – დღეზე. ცირკონიუმის შემცველობა ადამიანის სისხლში 10 მილიონზე ნაკლებია. წყალმცენარეები იწოვენ ხსნად ცირკონიუმს, რაც იშვიათია ხმელეთის მცენარეებში. მცენარეების 70% არ შეიცავს ცირკონიუმს, ხოლო ვინც შიცავს იგი არ აღემატება 5 მილიარდს.
ცირკონიუმი, როგორც გარდამავალი მეტალი, წარმოქმნის მრავალ არაორგანულ ნაერთს, როგორიცაა ცირკონიუმის დიოქსიდი (ZrO2). ეს ნაერთი, რომელსაც ასევე მოიხსენიებენ, როგორც ცირკონია, წარმოადგენს ქიმიურად მდგრად ნაერთს, განსაკუთრებით კუბურ ფორმაში. ამ თვისებების გამო იგი გამოიყენება თერმულ ბარიერული დანაფარების მისაღებად. იგი აგრეთვე ანაცვლებს ალმასს. ცირკონიუმის ვოლფრამის მჟავას მარილი, წარმოადგენს არაჩვეულებრივ ნივთიერებას, რომელშიც ის იკუმშება გაცხელებისას, მაშინ როცა უმეტესი ნაერთები გაცხელებისას ფართოვდება. ZrZn2 ერთ–ერთი ამათგანია, რომელიც ამჟღავნებს ზეგამტარ თვისებებს და ახასიათებს ფერომაგნიტიზმი, ცირკონიუმის სხვა არაორგანული ნაერთებია ცირკონიუმ (III) ჰიდრიდი, ცირკონიუმ ნიტრიდი და ცირკონიუმ ტეტრაქლორიდი (ZrCl4) გამოიყენება ფროდელ–კრაფტსის რეაქციებში.
ორგანოცირკონიუმის ქიმია. შეისწავლის ნაერთებს, რომელებიც შეიცავენ კარბონ – ცირკონიუმ ბმას. ისინი უმეტესაც გამოიყენებიან, როგორც პოლიმერიზაციის კატალიზატორები. პირველი ასეთი ნაერთი, ცირკონოცენ დიბრომიდი, მიღებული იქნა 1952წ ჰარვარდის უნივერსიტეტში მ.ბირმანგამის მიერ. 1970წ მიღებულ იქნა მეტალოცენი, რომელიც გამოიყენება ორგანულ სინთეზში ალკენების და ალკინების გარდასაქმნელად.
იზოტოპები. ბუნებრივი ცირკონიუმი გვხვდება ექვსი იზოტოპის სახით, 90Zr, 91Zr და 92Zr სტაბილურებია.94Zr –ის ნახევარდაშლის პერიოდი 1*10*1017 წელი, 96Zr–ის ნახევარდაშლის პერიოდია 2.4*1019 წელი, რომელიც წარმოადგენს ყველაზე დღეგრძელ რადიოიზოტოპს. ამ ბუნებრივი იზოტოპებიდან 90Zr ყველაზე გავრცელებულია, იგი შეიცავს მხოლოდ 2.80% ცირკონიუმს.
სინთეზირებულია 28 ხელოვნური იზოტოპი, რომელთა ატომური მასებია 78–დან 110–მდე. მათ შორის 93Zr ყველაზე დღეგრძელი იზოტოპია (ნახევარდაშლის პერიოდია 1.53*106). 110Zr (ცირკონიუმის ყველაზე მძიმე იზოტპის) ნახევარდაშლის პერიოდია 30 მილიწამი. ცირკონიუმს აგრეთვე აქვს ექვსი მეტასტაბილური იზოტოპი: 83mZr, 85mZr, 89mZr, 90m1Zr, 90m2Zr და 91mZr. მათგან 90m2Zr–ის ნახევარდაშლის პერიოდია 4.161 წთ.
ტოქსიკურობა
ცირკონიუმის ფხვნილმა შეიძლება გამოიწვიოს თვალის გაღიზიანება, ხოლო ცირკონიუმის ნაერთების ჩასუნთქვამ კი შეიძლება გამოიწვიოს ფილტვების და კანის დასკდომა. ცირკონიუმის ტეტრაქლორიდი ზრდის ვირთხებისა და ზღვის გოჭების სიკვდილიანობას . ასევე ძაღლებში დაბლა წევს ჰემოგლობინს და სისხლის წითელ უჯრედებს. OSHA რეკომენდაციას იძლევა საშუალოდ ხანმოკლე დასხივებისას მიღებულ იქნეს 5მგ/მ3– დან 10მგ/მ3–მდე რაოდენობით.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით


