| წინა ელემენტი |
|
შემდეგი ელემენტი |
სახე

შავი, ნაცრისფერი და წითელი ალოტროპიები
ძირითადი თვისებები
| დასახელება, სიმბოლო, ნომერი |
სელენი, Se, 34 |
| წარმოთქმა |
|
| ელემენტის კატეგორია |
არამეტალი |
| ჯგუფი, პერიოდი, ბლოკი |
16, 4, p |
| ატომური მასა |
78.96 გ მოლი-1 |
| ელექტრონული კონფიგურაცია |
[Ar] 4s2 3d10 4p4 |
| ელექტრონები ორბიტალებზე |
2, 8, 18, 6 |
ფიზიკური თვისებები
| აგრეგატული მდგომარეობა |
მყარი |
| სიმკვრივე |
(ნაცრისფერი) 4.81, (ალფა) 4.39, (მინისებრი) 4.28 გ სმ-3 |
| სიმკვრივე თხევად მგდომარეობაში (ლღობის ტემპერატურაზე) |
3.99 გ სმ-3 |
| ლღობის ტემპერატურა |
494 K, 221˚C |
| დუღილის ტემპერატურა |
958 K, 685 ˚C, 1265 ˚F |
| კრიტიკული წერტილი |
|
| დნობის სითბო |
(ნაცრისფერი) 6.69 კჯ მოლი-1 |
| აორთქლების სითბო |
95.48 კჯ მოლი-1 |
| სპეციალური სითბოტევადობა |
(25 ˚C) |
| ორთლის წნევა | ||||||||||||||
|
ატომური თვისებები
| ჟანგვითი რიცხვები |
6, 4, 2, 1, -2 |
| ელექტროუარყოფითობა |
2.55 (პოლინგის შკალა) |
| იონიზაციის ენერგიები |
I: 941.0 კჯმოლი-1 |
| ატომური რადიუსი |
120 pm |
| კოვანელტური რადიუსი |
120±4 pm |
| ვან დერ ვაალსის რადიუსი |
190 pm |
სხვადასხვა
| კრისტალური სტრუქტურა |
ჰექსაგონალური |
| მაგნიტური მოწესრიგებულობა |
დიამაგნიტური |
| კუთრი ელექტრული წინაღობა |
(20˚C) ___ ნΏ მ |
| სითბოგამტარობა |
(300 K) (ამორფ) 0.519 ვტმ-1K-1 |
| სითბოგადაცემა |
(25˚C) (ამორფ) 37 µm m-1K-1 |
| ბგერის სიჩქარე |
(20˚C) 3350 მ/წმ |
| იუნგის მოდული |
10 გპა |
| შერის მოდული |
3.7 გპა |
| ბულკის მოდული |
8.3 გპა |
| სიმტკიცე მოსის მიხედვით |
2.0 |
| CAS-ის რეფისტრაციის ნომერი |
7782-49-2 |
მდგრადი იზოტოპები
| იზოტ. | NA | ნახევარ-სიცოცხლე | DM | DE(MeV) | DP |
| 72Se | სინთ. | 8.4 დღე | ε | - | 72As |
| γ | 0.046 | - | |||
| 74Se | 0.87% | 74Se მდგრადია 40 ნეიტრონით | |||
| 75Se | სინთ. | 119.8 დღე | ε | - | 75As |
| γ | 0.264, 0.136, 0.279 |
- | |||
| 76Se | 9.36% | 76Se მდგრადია 42 ნეიტრონით | |||
| 77Se | 7.63% | 77Se მდგრადია 43 ნეიტრონით | |||
| 78Se | 23.78% | 78Se მდგრადია 44 ნეიტრონით | |||
| 79Se | კვალი | 2.95×105 წ | β- | 0.151 | 79Br |
| 80Se | 49.61% | 80Se მდგრადია 46 ნეიტრონით | |||
| 82Se | 8.73% | 1.08×1020 წ | β-β- | 2.995 | 82Kr |
სელენი
სელენი (სიმბოლო -Se) ქიმიური ელემენტია ატომური ნომრით 34. მისი ატომური მასაა 78.96. სელენი არამეტალია, ქიმიურად ენათესავება გოგირდს და ტელურს, იგი ბუნებაში თავისუფალი სახით იშვიათად გვხვდება .
სელენი შვიდი სხვადასხვა ფორმითაა გამოყოფილია, რომელთა შორის ყველაზე სტაბილურია მუქი წითელი-მოსერო ფერის, რომელიც სტრუქტურულად წარმოადგენს ტრიგონალურ პოლიმერულ ჯაჭვს. იგი სინათლეზე დენს უკეთესად ატარებს, ვიდრე სიბნელეში და გამოიყენება ფოტოელემენტებში. სელენი აგრეთვე წარმოქმნის მრავალ არაგამტარ ფორმას. შავი, მინისმაგვარი ალოტროპია, ასევე სხვადასხვა წითელი კრისტალური ფორმა, რომელიც აგებულია მისი მონათესავე გოგირდის მსგავსად რვაწევრიანი მოლეკულების რიგისაგან.
სელენი მცირე რაოდენობით ნაპოვნია გოგირდის საბადოებში, მაგ. პირიტში, აგრეთვე ცნობილია სელენიდებისა და სელენატების საბადოები, მაგრამ ისინი საკმაოდ იშვიათია. დღეისათვის სელენი ძირითადად გამოიყენება მინის წარმოებაში, ქიმიაში და პიგმენტებში, ასევე გამოიყენება ელექტრონიკაში - ნახევარგამტარებად.
სელენის მარილების დიდი რაოდენობა ტოქსიკურია, მაგრამ მცირე რაოდენობით კვალის სახით აუცილებელიცაა ზოგიერთი (თუ არა ყველასთვის) ცხოველისათვის. ისინი წარმოქმნიან ენზიმს გლუტათიონპეროქსიდს და თიორედუქსინ რედუქტაზს (რომელიც არაპირდაპირ აღადგენს ზოგიერთ დაჟანგულ მოლეკულას ცხოველებსა და ზოგიერთ მცენარეებში) და სამ ცნობილ დიოდინაზას ენზიმს (რომელსაც ერთი ”thyroid hormone ” გადაჰყავს მეორეში).
ისტორია და გლობალური მოთხოვნები

ბუნებრივი სელენიუმი
1817 წელს სელენი (ბერძნული სიტყვიდან ”Moon - მთვარე”) აღმოჩენილ იქნა ჯ. ბერცელიუსის მიერ, რომელმაც ეს ელემენტი აღმოაჩინა ტელურთან ერთად. სელენი აღმოჩენილ იქნა, როგორც გოგირდმჟავას წარმოების თანამდევი პროდუქტი.
სელენი მისი ტოქსიკურობის გამო შედარებით გვიან გამოჩნდა მედიცინაში. იგი აგრეთვე აღიარეს როგორც მნიშვნელოვანი ვეტერინალური ტოქსინი. 1954 წელს აღმოჩენილ იქნა სელენის სპეციფიკური ბიოლოგიური ფუნქცია მიკროორგანიზმებში. 1957 წელს დაადგინეს, რომ იგი აუცილებელია ძუძუმწოვრების სიცოცხლისათვის. 1970 წელს ნაჩვენები იქნა მისი არსებობა ორ სხვადასხვა ენზიმში. ამას მოჰყვა სელენცისტეინის აღმოჩენა პეროტეინებში.
სელენზე მოთხოვნილების გაზრდამ გამოიწვია მისი გამოყენების უფრო ღრმა შესწავლა და გამოჩნდა მისი გამოყენების ახალი მიმართულებები. მაგ.: კაუჩუკის წარმოებაში, ფოლადის შენადნობებში და სელენის რექტიფიკატორების წარმოებაში. სელენი ასევევ წარმოადგენს აუცილებელ მასალას ლაზერულ პრინტერებში და ქსეროქსის ასლგადამღებ დანადგარებში.
გავრცელება
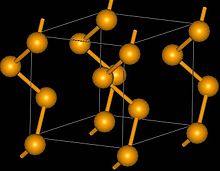
სამკუთხა სელენიუმის სტრუქტურა
სელენი ბუნებაში გვხვდება არაორგანული ფორმით, მათ შორის სელენიდები, სელენატები და სელუნიტები. სელენი ხშირად გვხვდება ნიადაგში სელენატის ხსნადი ფორმით (სულფატის ანალოგიურად).
სელენს გააჩნია ბიოლოგიური როლი. იგი გვხვდება ორგანულ ნაერთებში, როგორიცაა დიმეთილსელენიდი, სელენომეთიონინი, სელენოცისტეინი და მეთილსელენოცისტეინი. ამ ნაერთებში სელენი გოგირდის ანალოგიურ როლს თამაშობს.
სელენი უმეტესად მიიღება სელენიდისაგან, რომელიც არსებობს სულფიდურ საბადოებში, როგორიცაა სპილენძის, ვერცხლის ან ტყვიის სულფიდური საბადოები. იგი ამ საბადოების დამუშავებისას მიიღება როგორც ბიპროდუქტი.
წარმოება და ალოტროპიული ფორმები
ბუნებრივი სელენი იშვიათი მინერალია, რომელიც ჩვეულებრივ არ წარმოქმნის კარგ კრისტალებს, მაგრამ როდესაც წარმოქმნის, მათ აქვთ რომბოედრის ფორმა ან წარმოადგენენ ძალიან თხელ კრისტალებს. სელენის გამოყოფა ხშირად გაძნელებულია სხვა ნაერთების და ელემენტების არსებობით. მისი მიღების საწყის წყაროს წარმოადგენს სპილენძის ელექტროლიტური ქარხნების, გოგირდმჟავას და ცელულოზის წარმოების შლამები.
სელენის სამრეწველო წარმოებაში ხშირად იყენებენ სელენის დიოქსიდის ექსტრაქციას ნალექიდან, რომელიც მიიღება სპილენძის გასუფთავებისას. ზოგადად, სელენის წარმოება იწყება წარმოქმნილი სელენის დიოქსიდის ნატრიუმის კარბონატით დაჟანგვით, რის შემდეგ სელენის დიოქსიდს შეურევენ წყალს და ხსნარს შეამჟავებენ, ამ დროს წარმოიქმნება სელენოვანი მჟავა (ჟანგვის საფეხური), რომელიც შეერევა გოგირდის დიოქსიდს (აღდგენის საფეხური) და მიიღება ელემენტური სელენი, რომელიც ქიმიური რეაქციების დროს გამოიყოფა წითელი, ამორფული ფორმით- უხსნადი, აგურისფერი-წითელი ფხვნილის სახით. ამ ფორმას როდესაც სწრაფად გაალღობენ, მიიღება შავი, მინისებური ფორმა. სელენის თერმოდინამიკურად მდგრადი, მკვრივი ფორმა წარმოადგენს ელექტროგამტარს (რუხი ფერის ტრიგონალური ფორმა), რომელიც შედგება სელენის ატომების გრძელი, ვერტიკალური ჯაჭვებისაგან. ამ ფორმის ელექტროგამტარობა მგრძნობიარეა დასხივების მიმართ. სელენი, აგრეთვე გვხვდება სამი სხვადასხვა ფორმით- მუქი წითელი ფერის მონოკლინურ კრისტალური, რომლებიც შედგება Se8 მოლეკულისაგან (გოგირდის ალოტროპიის მსგავსად). თუმცა, სელენის სიბლანტე არ იცვლება გაცხელებით, გოგირდისგან განსხვავებით.
იზოტოპები
სელენს გააჩნია ექვსი ბუნებრივი იზოტოპი, რომელთაგან სტაბილურია ხუთი: 74Se, 76Se, 77Se, 78Se და 80Se. ბოლო სამი იზოტოპი გვხვდება აგრეთვე , როგორც დაშლის პროდუქტი, რომელთა შორის 79Se-ის ნახევარდაშლის პერიოდია 327წელი. ბოლო ბუნებრივ იზოტოპს, რომელიც ბუნებაში გვხვდება - 82Se-ის ნახევარდაშლის პერიოდი ძალიან ხანგრძლივია (~ 1020 წელი, რომელიც 82Kr-ის დუბლ-ბეტა დაშლით მიიღება ). დახასიათებულია ოცდასამი დანარჩენი არასტაბილური იზოტოპი.
სელენის გარე ელექტრონული შრის კონფიგურაციაა 4S24P4.
ჯანმრთელობის ეფექტი და დიეტა
სელენი დიდი დოზირებით რადგანაც ტოქსიკურია, იგი ცხოველებისათვის აუცილებელია მიკრორაოდენობით. მცენარეებში იგი გვხვდება, როგორც ”მოწმე” - მაყურებელი მინერალი, ხანდახან საფურაჟე საკვებში ტოქსიკური პროპორციით (ზოგიერთ მცენარეს შეუძლია სელენის აკუმულირება და მას იყენებს რათა ცხოველებმა არ შეჭამონ, მაგრამ სხვა მცენარეები, როგორიცაა ზოგიერთი სარეველა, საჭიროებს სელენს და მათი ზრდის მაჩვენებელია ნიადაგში სელენის არსებობა). იგი არის ამინომჟავების, სელენოცისტეინის და სელენომეთიონინის შემადგენელი კომპონენტი. ადამიანებში, სელენი არის კვალის სახით, რომელიც ფუნქციონირებს როგორც კოფაქტორი ისეთი ანტიოქსიდანტ ენზიმებისათვის, როგორიცაა გლუტათიონპეროქსიდაზა და თიორედოქსინრედუქტაზას ზოგიერთი ფორმების აღდგენისათვის, რომლებიც ნაპოვნია ცხოველებში და ზოგიერთ მცენარეში (ეს ენზიმი გვხვდება ყველა ცოცხალ ორგანიზმში, მაგრამ არა ყველა მცენარეში, რომელსაც სჭირდება სელენი).
ქიმია
სელენი ნაერთებში წარმოქმნის ორ ოქსიდს: სელენის დიოქსიდსა (SeO2) და ტრიოქსიდს (SeO3). სელენის დიოქსიდი მიიღება ელემენტური სელენის ჟანგბადთან ურთიერთქმედებით:
Se8 + 8 O2 → 8 SeO2
ეს პოლიმერული ნაერთი, შემდგომ აირად ფაზაში წარმოქმნის მონომერული SeO2 - ის მოლეკულებს. იგი იხსნება წყალში სელენოვანი მჟავას H2SeO3-ის წარმოქმნით, რომელიც ასევე შეიძლება მივიღოთ ელემენტური სელენის აზოტმჟავით დაჟანგვით:
3 Se + 4 HNO3 → 3 H2SeO3 + 4 NO
სელენოვანი მჟავას მარილებს ეწოდება სელენიტები, რომელთა შორისაა ვერცხლის სელენიტი (Ag2SeO3) და ნატრიუმის სელენიტი (Na2SeO3). გოგირდწყალბადი ურთიერთქმედებს სელენოვანი მჟავას ხსნართან და წარმოქმნის სელენიუმდისულფიდს:
H2SeO3 + 2 H2S → SeS2 + 3 H2O
სელენის დისულფიდი შეიცავს გოგირდის რვაწევრიან რგოლებს, სადაც სელენით ჩანაცვლებულია გოგირდის ზოგიერთი ატომი. მას აქვს დაახლოებით SeS2- ის შედგენილობა, სადაც ზოგიერთი რგოლი შედგება Se4S4 და Se2S6-გან. მათ აქვთ სხვადასხვა გამოყენება, მათ შორის გამოიყენება შამპუნებში როგორც ქერტლის საწინააღმდეგო აგენტი, აგრეთვე პოლიმერულ ქიმიაში ინჰიბიტორად, მინის შესაღებად და აღმდგენ აგენტად ფეიერვერკებში. გოგირდისგან განსხვავებით (რომელიც წარმოქმნის სტაბილურ ტრიოქსიდს) სელენის ტრიოქსიდი არამდგრადია, იშლება დიოქსიდად 185oC:
2 SeO3 → 2 SeO2 + O2 (ΔH = −54 კჯ/მოლ)
სელენის ტრიოქსიდი შეიძლება სინთეზირებულ იქნას სელენმჟავას (H2SeO4) დეჰიდრატაციით, რომელიც თავისთავად წარმოიქმნება სელენის დიოქსიდის დაჟანგვით წყალბადის ზეჟანგის თანაობისას:
SeO2 + H2O2 → H2SeO4
ჰალოგენნაერთები. სელენი რეაგირებს ფტორთან და წარმოქმნის სელენიუმჰექსაფტორიდს.
Se8 + 24 F2 → 8SeF6
გოგირდის ანალოგიური ნაერთისაგან განსხვავებით (გოგირდჰექსაფტორიდისაგან) SeF6 უფრო რეაქციისუნარიანია. იგი ტოქსიკურია და აღიზიანებს ფილტვებს. მას შეუძლია გამოიწვიოს მოყინვა და კანის გახლეჩა.
სელენის სხვა ჰალოგენიდებია: SeF4, Se2Cl2, SeCl4, და Se2Br2. სელენდიქლორიდი (SeCl2) მნიშვნელოვანი რეაგენტია სელენის ქიმიაში. იგი შეიძლება მივიღოთ სელენის სუფთა ელემენტური ფორმის ურთიერთქმედებით SO2Cl2-თან ტეტრაჰიდროფურანის ხსნარში. სელენის ზოგიერთი ოქსიჰალოგენიდი, როგორიცაა SeOF2, გამოიყენება როგორც უწყლო გამხსნელი.
სელენიდები. გოგირდისა და ჟანგბადის მსგავსად, სელენი წარმოქმნის სელენიდებს მეტალებთან. მაგალითად, ალუმინთან ურთიერთქმედებით იგი წარმოქმნის ალუმინიუმსელენიდს.
3 Se8 + 16 Al → 8 Al2Se3
სხვა სელენიდები: ვერცხლისწყლის სელენიდი (HgSe), ტყვიის სელენიდი (PbSe) და თუთიის სელენიდი (ZnSe). მნიშვნელოვანი სელენიდია სპილენძ-ინდიუმ-გალიუმის სელენიდი (Cu(Ga,In)Se2), რომელიც წარმოადგენს ნახევარგამტარს.
სელენი უშუალოდ არ ურთიერთქმედებს წყალბადთან, მაგრამ სელენწყალბადი (გოგირდწყალბადის და წყლის ანალოგი), შეიძლება მიღებულ იქნას შემდეგნაირად- თავდაპირველად მეტალთან სელენის ურთიერთქმედებით მიიღება სელენიდი და შემდეგ კი მიმდინარეობს სელენიდანიონის პროტონირება მჟავით, რის შედეგადაც მიიღება H2Se.
სხვა ნაერთები. ტეტრასელენტეტრანიტრიდი (Se4N4) ფეთქებადი, ყვითელი ნაერთია, რომელიც წარმოადგენს S4N4 – ის ანალოგს. იგი შეიძლება მიღებულ იქნას SeCl4 -ის 78oC-ზე (Cu(Ga,In)Se2)-თან ურთიერთქმედებით დიქლორმეთანის ხსნარში.
სელენი რეაგირებს ციანიდებთან სელენციანატების წარმოქმნით. მაგ. :
8 KCN + Se8 → 8 KseCN
არაბიოლოგიური გამოყენება
ქიმიური გამოყენება
სელენი კატალიზატორად გამოიყენება ბევრ ქიმიურ რეაქციაში. იგი ფართოდ იხმარება მრეწველობაში და ლაბორატორიაში, განსაკუთრებით ორგანოსელენის ქიმიაში. იგი ასევე ფართოდ გამოიყენება პროტეინების და ნუკლეინმჟავების სტრუქტურების დასადგენად სხივების კრისტალოგრაფიაში.
სელენი ფართოდ გამოიყნება მინისა და კერამიკის წარმოებაში, მას უმატებენ მინის წითელი შეფერვის მისაცემად, ასევე გამოიყენება ჭიქური მინანქრების წარმოებაში.
სელენი ბისმუტთან ერთად გამოიყენება თითბერში. უფრო მეტად ტოქსიკური ტყვიის ჩასანაცვლებლად. სელენს ასევე იყენებენ ვულკანიზებული კაუჩუკის (რეზინის) მდგრადობის გასაუმჯობესებლად.
ელექტრონიკა. სელენის ფოტოელექტრული გამტარობის გამო, გამოყენება ჰპოვა ფოტოკოპირებაში, სინათლისა და მზის ელემენტებში და სხვა.
ბიოლოგიური გამოყენება
მედიცინაში. ნივთიერება, რომელსაც ეწოდება სენენსულფიდი (ფორმულა- SeS2 ), წარმოადგენს აქტიურ ინგრედიენტს ზოგიერთ შამპუნში ქერტლის საწინააღმდეგოდ. სელენის ნაერთები კლავენ ქავილის გამომწვევ სოკოებს ”malassezia”-ს, რომელიც ასევე იწვევს მშალი კანის ფრაგმენტის დასკდომას, აგრეთვე გამოიყენება ლოსიონებში ”Tinca versicda”-ს ტანის კანის დასამუშავებლად.
მკვებავი. სელენი მცირე დოზებით (50-დან 200 მიკროგრამამდე დღეში მოზრდილი ადამიანისთვის) ფართოდ გამოიყენება ვიტამინების წარმოებაში და სხვა დიეტურ დანამატებად. ზოგიერთი შინაური პირუტყვის საჭმელში სელენი შედის დანამატებად. ჩატარებული მრავალი კვლევის შედეგად დაადგინეს, რომ სელენის დანამატებმა, სხვა მკვებავებთან ერთად შეიძლება განმეორებითი ტუბერკულოზის პრევენციაც. ექსპერიმენტულმა კვლევებმა ასევე აჩვენა, რომ სელენს გააჩნია დაცვითი ეფექტი მეთილვერცხლისწყლის ტოქსიკურობის მიმართ.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით


