კრიპტონი
კრიპტონი (ბერძნულ. ”Kryptos” - ნიშნავს დაფარულს, დამალულს) წარმოადგენს ქიმიურ ელემენტს, რომლის სიმბოლოა Kr, ატომური ნომერი კი - 36. იგი პერიოდულ სისტემაში მდებარეობს 18 ჯგუფში და მეოთხე პერიოდში. კრიპტონი უფერო, უსუნო, უგემო კეთილშობილი აირია. იგი ატმოსფეროში გვხვდება კვალის სახით. მისი გამოყოფა თხევადი აირიდან ხდება ფრაქციული გამოხდით. სხვა იშვიათ აირებთან ერთად იგი ხშირად გამოიყენება ფლოურესცენცირებულ ნაერთებში.
კრიპტონს აგრეთვე შეუძლია წყალთან წარმოქმნას კლარტატები (ჰიდრატები, მაგალითად, Kr·6H2O), სადაც წყალში მოლეკულათშორისი მანძილები შევსებულია აირის მოლეკულებით. კლარტატები წარმოადგენენ არამდგრად ნაერთებს და მათ არსებობა შეუძლიათ შედარებით დაბალ ტემპერატურაზე. კრიპტონის ატომების მიერ კრისტალჰიდრატის წარმოქმნა იმის მაჩვენებელია, რომ მათ აქვთ პოლარიზაციის უნარი.

სერ ვილიამ რამზაი.
კრიპტონის აღმომჩენი
ისტორია
კრიპტონი აღმოჩენილია ბრიტანეთში 1898 წელს უ. რამზეის (შოტლანდიელი ქიმიკოსი) და მ. ტრავერის (ინგლისელი ქიმიკოსის) მიერ თხევადი აირის შემადგენელი კომპონენტების აორთქლების შემდეგ დარჩენილ ნაშთში. იმავე მეცნიერების მიერ, რამდენიმე კვირის მოგვიანებით, მსგავსი პროცედურებით აღმოჩენილ იქნა ნეონიც. 1904 წელს უ. რამზეის მიანიჭეს ნობელის პრემია კეთილშობილი აირების სერიის აღმოჩენისათვის.
გავრცელება
დედამიწის ქერქში (ლითოსფეროსა და ატმოსფეროს ჩათვლით) კრიპტონის შემცველობა შეადგენს 1.9×10-8 %. იგი შეიძლება მივიღოთ თხევადი ჰაერის ფრაქციული გამოხდით. კრიპტონის რაოდენობა სივრცეში დამოკიდებულია მეტეორულ აქტივობასა და მზის ქარებზე.
იზოტოპები
ბუნებრივი კრიპტონი გვხვდება ექვსი სტაბილური იზოტოპის სახით. გარდა ამისა, ცნობილია მისი ოცდაათამდე არასტაბილური იზოტოპი. 81Kr - ატმოსფერული პროცესების პროდუქტი, წარმოიქმნება კრიპტონის გავრცელებული ბუნებრივი იზოტოპებისაგან. Kr რადიოაქტიურია, მისი ნახევარდაშლის პერიოდია 230 000 წელი. ბუნებრივ წყლებთან არსებული კრიპტონი ძლიერ აქროლადია. 81Kr შეიძლება გამოყენებულ იქნას მიწისქვეშა წყლების ასაკის დასადგენად (50 000 – 800 000 წელი).
85Kr წარმოადგენს რადიოაქტიურ კეთილშობილ აირს, ნახევარდაშლის პერიოდით 10.76 წელი. იგი წარმოიქმნება ბირთვულ რეაქციებში ურანისა და პლუტონიუმის დასლის შედეგად.
ფიზიკური თვისებები
კრიპტონი ხასიათდება მკვეთრი, მწვანე და ყვითელი ხაზის გამოყოფით (სპექტრალური ხელწერა). იგი წარმოადგენს ურანის დაშლის ერთ-ერთ პროდუქტს. მყარი კრიპტონი თეთრია, კუბური კრისტალური სტრუქტურით, რომელიც წარმოადგენს ყველა კეთილშობილი აირისათვის საერთო თვისებას.
ქიმიური თვისებები
სხვა კეთილშობილი აირების მსგავსად, კრიპტონიც ქიმიურად არააქტიურია. ქსენონის ნაერთების პირველი წარმატებული სინთეზი განხორციელებულ იქნა 1962 წელს, ხოლო 1963 წელს მიიღეს კრიპტონის დისულფიდი (KrS2). გამოკვლეულ იქნა პოლიატომური იონები ArKr+ და KrH+ და იგი დადასტურდა KrXe da KrXe+-თვის.
აღმოჩენილ იქნა ნაერთები, რომელშიც კრიპტონი დაკავშირებულია ფთორის ატომებთან. KrF2-სა და B(OTeF5)3-ს შორის რეაქციის შედეგად მიიღება არამდგრადი ნაერთი Kr(OTeF5)2, რომელიც შეიცავს კრიპტონ-ჟანგბადის ბმას.
კრიპტონ-აზოტის კავშირი აღმოჩენილ იქნა [HC≡N–Kr–F]+ კატიონში, რომელიც მიიღება KrF2-ის ურთიერთქმედებით [HC≡NH]+[AsF−6]-თან −50 °C-ზე დაბალ ტემპერატურაზე.
ფინეთში, ჰელსინკის უნივერსიტეტში ნაჩვენები იქნა, რომ HKrCN და HKrC≡CH (კრიპტონჰიდრიდციანიდი და ჰიდროკრიპტოაცეტილენი) მდგრადია 40 K-ზე მაღალ ტემპერატურაზე.
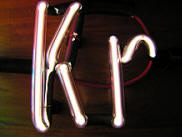
კრიპტონის ნათურა
გამოყენება
კრიპტონოსაგან გამოყოფილი მრავალი სპექტრალური ხაზი იწვევს მის იონიზაციას, რაც საშუალებას იძლევა იგი გამოყენებულ იქნას ფოტოგრაფიაში, როგორც ბრილიანტის თეთრის ნათების წყარო. კრიპტონი, სხვა აირებთან ერთად იძლევა კაშკაშა მომწვანო-ყვითელ ნათებას.
კრიპტონს არგონთან ერთად იყენებენ ფლუორესცენციული ნათურების შესავსებად (კრიპტონი 100-ჯერ უფრო ძვირია, ვიდრე არგონი). კრიპტონი ქსენონთან ერთად გამოიყენება გავარვარებული ნათურების შესავსებად. კრიპტონი ასრულებს მნიშვნელოვან როლს კრიპტონ-ფთორიდის ლაზერის მიღებასა და გამოყენებაში.
ექსპერიმენტულ ფიზიკაში თხევადი კრიპტონი გამოიყენება კვაზი-ჰომიგენური ელექტრომაგნიტური კალორიმეტრის მისაღებად. ამის მაგალითია NAM48-ის ექსპერიმენტი CERN-ში, რომელიც შეიცავს დაახლოებით 27 ტონა თხევად კრიპტონს. კრიპტონ-83 გამოყენება ჰპოვა (MRI) - მაგნიტურ რეზონანსულ ასახბაში (გამოსახულება), კერძოდ იგი გამოიყენება ჰიდროფილური და ჰიდროფობური ზედაპირების გასასხვავებლად, რომელსაც მოიცავს აირის სივრცე.
ბიოლოგიური როლი
კრიპტონი ითვლება არატოქსიკურ ასფიქსიენტად. მისი ნარკოზული პოტენციალი შვიდჯერ მეტია, ვიდრე ჰაერისა. ამიტომაც 50% კრიპტონისა და 50% ჰაერის შესუნთქვა იწვევს ნარკოზს, რომელიც მსგავსია ოთხ ატმოსფერულ წნევაზე ჰაერის შესუნთქვის.
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით



