| წინა ელემენტი |
|
შემდეგი ელემენტი |
სახე

მოვერცხლისფრო-მონაცრისფრო-თეთრი მეტალური
ძირითადი თვისებები
| დასახელება, სიმბოლო, ნომერი |
ტიტანი, Ti, 22 |
| წარმოთქმა |
|
| ელემენტის კატეგორია |
გარდამავალი მეტალი |
| ჯგუფი, პერიოდი, ბლოკი |
4, 4, d |
| ატომური მასა |
47.867(1) გ მოლი-1 |
| ელექტრონული კონფიგურაცია |
[Ar] 3d2 4s2 |
| ელექტრონები ორბიტალებზე |
2, 8, 10, 2 |
ფიზიკური თვისებები
| აგრეგატული მდგომარეობა |
მყარი |
| სიმკვრივე |
4.506 გ სმ-3 |
| სიმკვრივე თხევად მგდომარეობაში (ლღობის ტემპერატურაზე) |
4.11 გ სმ-3 |
| ლღობის ტემპერატურა |
1941 K, 1668˚C |
| დუღილის ტემპერატურა |
3560 K, 3287 ˚C, 5949 ˚F |
| კრიტიკული წერტილი |
|
| დნობის სითბო |
14.15 კჯ მოლი-1 |
| აორთქლების სითბო |
425 კჯ მოლი-1 |
| სპეციალური სითბოტევადობა |
(25 ˚C) |
| ორთლის წნევა | ||||||||||||||
|
ატომური თვისებები
| ჟანგვითი რიცხვები |
4, 3, 2, 1 |
| ელექტროუარყოფითობა |
1.54 (პოლინგის შკალა) |
| იონიზაციის ენერგიები |
I: 658.8 კჯმოლი-1 |
| ატომური რადიუსი |
147 pm |
| კოვანელტური რადიუსი |
160±8 pm |
| ვან დერ ვაალსის რადიუსი |
___pm |
სხვადასხვა
| კრისტალური სტრუქტურა |
ჰექსაგონალური |
| მაგნიტური მოწესრიგებულობა |
პარამაგნიტური |
| კუთრი ელექტრული წინაღობა |
(20˚C) 0.420ნΏ მ |
| სითბოგამტარობა |
(300 K) 21.9 ვტმ-1K-1 |
| სითბოგადაცემა |
(25˚C) 8.6 µm m-1K-1 |
| ბგერის სიჩქარე |
(20˚C) 5,090 მ/წმ |
| იუნგის მოდული |
116 გპა |
| შერის მოდული |
44 გპა |
| ბულკის მოდული |
110 გპა |
| სიმტკიცე მოსის მიხედვით |
6.0 |
| CAS-ის რეფისტრაციის ნომერი |
7440-32-6 |
მდგრადი იზოტოპები
| იზოტოპი | NA | ნახევარ-სიცოცხლე | DM | DE(MeV) | DP |
| 44Ti | სინთ | 63 y | ε | - | 44Sc |
| γ | 0.07D, 0.08D | - | |||
| 46Ti | 8.0% | 46Ti მდგრადია 24 ნეიტრონით | |||
| 47Ti | 7.3% | 47Ti მდგრადია25 ნეიტრონით | |||
| 48Ti | 73.8% | 48Ti მდგრადია 26 ნეიტრონით | |||
| 49Ti | 5.5% | 49Ti მდგრადია27 ნეიტრონით | |||
| 50Ti | 5.4% | 50Ti მდგრადია 28 ნეიტრონით | |||
ტიტანი
ტიტანი წარმოადგენს ქიმიურ ელემენტს, რომლის სიმბოლოა Ti, ხოლო ატომური ნომერი 22. ზოგჯერ მას უწოდებენ გარდამავალ მეტალს. მას აქვს დაბალი სიმკვრივე და მაგარია, აქვს კრიალა, ვერცხლისფერი ზედაპირი, არის კოროზიისადმი მედეგი (ზღვის წყლის, სამეფო წყლის და ქლორის ჩათვლით).
ტიტანი აღმოჩენილ იქნა 1791 წელს ინგლისში უ. გრეგორის მიერ, ხოლო სახელი ტიტანი დაერქვა ჰ. კლაპროტის მიერ ბერძნული მითოლოგიის მიხედვით.
ტიტანი გვხვდება მინერალებში: რუტილი (TiO2) და ილმენიტი (FeTiO3), რომელიც ფართოდაა გავრცელებული დედამიწის ქერქში და ლოთოსფეროში. იგი აგრეთვე გვხვდება თითქმის ყველა ცოცხალ ორგანიზმში, წყალმცენარეებში, ქვის ქანებში და მტვერში. იგი მინერალებიდან გამოიყოფა ექსტრაქციით. ტიტანის დიოქსიდი ყველაზე გავრცელებული ნაერთია, რომელიც პოპულარულია ფოტოკატალიზში და გამოიყენება თეთრი პიგმენტების წარმოებაში. სხვა ნაერთები როგორიცაა ტეტრაქლორტიტანი ((TiCl4), რომელიც შედის კვამლის საფარში და გამოიყენება კატალიზატორად. სამქლორიანი ტიტანი (TiCl3)- გამოიყენება პროპილენის წარმოებაში - კატალიზატორად.
მაღალი კოროზიამედეგობის გამო ტიტანი წარმოადგენს შესანიშნავ მასალას ქიმიური აპარატურის დასამზადებლად. მაღალი თერმომდგრადობით ხასიათდება როგორც ტიტანი, ასევე მისი შენადნობები ალუმინთან და სხვა მეტალებთან.მაღალ ტემპერატურაზე ეს შენადნობები ინარჩუნებენ მექანიკურ თვისებებს, რის გამოც მათ იყენებენ თვითმფრინავის და სარაკეტო მშენებლობაში. ტიტანი ცოტათი მძიმეა ალუმინზე, ამის გამო ტიტანს და მის შენადნობებს იყენებენ მანქანათმშენებლობაში, შიგა წვის ძრავების დასამზადებლად, რაც ამ ძრავების მასას ამცირებს 30%-ით.
მაღალ ტემპერატურაზე ტიტანი უერთდება ჰალოგენებს, ჟანგბადს, გოგირდს, აზოტს და სხვა ელემენტებს. ამას ემატება ტიტანის რკინასთან შენადნობის (ფეროტიტანის) მიღება, რომელსაც უმატებენ ფოლადს. ტიტანი უერთდება გამლღვალ ფოლადში არსებულ აზოტსა და ჟანგბადს, ფოლადის გამყარების დროს ეს უკანასკნელნი არ გამოიყოფიან და ამიტომაც ერთგვაროვანი ფოლადი მიიღება. ტიტანი ნახშირბადთან შეერთებისას იძლევა კარბიდს. ტიტან-ვანადიუმის კარბიდზე კობალტის დამატებით მიიღება ნალღობი, რომელიც სიმაგრით უახლოვდება ალმასს.
ტიტანის თვისებებში აღსანიშნავია ის, რომ ნებისმიერ მეტალთან შედარებით აქვს უკეთესი კოროზიამედეგობა და არის გამძლე. ტიტანი ფოლადზე უფრო მტკიცეა და ამავე დროს მასზე 45%-ით უფრო მსუბუქია. არსებობს ტიტანის ორი ალოტროპიული ფორმა და ხუთი ბუნებრივი იზოტოპი. 46Ti , 48Ti და 50Ti არიან უფრო მეტად გავრცელებული იზოტოპები (73.8%). ტიტანი როგორც ქიმიური, ისე ფიზიკური თვისებებით ცირკონიუმის მსგავსია.
ფიზიკური თვისებები
მეტალური ტიტანი ცნობილია თავისი მაღალი გამძლეობით და დაბალი სიმკვრივით. იგი ადვილად დასამუშავებელი მეტალია, განსაკუთრებით უჟანგბადო არეში. იგი ვერცხლისებური-თეთრი მბრწყინავი ლითონია, ფხაჭნის კვარცს. შედარებით მაღალი ლღობის ტემპერატურის (1650°C ან 3000°C) გამო იგი ცეცხლგამძლე მეტალია. ტიტანი პარამაგნიტურია და აქვს ძალიან დაბალი ელექტრო და თერმული გამტარობა.
კომერციული ტიტანის (99.2% სისუფთავით) გაჭიმვის გამძლეობის ზღვარია დაახლოებით 434მპა, რომელიც ტოლია ამავე მონაცემის ფოლადის შენადნობისათვის, მაშინ როდესაც ტიტანი 45%-ით მსუბუქია ფოლადზე.
ტიტანი წარმოადგენს დიმორფულ ალოტროპს, რომლის ჰექსაგონალური a-ფორმა გადადის მოცულობით ცენტრიდანულ კუბურ ფორმაში 882 °C (1620°F). a-Ti და b-Ti ფორმების სიმკვრივეა 4.505 და 4.32 გ/სმ3 შესაბამისად.
იზოტოპები
ბუნებაში ტიტანი გვხვდება ხუთი სტაბილური იზოტოპის სახით: 46Ti, 47Ti, 48Ti, 49Ti, 48Ti და 50Ti , რომელთაგან მეტად გავრცელებულია 48Ti (73.8%). შეიძლება დავახასიათოთ ტიტანის თერთმეტი რადიოიზოტოპი, რომელთაგან ყველაზე სტაბილური 44Ti-ის ნახევარდაშლის პერიოდია 63 წელი, 45Ti-ის ნახევარდაშლის პერიოდია 184.8 წუთი, 51Ti-ის ნახევარდაშლის პერიოდია 5.76 წუთი, 52Ti-ის ნახევარდაშლის პერიოდია 1.7 წუთი. ყველა დანარჩენი რადიოაქტიური იზოტოპის ნახევარდაშლის პერიოდია 33წმ, მათ შორისაა იზოტოპი, ნახევარდაშლის პერიოდით წამის ნახევარზე ნაკლები.
ისტორია

მარტინ ჰეინრიხ კლაპროთი
(Martin Heinrich Klaproth)
მიერ იქნა შერქმეული სახელი ტიტანი ბერძნული მითოლოგიური პერსონაჟის მიხედვით named titanium for the Titans of Greek mythology.
ტიტანი აღმოჩენილ იქნა ინგლისში 1791 წელს (მინერალში) მოყვარული გეოლოგისა და პასტორის უ. გრეგორის მიერ (შემდგომში გახდა ეკლესიის მოძღვარი). მან აღმოაჩინა ახალი ელემენტის არსებობა მინერალ ილემინიტში, როდესაც ნახა, რომ ეკლესიის მისასვლელთან არსებული ქვიშა მიიზიდებოდა მაგნიტით. ქვიშის ქიმიურმა ანალიზმა უჩვენა ორი მეტალის ოქსიდის არსებობა - რკინის ოქსიდისა (რითაც აიხსნებოდა მაგნიტით მიზიდვა) და 45.25% თეთრი მეტალური ოქსიდი, რომლის იდენტიფიკაციაც მან ვერ შეძლო. უ.გრეგორიმ ამ მონაცემების შესახებ აცნობა ინგლისის სამეფო გეოლოგიურ საზოგადოებას და გერმანიის სამეცნიერო ჟურნალ ”Crell's Annalen” -ს. თითქმის ამავე პერიოდში ფ. მიულერმა მიიღო მსგავსი ნივთიერება, მაგრამ ვერ შეძლო მისი იდენტიფიკაცია. თეთრი ოქსიდი იდენტიფიცირებულ იქნა 1795 წელს გერმანელი ქიმიკოსის მ.ჰ. კლაპროტის მიერ საბადო რუტილში (უნგრეთი). მ.კლაპროტმა აღმოაჩინა, რომ იგი შეიცავდა ახალ ელემენტს, რომელსაც მან ბერძნული მითოლოგიის მიხედვით უწოდა ტიტანი. მას შემდეგ რაც გაიგო უ.გრეგორის ადრინდელი აღმოჩენის ამბავი, კლაპროტმა მიიღო მანასანიტის ნიმუში და დაამტკიცა, რომ იგი შეიცავდა ტიტანს.
პროცესი მოითხოვდა ტიტანის ექსტრაქციას სხვადასხვა მადნებიდან, რომელიც საკმაოდ შრომატევადია და ხარჯებთანაა დაკავშირებული. ტიტანის აღდგენა ნახშირბადით ნორმალურ პირობებში იყო შეუძლებელი, რადგანაც ამ დროს წარმოიქმნებოდა ტიტანის კარბიდი. სუფთა მეტალური ტიტანი (99.9%), პირველად მიღებულ იქნა 1910 წელს მ. ჰანთერის მიერ. ოთხქლორიანი ტიტანის (TiCl4) ნატრიუმთან გაცხელებით, 700-800°C (ჰანთერის პროცესი), მაგრამ იმ დროისათვის მეტალური ტიტანი მხოლოდ ლაბორატორიაში გამოიყენებოდა 1932 წლამდე, როდესაც უ. კროლმა აღმოაჩინა, რომ ტიტანის მიღება შეიძლება ტეტრაქლორტიტანის (TiCl4) კალციუმით აღდგენით.რვა წლის შემდეგ ეს პროცესი დაიხვეწა და აღმდგენელად გამოიყენებოდა მაგნიუმი და ნატრიუმი. კროლის ცნობილი პროცესიდან შემდგომ კვლევა გაგრძელდა უფრო ეფექტური და იაფი პროცესის მისაღწევად, მაგრამ კროლის პროცესი დღემდე გამოიყენება კომერციული ტიტანის მისაღებად.
ქიმიური თვისებები
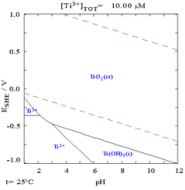
პურბეს (პოტენციალების) დიაგრამა ტიტანისათვის სუფთა წყალში, პერქლორმჟავასა და ნატრიუმის ჰიდროქსიდში
ტიტანის ყველაზე მნიშვნელოვანი ქიმიური თვისებაა მისი კოროზიამედეგობა, იგი თითქმის მსგავსია პლატინის, რომელიც არ ურთიერთქმედებს განზავებულ გოგირდმჟავასთან და ქლორწყალბადმჟავასთან, ასევე აირად ქლორთან, ქლორიდების ხსნარებთან და ორგანული მჟავების უმეტესობასთან, მაგრამ იგი იხსნება მჟავათა კონცენტრირებულ ხსნარებში. ტიტანი ნელა ურთიერთქმედებს წყალთან და ჰაერთან, რადგანაც იგი წარმოქმნის პასიურ, ოქსიდურ ფენას, რომელიც იცავს მას შემდგომი რეაქციისაგან. ჰაერზე ტემპერატურის გაზრდის შემთხვევაში ტიტანი სწრაფად რეაგირებს ჟანგბადთან.
ტიტანი 1200°C (2190°F) იწვის ჰაერზე, ხოლო 610°C (1130°F)- სუფთა ჟანგბადში და წარმოქმნის ტიტანის დიოქსიდს. ამის გამოა, რომ ტიტანის გალღობა ღია ჰაერზე ვერ ხერხდება, რადგან იგი გალღობის ტემპერატურის მიღწევამდე იწვის. მისი გალღობა შესაძლებელია მხოლოდ ინერტულ გარემოში ან ვაკუუმში. 550 °C (1022 °F) იგი უერთდება ქლორს. იგი აგრეთვე რეაგირებს სხვა ჰალოგენებთან, ასევე შთანთქავს წყალბადს. ტიტანი სუფთა აზოტში იწვის 800 °C (1470°F) და წარმოქმნის ნიტრიდს, რომელიც ხასიათდება სიმყიფით. ტიტანი ასევე უერთდება ნახშირბადს და სილიციუმს და შესაბამისად წარმოქმნის კარბიდს (TiC) და სილიციდს (TiSi2). ექსპერიმენტმა აჩვენა, რომ ბუნებრივი ტიტანი ხდება რადიოაქტიური მისი დეიტერონით დაბომბვისას. ამ დროს იგი ძირითადად გამოყოფს პოზიტრონებს და მძიმე გამა სხივებს.
ნაერთები
ტიტანის ქიმიაში დომინირებს +4 დაჟანგულობის ხარისხი, მაგრამ ცნობილია ნაერთები, რომლებშიც იგი ამჟღავნებს +3 დაჟანგულობის ხარისხს. ამ მაღალი დაჟანგულობის ხარისხის გამო მის ბევრ ნაერთს უნარი აქვს წარმოქმნას კოვალენტური ბმები.
ტიტანატები მიიღება ტიტანის დიოქსიდისაგან. ბარიუმის ტიტანატს გააჩნია პიეზოელექტრული თვისებები, რაც შესაძლებლობას იძლევა იგი გამოყენებულ იქნას ბგერისა და ელექტრობის ურთიერთგადასვლის დროს როგორც გარდამქმნელი. ტიტანის რთული ესტერები მიიღება სპირტების ურთიერთქმედებით ტეტრაქლორტიტანთან. ისინი გამოიყენებიან წყალგაუმტარი ფაბრიკატების დასამზადებლად.
ტიტანის ნიტრიდის (TiN) სიმაგრე უტოლდება საფირონისა და კარბორუმდის სიმაგრეს (9.0 მოხის შკალის მიხედვით). იგი გამოიყენება საბურღავ ინსტრუმენტებში. მან გამოყენება ჰპოვა აგრეთვე ოქროსფერი დეკორატიული აპარატურებისათვის და როგორც მეტალური ბარიერი ნახევარგამტარების წარმოებაში. ტიტანისტეტრაქლორიდი (TiCl4) წარმოადგენს უფერო სითხეს, რომელიც როგორც შუალედური პროდუქტი გამოიყენება ტიტანის დიოქსიდის მისაღებად. ტიტანი ასევე წარმოქმნის ტიტან (III) ქლორიდს (TiCl3), რომელიც გამოიყენება აღმდგენელ აგენტად.
გავრცელება
ტიტანის ოქსიდის წარმოება 2003 წლისათვის (ათასი ტონა)
| მწარმოებელი | წარმოება | მთლიანი % |
| ავსტრალია | 1291.0 | 30.6 |
| სამხრეთ აფრიკა | 850.0 | 20.1 |
| კანადა | 767.0 | 18.2 |
| ნორვეგია | 382.9 | 9.1 |
| უკრაინა | 357.0 | 8.5 |
| სხვა ქვეყნები | 573.1 | 13.6 |
| მთლიანად მსოფლიო | 4221.0 | 100.0 |
ტიტანის შემცველობა დედამიწის ქერქში შეადგენს 0.63% მასის მიხედვით. იგი მეშვიდე ელემენტია დედამიწაზე გავრცელების მიხედვით, მაგრამ ტიტანი მიეკუთვნება განბნეული ელემენტების რიცხვს - გვხვდება სხვადასხვა ელემენტებთან ერთად. ტიტანი გვხვდება ვულკანური წარმოშობის ქანებში, წყლის ცოცხალ ორგანიზმებში. აშშ-ის გეოლოგიურმა გაერთიანებამ ჩაატარა 801 ვულკანური ქანის ანალიზი, აქედან 784 შეიცავდა ტიტანს. მისი წილი ნიადაგში დაახლოებით 0.5-დან 1.5%-მდეა.
ტიტანი ფართოდაა გავრცელებული და ძირითადად გვხვდება შემდეგ მინერალებში: ანათაზი, ბრუკიტი, ილუმინიტი, პეროვსკიტი, რუთილი, ტიტანიტი (სავენი) და სხვა მრავალ რკინის მადნებში. ამ მინერალებიდან მხოლოდ რუთილს და ილუმინიტს აქვთ ეკონომიური მნიშვნელობა, მაგრამ ჯერ კიდევ ძნელია მათი მოპოვება დიდი კონცენტრაციით. ტიტანის შემცველი ილუმინიტის მნიშვნელოვანი დეპოზიტი არის დასავლეთ ავსტრალიაში, კანადაში, ჩინეთში, ინდოეთში, ახალ ზელანდიაში, ნორვეგიასა და უკრაინაში. რუთილი დიდი რაოდენობით გვხვდება ჩრდილოეთ ამერიკაში, სამხრეთ აფრიკაში, რაც ხელს უწყობს მეტალის (90 000 ტონა) და ტიტანის დიოქსიდის (43 მილიონი ტონა) ყოველწლიურ წარმოებას. ტიტანის საერთო სარეზერვო მარაგი წარმოადგენს დაახლოებით 600 მილიონ ტონას.
ტიტანს შეიცავს მეტეორიტები და მისი აღმოჩენა შეიძლება მზეზე და M-ტიპის ვარსკვლავებზეც. ყველაზე ცივი ვარსკვლავის ზედაპირის ტემპერატურაა 3 200 °C (5 790°F).
მიღება და წარმოება

TiN-ით დაფარული სვერლო
მეტალური ტიტანის მიღება მოიცავს ოთხ ძირითად საფეხურს. ტიტანის საბადოს აღდგენა „ღრუბლის“ ფორმაში ანუ ფოროვან ფორმაში, შემდეგ ხდება ამ ფოროვანი ფორმის გალღობა და ფოროვანო ფორმისაგან შენალღობის წარმოქმნა. პირველადი წარმოება როდესაც ნალღობი გარდაიქმნება ქარხნულ პროდუქტად, როგორიცაა: სახრახნი, შტანგა, მეტალის ფურცლები, საიალქნე ბაგირები, მილები და საქარხნო პროდუქტების მეორადი წარმოება.
რადგანაც მეტალი რეაგირებს ჟანგბადთან მაღალ ტემპერატურაზე, არ შეიძლება მისი მიღება დიოქსიდის აღდგენით. კომერციული ტიტანი მიიღება კროლის პროცესით, სადაც პირველ რიგში ოქსიდი გარდაიქმნება ქლორიდად კარბოქლორირებით, სადაც აირადი ქლორი გაივლის ცხელ რუთილში ან ილმენიტში ნახშირბადის თანაობისას და წარმოიქმნება ოთხქლორიანი ტიტანი (TiCl4). იგი კონდენსირდება და სუფთავდება ფრაქციული გამოხდით და შემდგომ აღდგება 800 °C ტემპერატურა გამლღვალი მაგნიუმით არგონის არეში.
შედარებით ახალმა მეთოდმა - FFC Cambridge პროცესმა ჩაანაცვლა კროლის პროცესი. ამ პროცესში გამოყენებულია ტიტანდიოქსიდის ფხვნილი, რომელიც მიიღება რუთილის, როგორც საწყისი ნედლეულის დაქუცმაცებით. ფხვნილისებრი ან ფოროვანი საბოლოო პროდუქტის მისაღებად FFC Cambridge - პროცესი საშუალებას იძლევა ტიტანისაგან მივიღოთ ძვირფასი მასალა რეაქტიული თვითმფრინავების ინდუსტრიისათვის და სხვა ძვირფასი საგნების დასამზადებლად. ზოგადად ტიტანის შენადნობი მიიღება აღდგენით. მაგალითად, კუპროტიტანის (რუთილზე სპილენძის დანამატი და აღდგენა), ფეროკარბონტიტანის (ილმენიტის აღდგენა კოქსით ელექტროღუმელებში) და მაგნიტოტიტანის (რუთილი მანგანუმთან ან მანგანუმის ოქსიდთან) აღდგენით.
2 FeTiO3 + 7 Cl2 + 6 C → 2 TiCl4 + 2 FeCl3 + 6 CO (900 °C)
TiCl4 + 2 Mg → 2 MgCl2 + Ti (1100 °C)
გამოყენება
ტიტანი გამოიყენება ფოლადში, როგორც შესალღობი ელემენტი (ფერო-ტიტანი), რომელიც ამცირებს კრისტალის ზომას და ასევე წარმოადგენს განმჟანგველს და უჯანგავ ფოლადში ამცირებს ნახშირბადის შემცველობას. ტიტანს ხშირად ალღობენ ალუმინთან, ვანადიუმთან, მოლიბდენთან და სხვა მეტალებთან. ფხვნილისებრი ტიტანი გამოიყენება პიროტექნიკაში.
ნიადაგიდან ხდება 95%-მდე ტიტანის საბადოების ექსტრაგირება, რომელიც გასუფთავების შემდეგ გამოიყოფა ტიტანის დიოქსიდის (TiO2) სახით, რომელსაც თეთრი პიგმენტების სახით იყენებენ სამხატვრო საქმეში, ქაღალდის წარმოებაში, კბილის პასტებში და პლასტიკატების წარმოებაში. იგი აგრეთვე გამოიყენება ცემენტში, ძვირფას ქვებში და თევზსაჭერი ანკესების შემადგენელი გრაფიტის გამამგრებელ აგენტად. ტიტანის ორჟანგი აგრეთვე გამოიყენება ნატან-ციგლერის კატალიზში.
ტიტანმა გამოყენება ჰპოვა აგრეთვე არქიტექტურაშიც. მოსკოვში, პირველი კოსმონავტის - იური გაგარინის 40 მ (120 ფუტი) სიმაღლის მემორიალი გაკეთებულია ტიტანისაგან, სადაც მეტალის მიმზიდველი ფერი შეხამებულია სარაკეტო ტექნიკასთან. ბილბაოს გუგენჰემის მუზეუმი და სერიტოს ათასწლეულის ბიბლიოთეკის შენობები შესაბამისად ევროპასა და ჩრდილოეთ ამერიკაში შეფუთულია ტიტანის პანელებით. ტიტანი გამოიყენება ცეცხლსასროლი იარაღების პისტოლეტების და რევოლვერების ცილინდრის კარკასის წარმოებაში. იგი აგრეთვე გამოიყენება ლეპტოპ-კომპიუტერების ძირითად ნაწილში.
რადგანაც ტიტანი ბიოშეთავსებადია (იგი არატოქსიკურია), მან გამოყენება ჰპოვა მედიცინაში, მათ შორის ქირურგიული ინსტრუმენტების წარმოებაში. ტიტანის მასალით ხდება თეძოს ძვლისა და ბუდის (შეერთების ადგილას) ჩანაცვლება, რომელსაც ადგილზე შეუძლია გაძლოს 20 წელზე მეტი. ხშირად ამ დროს გამოიყენება ტიტანი შელღობილი 4% ან 6% ალუმინთან და 4% ვანადიუმთან.
_oxide.jpg)
ტიტანის დიოქსიდი არის ერთ-ერთეი ყველაზე მეტად გამოყენებული ნაერთი.

"ხარისხი 2" სისუფთავის ტიტანის ცილინდრი
მასალა მომზადებულია www.wikipedia.com -ის მიხედვით


